鉴别口蹄疫病毒O型、A型、AsiaⅠ型三重RT-PCR检测方法的建立
马震原, 闫若潜, 赵雪丽, 谢彩华, 曹伟伟, 王淑娟, 王东方, 王华俊, 王 翠
(河南省动物疫病预防控制中心, 河南郑州450008)
口蹄疫(Foot-and-mouth disease,FMD) 是由口蹄疫病毒(Foot-and-mouth disease virus,FMDV)引起的以偶蹄动物感染为主的急性、热性、高度接触性传染病[1]。该病传播快,传染性强,暴发时可给世界范围畜牧业造成严重危害。因此,世界动物卫生组织(OIE) 将其列为法定报告动物疫病的首位[2]。我国也将其列为一类重大动物疫病。FMDV病原变异大,现已发现有7个血清型[3],而我国主要受O、A型及AsiaⅠ型3种血清型的威胁[4]。FMDV各血清型之间无交叉免疫性,同一血清型内的不同亚型之间也只有部分有交叉免疫性[5]。因此,对FMDV的快速检测及血清型鉴定是有效控制该病流行的关键。
不同血清型FMDV感染的临床症状难以被区分,传统的检测方法很难准确判断[6-7]。目前,常用于FMDV检测的主要方法为酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA) 和分子生物学检测方法等。而ELISA目前只能用于评价口蹄疫单一血清型的抗体水平[8-9],无法实现对不同血清型抗原进行鉴别检测。普通RT-PCR方法具有快速、特异、敏感等优点,不依赖于价格昂贵的仪器,可在基层疫病病原学检测中广泛实践应用。本试验针对O型、A型与AsiaⅠ型3种血清型设计特异性引物,建立FMDV O型、A型与AsiaⅠ型三重RT-PCR检测方法,直接对3种血清型进行鉴定,方法快速、特异、准确,为临床中有效准确地对FMDV快速分型提供有力的技术支持。
1 材料与方法
1.1 毒株 经灭活的FMDV O型、A型和AsiaⅠ型标准株细胞培养物,购自国内某单位生产的口蹄疫检测试剂盒;经灭活的猪水疱病病毒(SVDV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪伪狂犬病病毒(PRV)、猪细小病毒(PPV)、猪附红细胞体(Eperythrozoonsuis)及猪弓形虫(Toxoplasmosis)等毒株及正常BHK-21细胞株,均由河南省动物疫病预防控制中心提供。
1.2 仪器和试剂 PCR扩增仪,德国Biomotra公司产品;Kingfishier全自动核酸提取仪,美国Thermo Fisher公司产品;凝胶成像分析系统,美国AIpha Innotech 公司产品;恒温水浴振荡器(HZQ-Q),哈尔滨东联电子技术开发有限公司产品;台式高速冷冻离心机,美国Heraeus公司产品;ExTaqDNA聚合酶、dNTPs、DNA回收试剂盒等,均购自宝生物工程(大连)有限公司;pGEM-T Easy载体、JM109感受态细胞,均购自Promega公司。
1.3 引物设计与合成 以FMDV O型、A型和AsiaⅠ型均高度保守的2B基因为模板设计反转录引物P0,根据VP1基因设计3对特异性引物,分别命名为P1/P2、P3/P4、P5/P6,由宝生物工程(大连)有限公司合成,扩增出的片段大小分别为234 bp、326 bp和467 bp。
1.4 样品核酸的提取和反转录 磁珠法提取经灭活的FMDV O型、A型和AsiaⅠ型标准株细胞培养物、正常BHK-21细胞、SVDV、PRRSV、CSFV 样品的总RNA和PRV、PPV、Eperythrozoonsuis、Toxoplasmosis样品的总DNA。提取样本总RNA经反转录后,其cDNA置于-20 ℃冻存备用。
1.5 PCR扩增及测序 通过对PCR反应体系及反应条件的优化,以经灭活的FMDV O型、A型和AsiaⅠ型标准株细胞培养物等量混合物cDNA为模板进行三重RT-PCR扩增,同时设正常BHK-21细胞cDNA 为阴性对照。PCR产物经电泳鉴定后克隆入pGEM-T Easy载体,送宝生物工程(大连)有限公司进行测序鉴定。
1.6 敏感性试验 将FMDV O型、A型和AsiaⅠ型标准株细胞培养物cDNA根据浓度成比列混合,每种cDNA的终浓度为1.0×107拷贝/μL,以10倍系列稀释浓度为1.0×107~1.0×100拷贝/μL的混合cDNA为模板,同时设正常BHK-21细胞cDNA为阴性对照,进行敏感性检测。
1.7 特异性试验 以SVDV、PRRSV、CSFV样品cDNA和PRV、PPV、猪附红细胞体及猪弓形虫样品DNA,同时设经灭活的FMDV O型、A型和AsiaⅠ型标准株细胞培养物等量混合物cDNA为阳性对照,正常BHK-21细胞cDNA为阴性对照,进行PCR扩增以验证该方法的特异性。
1.8 稳定性和重复性试验 以1.6敏感性试验的系列稀释浓度cDNA为模板进行PCR扩增,每个系列重复3次试验,以验证该方法的稳定性和重复性。
1.9 临床应用试验 由具备国内口蹄疫病毒分离培养研究资质的实验室以本试验建立的三重RT-PCR方法对其保存的10 份临床疑似样品进行检测,并与其之前的分离鉴定结果进行比较。同时设阴、阳性对照,同1.7特异性试验。
2 结果
2.1 FMDV O型、A型和AsiaⅠ型三重RT-PCR方法的建立 以经灭活的FMDV O型、A型和AsiaⅠ型标准株等量细胞培养液混合物cDNA为模板,扩增出了3条预期大小的目的条带,分别为234 bp、326 bp和467 bp;以单一标准株细胞培养液RNA反转录产物为模板,均能扩增出相应的条带;阴性对照未扩增出任何条带(见图1)。将3条不同的PCR扩增产物克隆入pGEM-T Easy载体进行测序,与GenBank中已登录序列进行比对,3种血清型O型、A型和AsiaⅠ型扩增片段核苷酸序列同源性均达98%以上。
2.2 敏感性试验 FMDV三种血清型O型、A型和AsiaⅠ型标准株细胞培养物cDNA最低检测限均为100 拷贝/μL,均出现大小为234 bp、326 bp和467 bp 左右的目的条带(见图2),表明本试验建立的FMDV O型、A型和AsiaⅠ型三重RT-PCR方法的最低检测限度为100 拷贝/μL。
2.3 特异性试验 阳性对照扩增出234 bp、326 bp和 467 bp 三条目的条带,而阴性对照、 SVDV、PRRSV、CSFV、PRV、PPV、Eperythrozoonsuis、Toxoplasmosis样品均未扩增出任何条带(见图3)。

图1 FMDV O型、A型和AsiaⅠ型三重RT-PCR方法扩增电泳图Fig.1 Identification result of RT-PCR for serotype O,A and AsiaⅠ FMDVM:DL-2 000 DNA marker; 1: FMDV O型、A型和AsiaⅠ型标准株等量细胞培养液混合物; 2: FMDV O型培养物; 3: FMDV A型培养物; 4: FMDV AsiaⅠ型培养物; 5:阴性对照M: DL-2 000 DNA marker; 1: Mixture of serotype O, A and AsiaⅠ FMDV standard strain infected cell culture; 2: Serotype O FMDV standard strain infected cell culture; 3: Serotype A FMDV standard strain infected cell culture; 4: Serotype AsiaⅠ FMDV standard strain infected cell culture; 5: Negative control
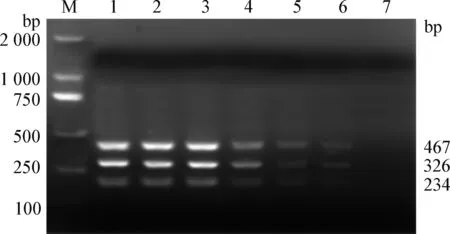
图2 FMDV O型、A型和AsiaⅠ型三重RT-PCR方法敏感性试验扩增电泳图Fig.2 Analysis of sensitivity test of RT-PCR for serotype O,A and AsiaⅠ FMDVM:DL-2 000 DNA marker; 1~7:10倍系列稀释的浓度均为1.0×107~1.0×100 拷贝/μL的FMDV三种血清型O型、A型和AsiaⅠ型培养物混合物M:DL-2 000 DNA marker; 1~7:Mixture serotype of O, A and AsiaⅠ FMDV plasmids in concentration of 1.0×107 ~1.0×100 copies/μL
2.4 稳定性和重复性试验 浓度为1.0×107~1.0×102拷贝/μL模板的3次重复扩增结果均为阳性;浓度为1.0×101~1.0×100拷贝/μL模板的3次重复结果均为阴性。表明本试验建立的FMDV O型、A型和AsiaⅠ型三重RT-PCR方法稳定性和重复性较好。
2.5 临床应用试验 对10份临床疑似样品株进行检测,结果为口蹄疫O型阳性样本4份、口蹄疫型A型阳性样本1份、口蹄疫AsiaⅠ型阳性样本3份、阴性样本2份(见图4)。此检测结果与以前的分离鉴定结果符合率为100%。
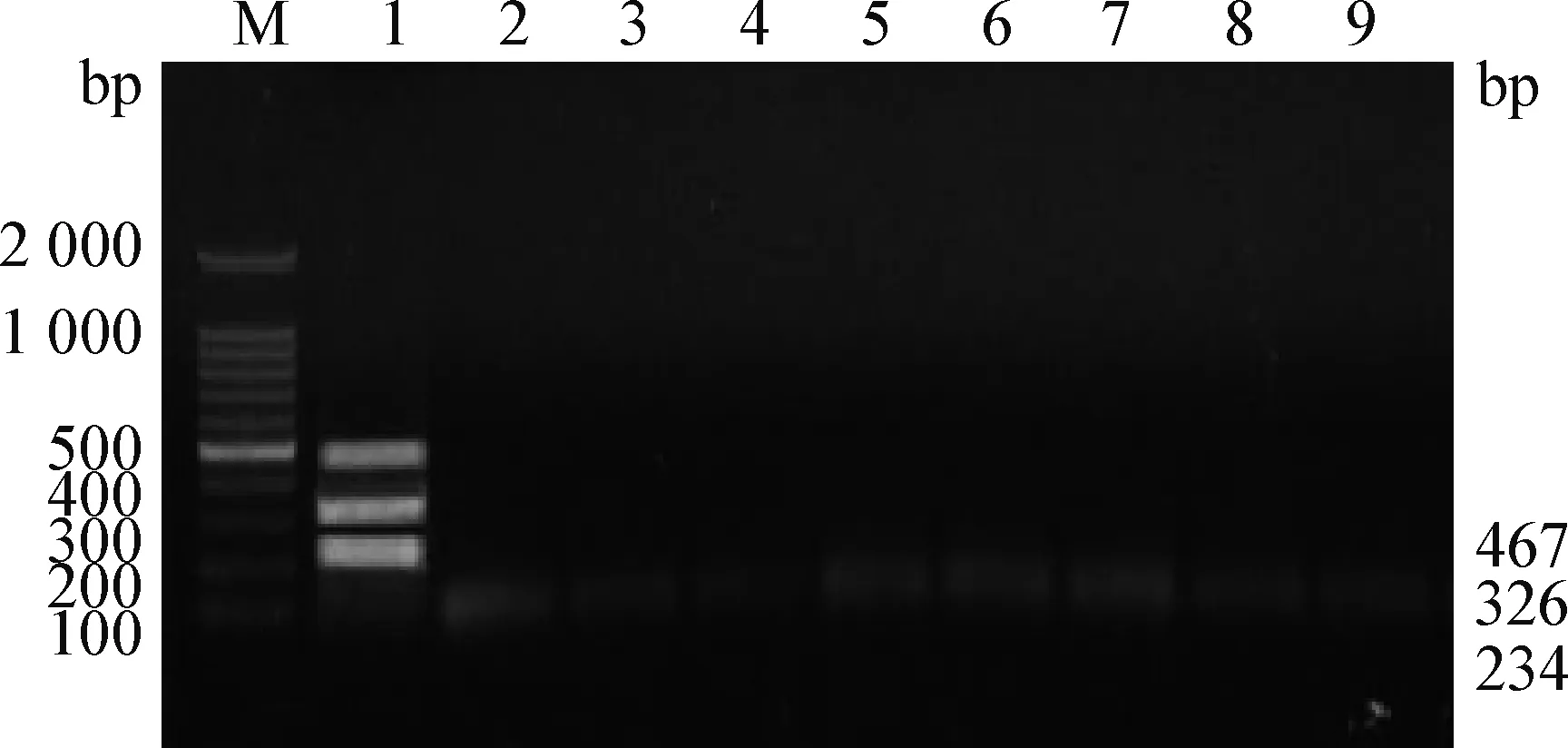
图3 FMDV O型、A型和AsiaⅠ型三重RT-PCR方法特异性试验扩增电泳图Fig.3 Analysis of specificity of RT-PCR for serotype O,A and AsiaⅠFMDVM:DL-2 000 DNA marker; 1:阳性对照; 2:阴性对照; 3~9:SVDV, PRRSV, CSFV, PRV, PPV, Eperythrozoon suis and ToxoplasmosisM:DL-2 000 DNA marker; 1:Positive control; 2:Negative control; 3~9:SVDV, PRRSV, CSFV, PRV, PPV, Eperythrozoon suis and Toxoplasmosis
3 讨论
我国是口蹄疫多发区,流行毒株种类较多。O型口蹄疫几乎每年都会发生,而且波及范围较广泛;AsiaⅠ型在多个省份出现过疫情,已经报告有猪感染后死亡的病例;A型从2009年初至今,已有多个省份发生,涉及到牛和羊。当前我国不仅面临FMDV毒株繁多、血清型复杂的严峻形势,而且各亚型毒株在猪群中共感染,导致发病率与死亡率增高、免疫失败散发,使防控难度大大增加。因此,对FMDV的快速分型检测是控制疫情的有效手段,也是科学免疫的必要前提。目前,只有分子生物学检测技术可以满足快速准确地进行抗原分型的要求,同时可检测到灭活病毒的核酸,较大程度地提高了检测工作的安全性[10]。

图4 FMDV O型、A型和AsiaⅠ型三重RT-PCR方法临床样本检测电泳图Fig.4 Clinical test of RT-PCR for serotype O,A and AsiaⅠ FMDVM:DL-2 000 DNA marker; 1:阳性对照; 2:阴性对照; 3~12:10份临床疑似样品M:DL-2 000 DNA marker; 1:Positive control; 2:Negative control; 3~12:10 suspected clinical samples
FMDV主要的非结构蛋白和保守序列主要包括2B、3D和IRES 等[11]。同源性分析显示,2B区最为保守,同源性为 87.7%~95.2%;其次是 3C,第三是 3D[12]。同时有研究者发现,以2B为模板建立的RT-PCR方法敏感性更高[13]。因此,本试验建立的FMDV O型、A型和AsiaⅠ型三重RT-PCR方法选取高度保守的2B基因区域设计反转录引物,对3种血清型病毒核酸反转录均能得到各自特异的cDNA。 本方法设计的3对型特异性引物是以FMDV的结构蛋白VP1为目的区域。因为该蛋白位于病毒衣壳表面,是决定FMDV抗原性的主要蛋白;同时VP1是能够诱导动物产生中和抗体的唯一蛋白,临床上合成肽疫苗的选择区域来源于VP1上在129~169 负责保护性免疫的氨基酸区域;而不同血清型的VP1蛋白同源性仅有约60%[14-15],这恰好为鉴别不同血清型提供了特异性基因区域的要求。本试验建立的鉴别FMDV O型、A型和AsiaⅠ型三重RT-PCR方法选择VP1基因上不同区域为模板设计特异性引物,不存在交叉反应,扩增条带分别为234、326 bp和467 bp,条带特异清晰,通过一次PCR反应就能达到较好的血清型分型效果。
通过对不同稀释度的3种血清型样品cDNA混合物进行检测,验证得到本方法的最低检测限度达到100 拷贝/μL,敏感性较高,可从较大程度上减少漏检的可能,并能够更好地检出隐性感染病原体。本试验建立的方法与临床上常与FMDV混合感染或临床症状难以区分的病原核酸无任何交叉反应,说明本方法具有较好的特异性,能够准确地应用于FMDV的临床检测,对FMD综合防控具有重要的意义。

