四川部分地区半舍饲肉羊消化道蠕虫感染调查
叶勇刚, 肖 璐, 魏 勇, 康润敏, 于吉锋, 张 涛, 叶建强, 曹 冶, 谢 晶, 李兴玉, 潘 梦, 林 毅, 孙文平, 戴卓建, 廖党金
(1. 四川省畜牧科学研究院, 四川成都610066 ; 2. 动物遗传育种四川省重点实验室, 四川成都610066 ; 3. 四川省凉山州畜牧兽医科学研究所, 四川西昌615042 ; 4. 四川省九龙县农牧农村和科技局, 四川九龙626200)
消化道蠕虫病在全世界范围广泛分布,是羊寄生虫病中对羊危害最大的一类寄生虫病,羊感染消化道蠕虫,通常导致羊消化不良、贫血、消瘦,甚至死亡[1-3]; 每年给养羊业造成重大的经济损失。一些羊的寄生虫病还是非常重要的人兽共患病,如包虫病、多头蚴和片形吸虫病等[4-6]。
四川位于我国西南,畜禽寄生虫虫种资源丰富,已报道的寄生虫种类多达671种[7]。近年来四川大力发展养羊业,养羊规模持续稳定增长,据2017年国家统计年鉴数据,2016年底四川肉羊存栏1 761.3 万只,居全国第6位,羊肉产量26.9万吨,居全国第5位,已成为我国肉羊生产大省[8]。四川肉羊养殖多以半舍饲化养殖模式,即放养加补饲为主,生产规模化程度、舍饲化水平和生产效率都不高[9],多数养殖场在寄生虫病防控方面,多采取春秋两季或更频繁的预防性驱虫[10-11],虽基本能够控制寄生虫病的发生,但由于连年不更换、或不针对性地使用药物,寄生虫病耐药问题也日益突出。而近年来,针对四川羊的寄生虫病流行病学调查多局限于县、市或州的调查,较为系统的调查多在20年前,专门针对半舍饲化养殖模式的羊寄生虫病调查更是未见报道[12-16]。基于此,试验通过粪便虫卵定量检测、寄生虫感染阳性羊尸体剖检、消化道蠕虫形态和内转录间隔区(Internal transcribed spacer,ITS)基因扩增鉴定,对四川半舍饲养殖肉羊流行的消化道蠕虫病开展调查,以掌握其流行实况,为本地区该养殖模式下的肉羊寄生虫病防控提供科学依据。
1 材料与方法
1.1 调查区域和时间 调查在2018年4月-2018年10月进行,主要针对四川半舍饲肉羊养殖的主产区,涉及四川的6个市州12个区县。其中A、B、C和D位于四川西南凉山州境内的布拖县、昭觉县和西昌市安宁镇,E、F和G位于四川东北部巴中市境内的南江县和恩阳区,H和I位于四川东北部达州市的宣汉县和万源市,J和K位于四川西部甘孜州境内的九龙县和丹巴县、L位于四川中部眉山市境内的仁寿县,M位于四川东南部自贡市的富顺县。
1.2 粪样的收集和检查 从13个不同羊群收集绵羊或山羊新鲜直肠粪便共计289份,每份不低于30 g (其中A、B、C和D场饲养凉山半细毛羊,样品数分别为28、41、20份和10份;E和L场饲养南江黄羊,样品数均为20份;F场饲养小尾寒羊,样品数为30份;G场饲养波尔山羊和南江黄羊,分别采样10份,样品数为20份;H场饲养波尔山羊,样品数为20份;I场饲养川中黑山羊,样品数为20份;J和K场饲养本地杂交山羊,样品数均为20份;M场饲养川南黑山羊,样品数为20份),单独存放于透明塑料采样袋中并做好标记,置于装有冰袋的泡沫箱中带回实验室镜检。虫卵和每克粪便虫卵数(Egg per gram,EPG)的鉴定,主要采用沉淀法和Liao D J[17]建立的方法进行判定。绦虫主要检查粪便中是否有孕卵节片,并根据形态特征初步判定种类。
1.3 消化道蠕虫的收集、保存和鉴定 13个羊群中粪便虫卵检测阳性的19只病弱羊(E场3只羊、A场、B场、G场和J场分别为2只羊,其余场1只羊),按蠕虫学完全剖检法进行。将被检羊剥皮后剖开胸腔和腹腔,将内部脏器依次按系统分离,将食道、胃、小肠、结肠、盲肠、肝脏、胰腺、肠系膜等分开放入搪瓷盆内逐一检查,仔细挑出所有的蠕虫,进行形态学鉴定[18-19]。
1.4 消化道蠕虫的分子鉴定
1.4.1 DNA提取和PCR 对DNA的提取主要针对吸虫和线虫。挑取不同种的消化道蠕虫成虫各1条,研磨后用TIANamp Genomic DNA Kit(TIANGEN)提取虫体基因组DNA。以引物NC 5 (5′-GTAGGTGAACCTGCGGAAGGATCATT-3′)和引物NC 2(5′-TTAGTTTCTTTTCCTCCGCT-3′)作为扩增消化道线虫的ITS和5.8 S基因序列的保守引物;以引物BD 1(5′-GTCGTAACAAGGTTTCCGTA-3′)和引物BD 2 (5′-TATGCTTAAATTCAGCGGGT-3′)作为扩增吸虫ITS和5.8 S基因序列的保守引物。分别以线虫和吸虫DNA为模板,线虫反应体系为:2 ×TaqPCR Master Mix (TIANGEN) 12.5 μL,NC 5和NC 2各0.5 μL,DNA模板2 μL,dd H2O 9.5 μL;反应条件:95 ℃预变性5 min;94 ℃变性30 s,56 ℃退火45 s, 72 ℃延伸45 s,35个循环;最后72 ℃延伸7 min。 吸虫反应体系为:2 ×TaqPCR Master Mix 12.5 μL,BD 1和BD 2各1 μL,DNA模板1.5 μL,dd H2O 9 μL;反应条件:98 ℃预变性3 min;98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸20 s,30个循环;最后72 ℃延伸5 min。
1.4.2 DNA测序及进化树构建 所有阳性扩增产物经纯化后,送至擎科生物有限公司进行测序。用Seqman软件查看测序峰图并进行序列拼接,随后在NCBI网站对序列进行BLAST比对并将序列上传至GenBank 数据库。利用MEGA-X软件采用N-J法构建系统进化树,Bootstrap重复值设为1 000。
2 结果
2.1 粪样检查 结果显示,肉羊消化道蠕虫感染阳性率为64.36%(186/289),其中线虫感染率最高,达60.55%(175/289),其次为片形吸虫、同盘吸虫和绦虫,阳性率分别为15.22%(44/289)、14.88%(43/289)和2.08%(6/289);另外线虫、片形吸虫和同盘吸虫的平均EPG值分别为1 197(56~28 187)、527(74~1 407)和413(63~1 291)。每个养殖场羊消化道线虫的感染率均明显高于吸虫或绦虫(H场除外),各养殖场粪便虫卵检测结果见表1。
2.2 消化道蠕虫的剖检 剖检19只经虫卵检测为阳性的病弱羊发现,捻转血矛线虫的感染率最高(84.21%),其次为夏伯特线虫、毛首线虫、肝片形吸虫、同盘吸虫、奥斯特线虫、食道口线虫、大片形吸虫、莫尼茨绦虫、背板线虫和列叶吸虫。成虫发现数量最多的为列叶吸虫,达到3 147条,最少的为莫尼茨绦虫,仅3条,见表2。对采自3只羊的绦虫节片进行染色镜检,发现2只羊单独感染扩展莫尼茨绦虫,1只羊单独感染贝氏莫尼茨绦虫。
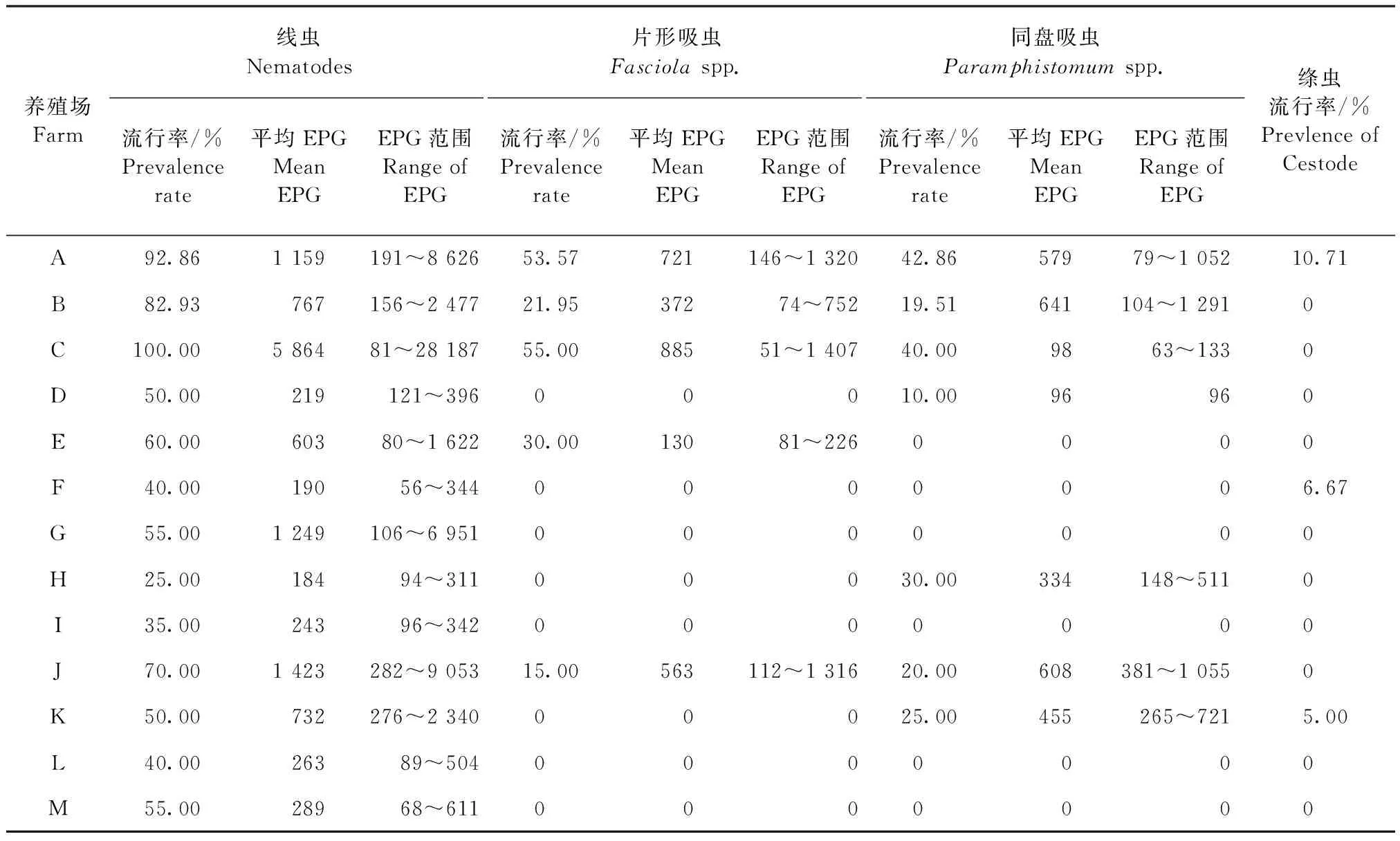
表1 不同养殖场羊消化道蠕虫的感染情况Table 1 The infection of helminthes parasited in digestive tract of sheeps or goats in different farms
2.3 分子鉴定及进化树分析 PCR扩增结果为阳性的产物,测序后拼接获得15条含rDNA ITS的基因序列,登录GenBank数据库得到登录号(MK397496、MK402081、MK402084-MK402088、MK472688、MK477543、MK530133、MK530935、MK811248、MK811249、MK818506和MK929282)。在线BLAST分析与NCBI基因库中的鹿列叶吸虫、肝片形吸虫、大片形吸虫、鹿同盘吸虫、捻转血矛线虫、羊夏伯特线虫、粗纹食道口线虫、羊毛首线虫、达氏背板线虫和奥斯特线虫(不确定种)的ITS序列相似性达92.59%~100%,与形态学鉴定结果基本一致。
基于ITS序列构建NJ树,结果显示,本试验所测的4个吸虫样品,处于3个大的不同分支。MK472688和MK929282处于同一大分支,其中MK472688与分离自中国和印度绵羊的肝片吸虫(KJ789364和KX198630)处于同一分支,MK929282与分离自印度绵羊的大片形吸虫(KX198631)处于同一小分支;MK530935与分离自印度大额牛的鹿同盘吸虫(KU365321)处于同一大分支的小分支;MK477543与中国分离的鹿列叶吸虫(KF008246)处于同一大分支的小分支,分别确定为肝片形吸虫、大片形吸虫、鹿同盘吸虫和鹿列叶吸虫,见图1。所测的9个线虫样品处于3个大分支,分别属于毛圆科、夏伯特科和毛首科;其中MK397496与分离自乌兹别克斯坦绵羊的达氏背板线虫(KX929993)处于同一分支;MK818506(形态鉴定为普通奥斯特线虫)与中国绵羊分离的奥斯特线虫(HQ844228)处于同一分支;MK402081、MK402086和MK402087与分离自中国和美国绵羊的捻转血矛线虫(HQ944231和EU086386)处于同一分支;MK402084与分离自中国的粗纹食道口线虫(KM200804)处于同一分支;MK402088和MK811249与分离自爱尔兰绵羊的羊夏伯特线虫(JF690981)处于同一分支;MK402085与分离自西班牙牛的羊毛首线虫(FR870274)处于同一分支,分别确定为达氏背板线虫、普通奥斯特线虫、捻转血矛线虫、粗纹食道口线虫、羊夏伯特线虫和羊毛首线虫,见图2。
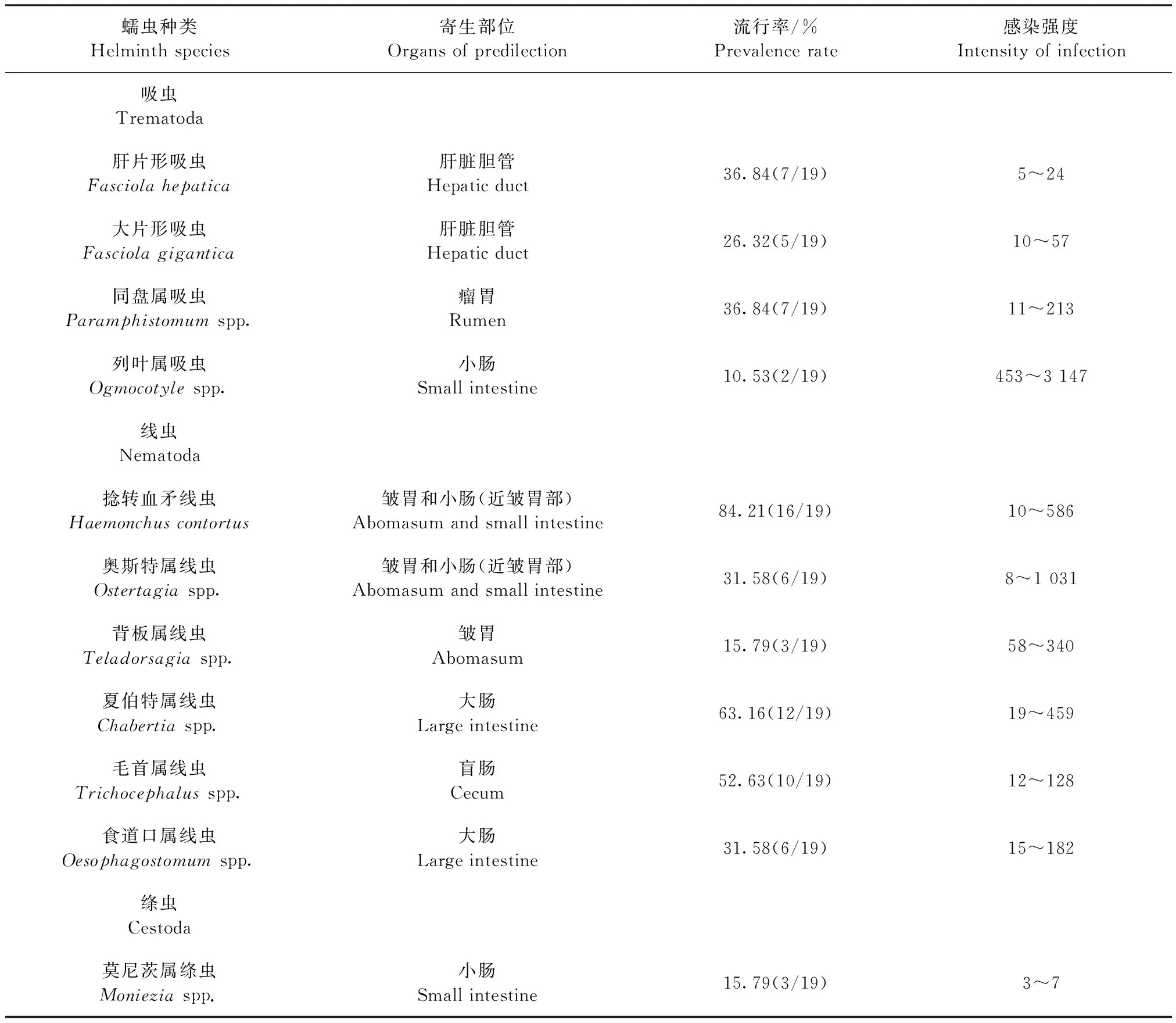
表2 绵羊或山羊不同种消化道蠕虫感染率、感染强度和寄生虫部位Table 2 Species,organs of predilection,prevalence and intensity of infection of helminthes in sheeps or goats
3 讨论
近年来,随着养殖设施条件的改善和驱虫药物的普及使用,羊的寄生虫病得到了较好的控制,但不针对性使用和常年不更换驱虫药的问题却十分突出。据报道,在我国乃至全球,羊的消化道蠕虫尤其线虫的抗药性问题已越来越普遍[20-22]。在本次调查的13个养殖场中,多数养殖场连续2年以上使用单一药物进行驱虫,未曾做到轮换用药和穿梭用药。其中G场使用阿维菌素驱虫3个月,线虫感染阳性率已达55%,EPG均值为1 249(见表1),已超过传统驱虫阈值[23],若再执行该场固有的春秋两季驱虫,已明显不能有效控制寄生虫病。此外,调查中有8个养殖场的羊感染吸虫,除B、E和H场外,其余均没有使用专门的抗吸虫药物,且部分羊的片形吸虫和同盘吸虫EPG值已超过500,需使用抗吸虫药物进行驱虫。
明确流行寄生虫种类,是制定针对性防控寄生虫病的前提。寄生虫的形态学鉴定虽然简单直观,但也存在对鉴定人员经验要求高和难以鉴别形态差异小的虫种等缺陷,分子鉴定方法是对形态学鉴定方法的补充。核糖体内转录间隔区(ITS)序列,是寄生虫分类鉴定使用最广泛的分子标记,已被广泛用于寄生虫虫种的分类和系统进化研究[24-25]。本试验对所检蠕虫开展形态学和分子鉴定,明确了当前四川半舍饲肉羊流行的消化道蠕虫主要有肝片形吸虫、大片形吸虫、鹿同盘吸虫、鹿列叶吸虫、捻转血矛线虫、羊夏伯特线虫、粗纹食道口线虫、羊毛首线虫、达氏背板线虫、普通奥斯特线虫、扩展莫尼茨绦虫和贝氏莫尼茨绦虫。除达氏背板线虫外,其余蠕虫均在《四川畜禽寄生虫志》有报道[16]。
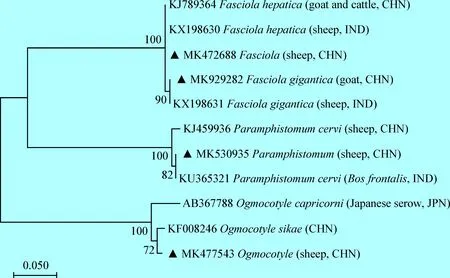
图1 基于几种吸虫ITS序列构建的NJ系统发育树Fig.1 Phylogenetic tree of the morphologically diagnosed trematodes based on ITS sequences by using the neighbour-joining method▲: 本试验所分离吸虫 ▲: Trematodes isolated in this test

图2 基于几种线虫ITS序列构建的NJ系统发育树Fig.2 Phylogenetic tree of the morphologically diagnosed nematodes based on ITS sequences by using the neighbour-joining method▲: 本试验所分离线虫 ▲: Nematodes isolated in this test
半舍饲养殖是一种早晚补充青干草或精料并适时放牧的一种养殖模式,该模式既能有效利用荒山草坡牧草资源,降低养殖成本,又能便于对羊群进行管理,是四川非常普遍的一种养羊模式。羊群在荒山草坡活动,接触寄生虫尤其消化道蠕虫病原或中间宿主的机会比纯圈养羊群机会多;但同时其便于统一驱虫管理,寄生虫病的发生又比纯放养羊群要低。四川位于我国西南,地域广阔,开展半舍饲养羊多是在半农半牧区或农区,这些区域相比高原牧区,其气候温和、湿度适中,比较适于寄生虫的生存和繁殖。据报道西南地区羊的寄生虫种类有线虫66种,吸虫50种,绦虫10种[26-28]。而本次调查发现的12种蠕虫在已报道的四川羊消化道蠕虫中仅占一小部分,可能与养殖模式、所选区域和样本数量较少,以及近年来对羊寄生虫病防治的重视和驱虫药物的普及有关。另外,线虫病在本次调查的13个养殖场中均有发现,场阳性率达100%,其中4个养殖场线虫平均EPG达1 000以上;对羊的剖检结果也进一步证实了羊线虫病的高感染率和感染程度。为此,线虫病是四川半舍饲肉羊寄生虫病防控的重点,其次,一些养殖场需加强对吸虫病的防控。本次调查结果对采取有效措施防控该养殖模式下的肉羊消化道蠕虫病提供了重要科学依据。

