FAM20A条件性基因敲除小鼠牙龈增生的组织测量学分析
刘 静,李丽丽,刘培红,马 肃
人类基因组测序完成后,基因命名委员会将具有相似序列的基因归为一个家族(Family),即Fam,依次编码为Fam1, 2, 3……Fam20即序列相似家族中的第20个家族,在哺乳动物体内,其成员包括Fam20A,Fam20B,Fam20C[1-2]。
临床报道,人Fam20A基因突变会导致牙龈纤维增生综合征(amelogenesis imperfecta gingival fibromatosis, AIGFS)与釉质-肾脏综合征(enamel renal syndrome,ERS)[3]。AIGFS患者通常会出现牙龈纤维性增生,釉质发育不良,牙齿萌出障碍,牙髓内钙化等病理现象[4-5];ERS患者除表现牙龈增生和釉质发育不良外,还会出现肾钙质沉着或肾结石[6]。AIGFS和ERS患者均伴发明显的牙龈增生,其发病机制尚待研究。
本实验通过建立Fam20A条件性基因敲除小鼠动物模型,即选择性地敲除小鼠上皮内的FAM20A基因,并对其牙龈表型进行形态学测量分析,为进一步研究其机制提供组织学基础。
1 材料与方法
1.1 仪器与试剂
ProFlex PCR仪(Life Technologies公司,美国);OLYMPUS SZ51体视显微镜(OLYMPUS株式会社,日本);Eppendorf单通道微量移液器1000/200/10/2(Eppendorf股份公司,德国);LEICA Modell SM 2000R切片机(LEICA微系统股份公司,德国);Nikon ECLIPSE 80i显微镜、Nikon NIS-Elements BR 3.0成像分析系统(Nikon株式会社,日本);多聚甲醛(光复化工研究所,中国);乙二胺四乙酸二钠(西陇化工股份有限公司,中国);苏木素、伊红、琼脂糖(中杉金桥生物技术有限公司,中国);EB 替代物(索莱宝科技有限公司,中国);PCR-MIX 试剂盒(庄盟生物试剂有限公司,中国)。
1.2 实验动物
1.2.1 报告基因标记小鼠 Fam20Aflox/+小鼠建模于北京百奥赛图基因生物技术有限公司。
1.2.2 工具鼠 k14-Cre转基因小鼠购买于苏州南京医科大学动物模式中心。
1.2.3 条件性基因敲除小鼠的繁殖 Fam20Aflox/+小鼠和Fam20Aflox/+小鼠交配,繁殖出Fam20Aflox/flox小鼠→Fam20Aflox/flox小鼠和k14-Cre转基因小鼠交配,繁殖出k14-Cre;Fam20Aflox/+小鼠→k14-Cre;Fam20Aflox/+小鼠与Fam20Aflox/flox小鼠交配,繁殖出k14-Cre;Fam20Aflox/flox小鼠(小鼠上皮内的Fam20A基因被敲除)。
本实验研究发现Fam20Aflox/flox小鼠或者失去Fam20A一个等位基因的小鼠(Fam20Aflox/+小鼠)没有任何表型变化,同正常野生小鼠表型完全一致,所以本实验以Fam20Aflox/+或者Fam20Aflox/flox小鼠作为正常对照小鼠。这样不仅可以减少小鼠的需要量而且可以消除不同窝小鼠之间的潜在差异。
1.2.4 条件性基因敲除小鼠的鉴定 将出生后7 d小鼠剪取3~5 mm鼠尾→放入EP管中→做标记→每个EP管中装入裂解液500 μL→100 ℃煮沸10 min→冷却至室温→每管加10 μL蛋白酶K→震荡器混匀→55 ℃恒温消化过夜→震荡器打散组织→100 ℃煮沸10 min→冷却至室温→15 000 r/min,离心20 min→取上清液1 μL作为模板进行25 μL体系PCR→加热(95 ℃10 min)→退火(60 ℃35个循环)→延伸(72 ℃5 min)。
鉴定Fam20A基因中外显子5~8被敲除后等位基因的引物:Primer-F:5′-gaaactttgcagtccttgttccc-3′,Primer-R:5′-gcactatcaatgccaagtttcc-3′。鉴定k14-Cre等位基因的引物:Cre-F:5′-atttgcctgcattaccggtc-3′,Cre-R:5′-atcaacgttttcttttcgg-3′。
1.2.5 实验动物分组 k14-Cre;Fam20Aflox/flox条件性基因敲除小鼠及同窝正常小鼠各20只,共计40只,分别于出生4、6、8、12周处死取材,每组各5对。所有小鼠均饲养于哈尔滨医科大学公共卫生学院实验动物中心,使用均经过了哈尔滨医科大学动物管理和使用委员会的批准。
1.3 实验方法
1.3.1 形态学观察 将出生4、6、8及12周的Fam20A条件性基因敲除小鼠和正常对照小鼠,用1.5%戊巴比妥钠(0.01 mL/g)腹腔注射麻醉,解剖暴露心脏,0.9%生理盐水和4%多聚甲醛经心脏灌注内固定;解剖获得小鼠双侧下颌牙体-牙周组织标本,选取小鼠的右侧标本块保存于0.5%多聚甲醛中,在体视显微镜下观察,拍照。
1.3.2 组织学测量 将上一步骤中获得左侧牙周-牙体组织块置于4%多聚甲醛外固定24 h→去除牙龈组织以外多余软组织→15%EDTA 4 ℃摇床脱钙1~2周→下颌第一磨牙近中面为包埋面常规石蜡包埋→颊舌向连续切片→片厚4 μm→下颌第一磨牙近远中向中点处随机选择3张切片,行HE染色。
光镜下观察各组标本颊侧牙龈上皮和结缔组织的组织学形态。采用Nikon IS-Elements BR3.0成像分析系统摄片,并在100倍视野下手动测量各组标本颊侧牙龈总面积、牙龈上皮面积、牙龈结缔组织面积3个指标,测量由同一人完成,每个标本测3张切片,每张切片测3次,取平均值。
1.4 统计学方法
采用SPSS 19.0软件包对每一指标进行析因设计的方差分析和费舍尔最小显著性差异确定显著性水平,P<0.05表示差异有统计学意义。
2 结 果
2.1 Fam20A上皮基因敲除小鼠鉴定结果
利用Primer-F 和Primer-R 这对引物,如果只扩增出545 bp的条带,则标记为Fam20Aflox/flox(图1中左侧的1、2、4号样本);如果只扩增出435 bp条带,则标记为Fam20A+/+;如果既扩增出545 bp的条带,又扩增出435 bp条带,则标记为Fam20Aflox/+。同时利用Cre-F和Cre-R这对引物,可出现k14-Cre等位基因扩增出的350 bp条带;或为Wildtype 等位基因不出现任何条带(图1)。综合上述两种引物,当只产生545 bp 的Fam20Aflox/flox条带,同时又能产生350 bp条带,也就是k14-Cre; Fam20Aflox/flox小鼠,即我们所需要的Fam20A条件性基因敲除鼠,而Fam20Aflox/+小鼠即本实验中的正常对照组小鼠。
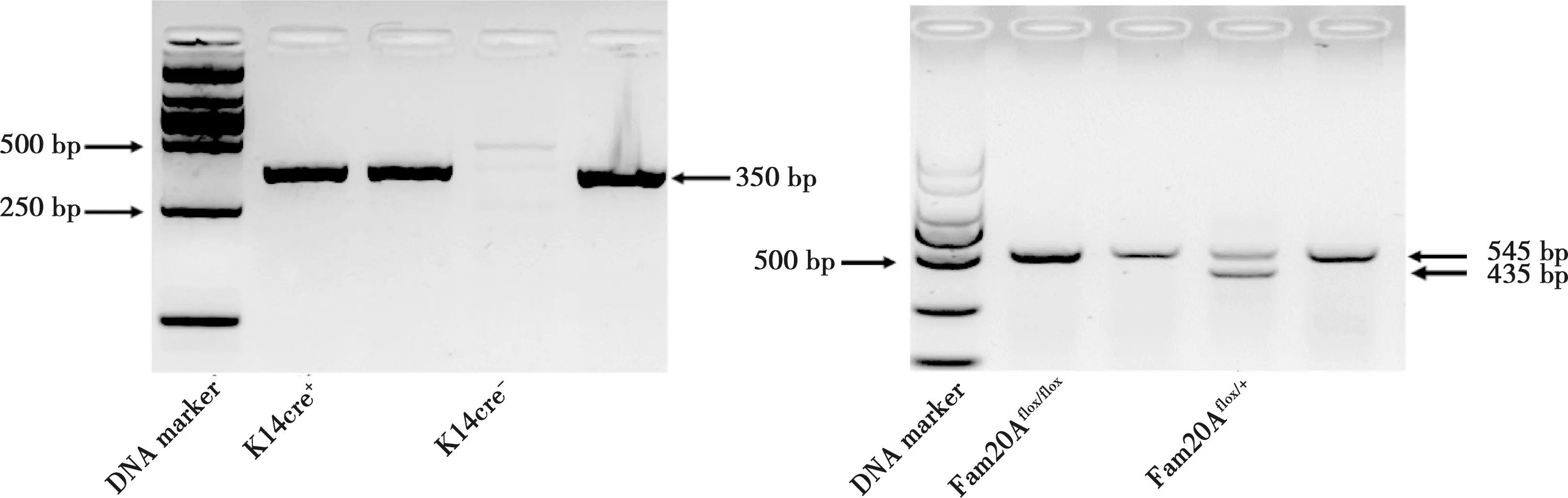
图1 K14-cre;Fam20Aflox/flox基因鉴定结果
2.2 牙龈形态学观察
与对照组小鼠相比,Fam20A条件性基因敲除小鼠的牙龈组织体积明显增大,厚度明显增厚(图2)。

左图为对照组小鼠牙龈组织体式显微镜下图片;右图为Fam20A条件性基因敲除小鼠牙龈组织体式显微镜下图片;蓝色虚线的长度分别代表下颌第一磨牙颊侧中点处和龈乳头处牙龈宽度;B:颊侧;L:舌侧;Ctrl:对照;cKO:条件性基因敲除
2.3 牙龈组织学染色观察
与对照组小鼠相比,Fam20A条件性基因敲除小鼠牙龈组织增厚,牙龈上皮和结缔组织均增厚,增厚未见明显部位特异性,分布于整个牙龈组织。牙龈上皮角化层增厚,基底层细胞层数和数量明显增加;固有层面积增大,成纤维细胞数量增加,胶原纤维束大量堆积,胶原纤维束明显增粗,胶原束间隙明显减小(图3A)。各组均未观察到明显炎症细胞浸润及组织水肿情况(图3A)。
2.4 牙龈组织组织学测量分析
基因敲除小鼠颊侧牙龈增厚,颊侧牙龈总面积、牙龈上皮面积和牙龈结缔组织面积均大于对照组(P<0.05)。其中,4周龄基因敲除小鼠颊侧牙龈总面积和牙龈上皮面积显著大于对照组(P<0.01),颊侧结缔组织面积大于对照组(P<0.05);6周龄基因敲除小鼠颊侧牙龈总面积、牙龈上皮面积和结缔组织面积均显著大于对照组(P<0.01);12周龄基因敲除小鼠颊侧牙龈总面积、牙龈上皮面积和结缔组织面积均大于对照组,差异无统计学意义(P>0.05)(图3B)。
3 讨 论
人类基因组学研究证实,小基因Fam20家族中Fam20A 基因与Fam20C 基因在人类牙齿组织的发育中起重要作用,体外研究表明Fam20A和Fam20C 可形成功能复合体,一起行使对某些分泌蛋白的磷酸化功能[2]。
目前,病例报道可见Fam20A基因缺失导致的牙龈增生现象[7-8],Fam20C基因敲除鼠没有出现牙龈上皮过度增生的表型变化[9-10],也没有学者报道人Fam20C基因突变导致雷恩综合征的患者出现牙龈增生症状[10-14]。前期实验中Fam20A基因条件性敲除鼠发生牙龈上皮细胞过度增殖的现象,而Fam20C基因敲除鼠未有牙龈变化[15],这说明,在口腔组织中Fam20A可能不依赖于Fam20C,独立行使其生物学作用。目前对Fam20A基因功能的研究还十分有限, Fam20A基因条件性敲除导致牙龈增生现象的具体分子机制需要阐明。
本实验拟采用2016年Qin等同北京百奥赛图动物模式有限公司合作制备的Fam20A条件性基因敲除小鼠,选择性敲除口腔上皮内的Fam20A基因[15]。通过带有β-半乳糖苷酶的Fam20Aflox/flox小鼠和K14-cre 转基因小鼠杂交,得到k14-Cre; Fam20Aflox/flox条件性基因敲除鼠(此小鼠上皮内所表达的Fam20A 基因被敲除)。对该动物模型的牙龈表型进行分析,为进一步研究Fam20A基因突变导致牙龈改变的机制提供组织学基础。
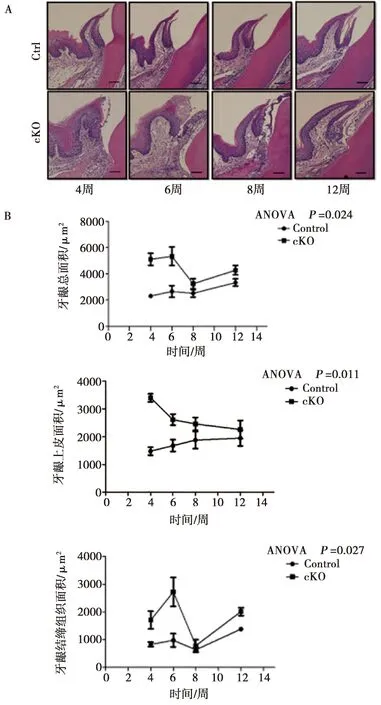
A:颊侧牙龈组织HE染色( ×100)(标尺50 μm);B:颊侧牙龈组织测量统计图,从上到下依次为颊侧牙龈总面积、牙龈上皮面积、牙龈结缔组织面积
在对实验动物的繁殖和饲养过程中,通过肉眼和体视显微镜观察,发现与对照组小鼠相比,所有基因敲除组小鼠颊侧牙龈组织的体积均有增大,为了验证该牙龈增生模型的可靠性,我们首先对小鼠进行PCR基因鉴定,结果证实所有实验组小鼠均为Fam20A条件性基因敲除小鼠,对照组为同窝正常小鼠。
小鼠出生后4周牙齿刚刚萌出,出生后8周性成熟,并且小鼠下颌第一磨牙的牙周牙体组织结构与人牙最为接近[16]。基于此,本实验以4、6、8和12周龄小鼠为研究对象,分别代表恒牙萌出小鼠,体成熟小鼠,性成熟小鼠和老龄小鼠,选取下颌第一磨牙为牙龈观察部位。
通过组织学HE染色,观察到基因敲除组小鼠颊侧牙龈上皮细胞层数和数量均增多,而且牙龈结缔组织体积增大,纤维数量增多,密度增高。为了进一步探讨FAM20A条件性基因敲除小鼠牙龈上皮和牙龈结缔组织的差异影响,使用Motic Med 6.0数码医学图像分析系统,分别测量4组小鼠下颌第一磨牙颊侧牙龈总面积、牙龈上皮面积和牙龈结缔组织面积,定量分析。结果显示:在本实验周期内,实验组小鼠颊侧牙龈总面积、牙龈上皮面积和牙龈结缔组织面积大于对照组(P<0.05),这种差异随小鼠周龄增长呈减弱趋势,至8周后差异无统计学意义。此外,所有小鼠牙龈组织内均未见到炎性细胞浸润和水肿现象。结果表明,在本实验周期内,Fam20A基因缺失可诱导小鼠牙龈上皮和结缔组织面积增加,而非牙龈炎症导致。
本研究Fam20A基因只在上皮内被敲除,结缔组织内的Fam20A基因并未被敲除;而实验结果显示,牙龈的增生是由上皮细胞和结缔组织共同增多导致的,这一现象的出现可能与发育过程中的上皮间充质转化[17]有关,具体的分子机制尚有待我们进一步研究揭示。

