超声造影征象及免疫因子与三阴性乳腺癌的相关性研究
蒋佼滟,李巍炜,冷晓玲
(新疆医科大学附属肿瘤医院超声科,乌鲁木齐830011)
三阴性乳腺癌(triple-negative breast carcinoma,TNBC)指病理分子生物学指标中,细胞表面雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)均表达阴性的乳腺癌。非三阴性乳腺癌(non-three-negative breast cance,NTNBC)即在病理分子生物学指标中不同时满足PR、ER、HER-2均为阴性的乳腺癌[1]。乳腺癌中TNBC占15%~20%,恶性程度高,相较其他类型的乳腺癌远处转移早、复发率高、对内分泌及靶向药物治疗不敏感,TNBC对新辅助化疗较敏感,与其他类别乳腺癌明显不同[2-3]。P53蛋白是一种抑癌因子,P53基因突变和缺失可导致细胞生长和凋亡失控,使细胞发生癌变,其表达水平对临床新辅助化疗及预后的评估可以作为参考数据[4]。P63与P53基因在结构和功能上有一定的同源性[5]。细胞角蛋白5/6(cytokeratin,CK5/6)表达被认为Basal-like表型乳腺癌的特征性标志之一,可作为判断TNBC的预后因素[6]。Tisheek等人指出雄激素受体(andmgen receptor,AR)是类固醇激素受体,AR的激活是一种保护性因素,AR阳性提示预后较好[7]。本研究通过观察TNBC和NTNBC的二维超声及造影表现特征,采用回顾性分析,分析二者间不同特征以及TNBC组织中CK5/6、P53、P63、AR的表达水平与二维超声及造影表现的相关性,现报道如下。
1 资料与方法
1.1 一般资料收集2015年1月-2019年6月于新疆医科大学附属肿瘤医院乳腺外科接受乳腺癌手术并术后病理证实为TNBC的72例患者以及随机抽取125例NTNBC患者的临床资料并进行回顾性分析。TNBC组年龄27~72岁,中位年龄44岁,结节直径为0.7~7.2 cm,NTNBC组年龄23~79岁,中位年龄50岁,结节直径为0.8~12.3 cm,。患者术前已行超声检查及超声造影检查,超声图像资料及病理免疫组化资料已完善。本研究获得新疆医科大学附属肿瘤医院伦理委员会的批准,超声造影检查提前告知患者造影剂注射的风险及需将检查结果纳入临床研究,并签署患者知情同意书。
1.2 仪器与方法采用GE公司LOGIQ E9彩超诊断仪,二维超声使用高频探头:ML6-15-D,频率:6~15 MHz。二维超声选取乳腺扫查模式,患者仰卧位,充分暴露双乳及双腋下区域。依次多次多切面扫查乳腺4个象限、乳晕区、双腋下区域。记录结节位置、大小、形态、生长方向(纵横比)、边缘、边界、内部回声及有无微钙化、后方回声、周边回声、血流信号、腋窝淋巴结有无转移,血流按照Adler半定量法[8],分0、I、II、III级。超声造影检查使用9L-D探头,造影时机械指数设定为0.16,频率:3~9 MHz。造影剂:声诺维(Sono Vue,Bracco,Italy),即注射用六氟化硫微泡,59 mg/瓶,使用前用5 mL 0.9%氯化钠溶液重组,注射剂量为5 mL/次。患者仰卧位,二维超声检查肿瘤的形态、大小、边缘,保持探头位置不动,抽取5 mL超声造影剂快速推注入一侧上肢肘静脉,再静推0.9%无菌氯化钠注射液5mL。注射造影剂后即刻开始记录动态影像150 s,直至病灶增强影像消减。超声造影定性分析参照文献[9]的方法,参数有造影增强模式、穿支血管以及造影前后肿块的大小差值。增强强度的判断以周围正常乳腺组织的回声强度作为参照,将乳腺结节内造影剂达峰时的增强程度分为:无增强,从开始至消退结束时结节内始终未见明显造影剂充填;低及中增强,达峰时乳腺结节增强强度低于或等于周边正常乳腺组织;高增强,达峰时乳腺结节增强强度高于周边正常乳腺组织。测定结果由2名具有5年以上的临床经验丰富的超声科医师在未知病理结果前独立完成分析,有分歧时与第三位高年资医师讨论达成统一意见。
1.3 指标的测定患者术前进行粗针穿刺活检取出乳腺病灶组织、术后病灶立即送病理科检查,应用免疫组化Elivision二步法检测蛋白表达检测ER、PR、HER-2,P53、P63、AR、CK5/6表达。
1.4 统计学处理数据采用SPSS 22.0统计学软件进行统计分析,计数资料以例(%)表示,采用χ2检验,相关性分析采用Spearman法,检验水准α=0.05。
2 结果
2.1 TNBC与NTNBC患者超声和超声造影特征比较与NTNBC患者比较,TNBC患者二维超声特征为圆形或者椭圆形(54.2%),边缘清晰(38.9%),后方回声增强(48.6%),无微钙化(77.8%),淋巴结转移少(47.2%),差异均有统计学意义(P<0.05)。两组间结节的大小与纵横比、血流信号分级之间差异无统计学意义(P>0.05),见表1,图1、2。
2.2 TNBC与NTNBC患者超声造影表现比较与NTNBC患者比较,TNBC患者超声造影呈高增强模式(70.8%),造影前后结节大小TNBC无明显变化(79.2%),差异均有统计学意义(P<0.01),见表2、图3。
2.3 P53与TNBC的超声及造影征象的相关性72例TNBC中,P53表达阳性47例,阳性率达65.3%,在P53表达阳性的病灶中,血流信号分级为II~III级44例,0~I血流4例(r=0.416、P<0.01),造影呈高增强29例,低及中增强18例(r=0.275、P=0.019),造影时有穿支血流灌注31例,无穿支血流为16例(r=0.320、P=0.006),以上差异有统计学意义(P<0.05),见表3。
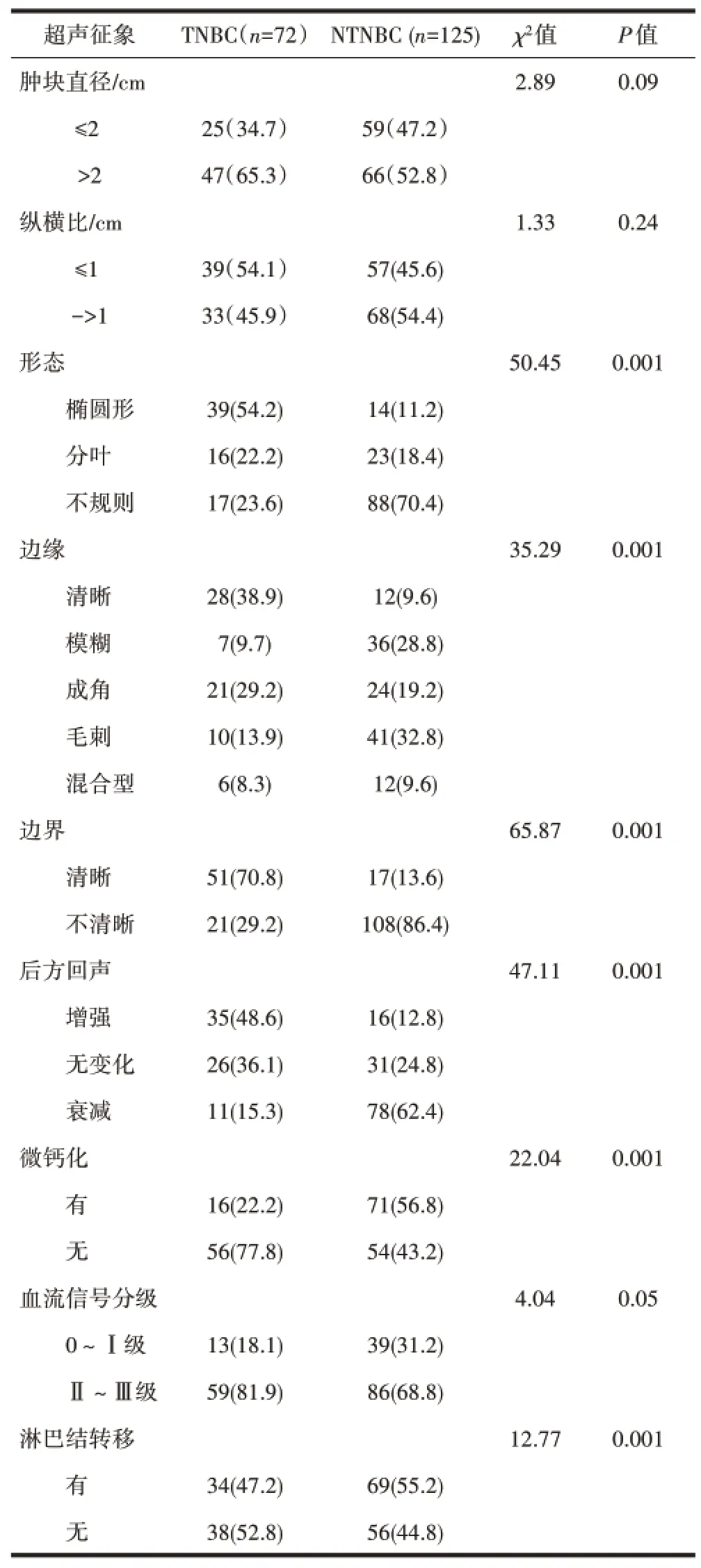
表1 TNBC与NTNBC超声征象比较[n(%)]
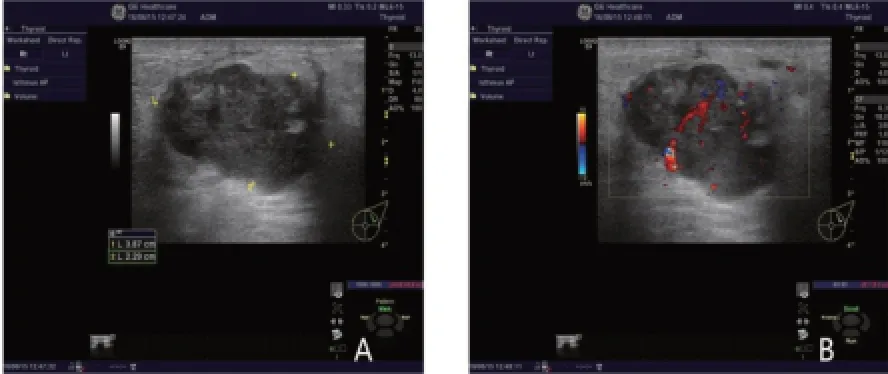
图1 TNBC患者的二维超声图

图2 NTNBC患者的二维超声图
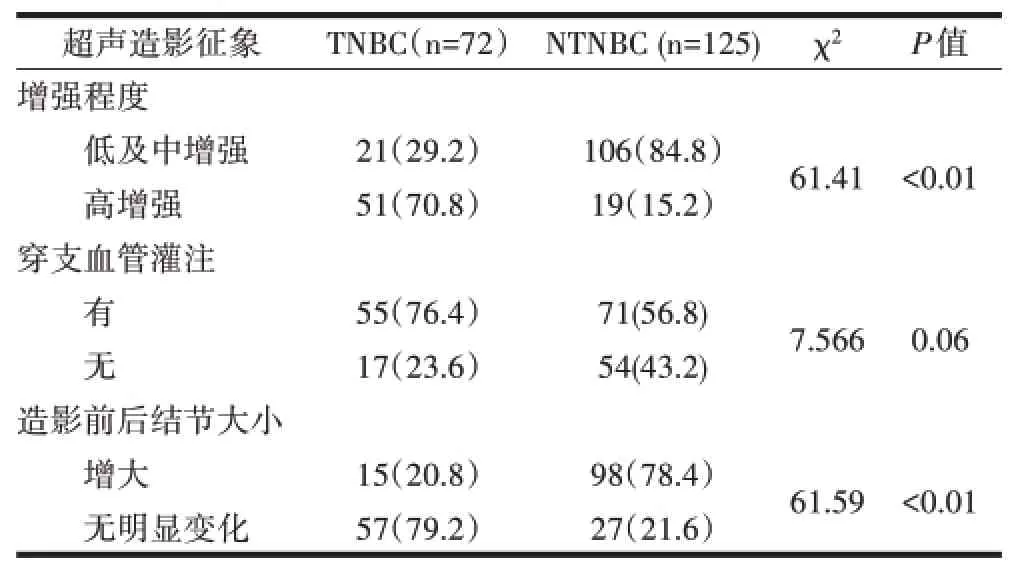
表2 TNBC与NTNBC超声造影征象比较[n(%)]
2.4 CK5/6与TNBC的超声及造影征象的相关性CK5/6表达阳性55例,阳性率为76.4%,TNBC结节边界不清,内部有微钙化,淋巴结转移,造影前后结节测量值增大与CK5/6表达阳性具有相关性,相关系数分别为0.285、0.568、0.326、0.369,差异有统计学意义(P<0.05),见表4。
2.5 P63与TNBC的超声及造影征象的相关性P63表达阳性7例,阳性率为9.7%,TNBC结节直径、生长方向(纵横比)、形态、边界、边缘、微钙化、后方回声,血流信号分级、淋巴结转移、超声造影表现等超声征象均与P63的表达无关联性(P>0.05),见表5。
2.6 AR与TNBC的超声及造影征象的相关性AR表达阳性者15例,阳性率为20.8%。TNBC结节直径、生长方向(纵横比)、形态、边界、边缘、微钙化、后方回声,血流信号分级、淋巴结转移、超声造影表现等超声征象均与AR的表达无相关性(P>0.05),见表6。
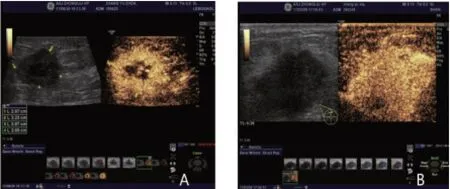
图3 TNBC与NTNBC患者的超声造影图
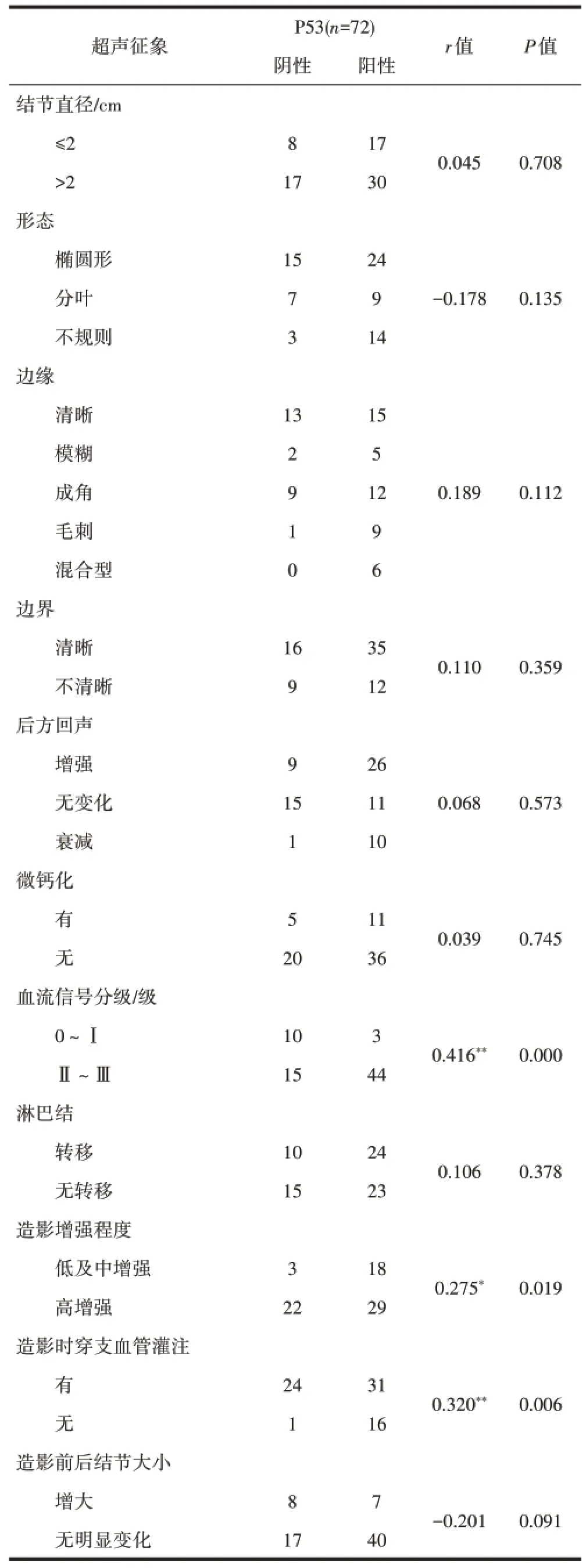
表3 TNBC的超声及造影征象与P53表达的相关性
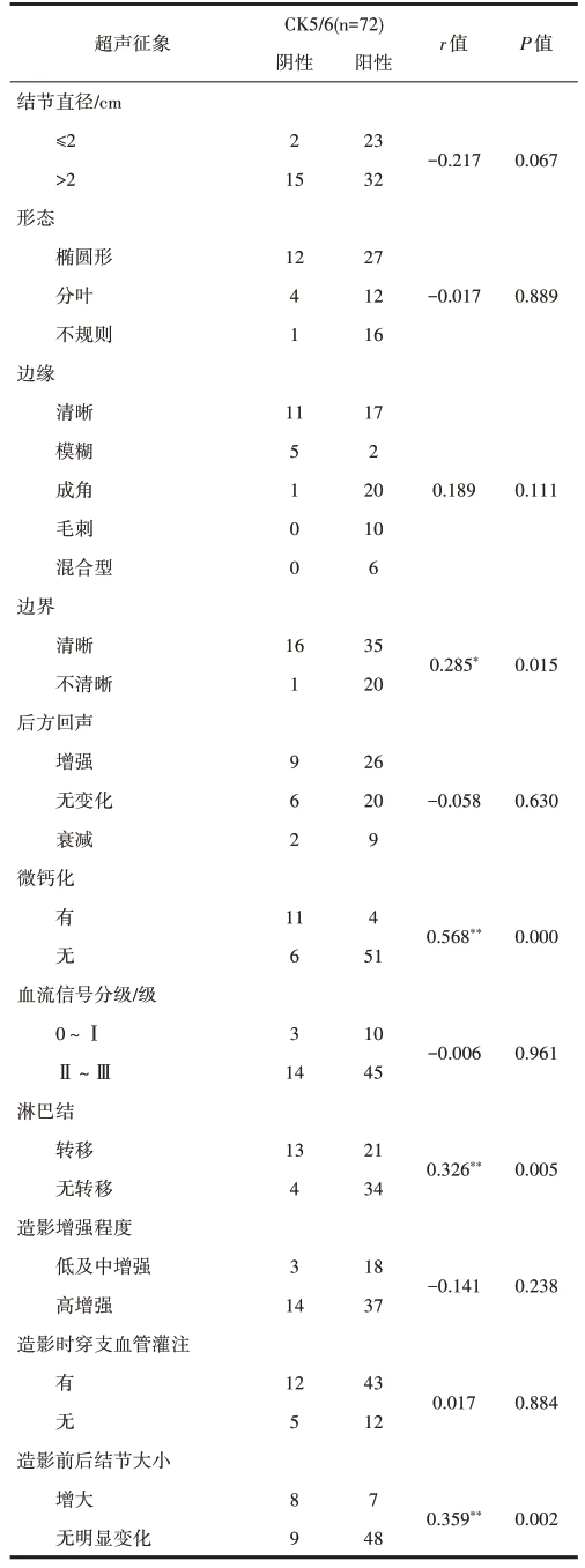
表4 TNBC的超声及造影征象与CK5/6表达的相关性
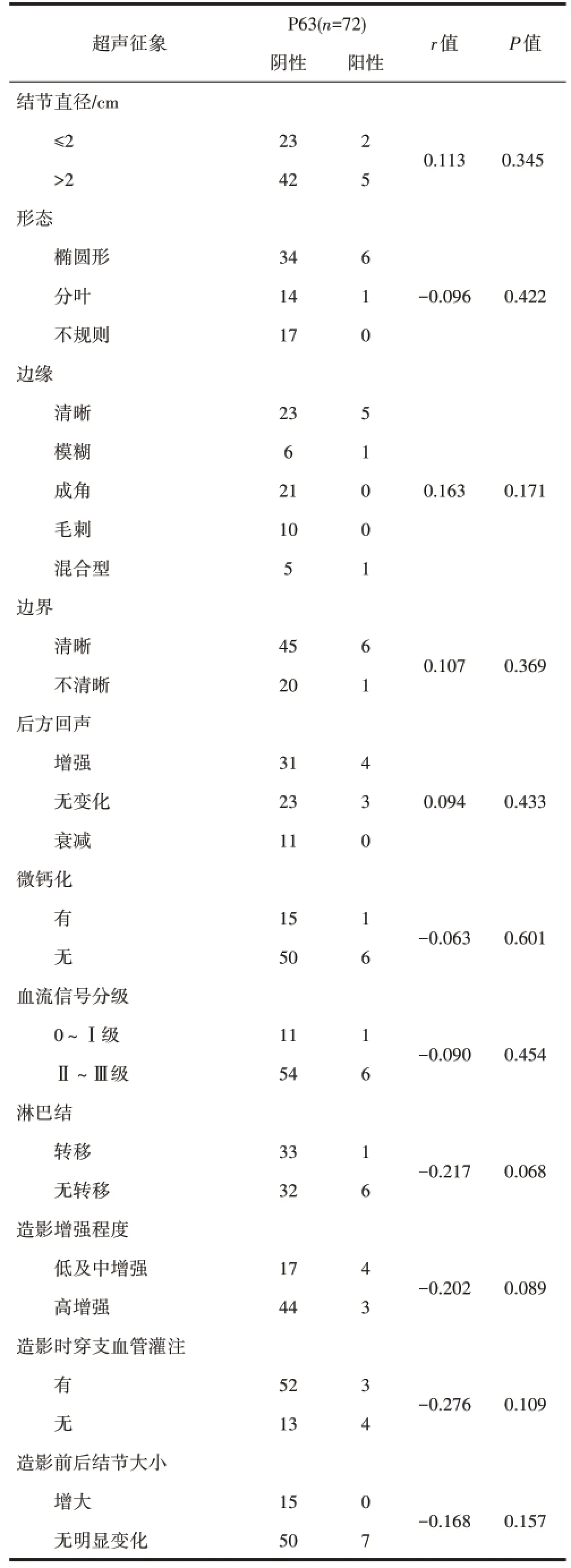
表5 TNBC的超声及造影征象与P63表达的相关性
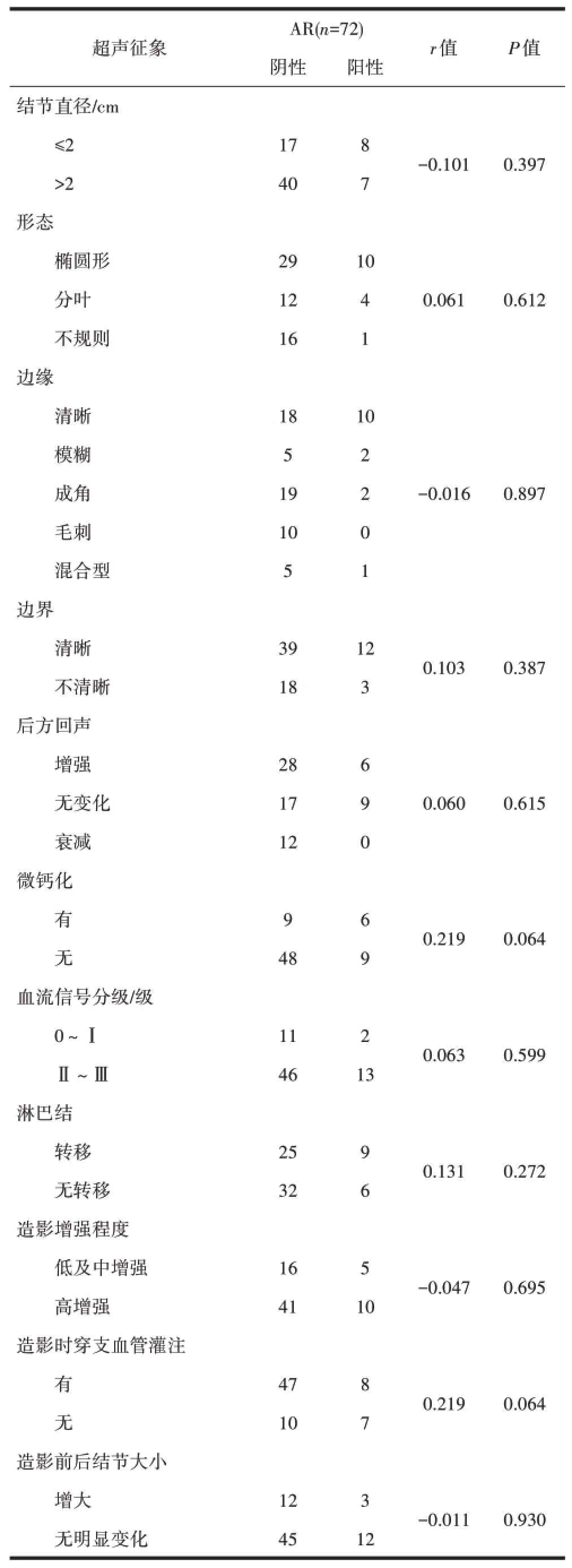
表6 TNBC的超声及造影征象与AR表达的相关性
3 讨论
本研究发现TNBC大多具有形态规则,边缘、边界清晰,后方回声增强的表现,相较NTNBC微钙化相对少见,淋巴结转移也相对少见。病灶的生长方向(纵横比)在结节生长早期对诊断有意义,乳腺结节在生长期间没有一定的规律性[17],皮肤及胸大肌的阻力使得结节在生长一段时间后无法继续纵向生长,故对病灶纵横比未探讨,超声造影技术利用造影剂增强对比,造影剂中的气体微泡与软组织及血液产生声阻抗差异,对结节内部的微循环灌注及新生的血管显示较清晰[10],可以观察病灶微血流灌注情况。本研究超声造影检查结果显示,TNBC以高增强模式为主,此外造影前后结节的大小测量无明显变化,与张玉竹等研究结果一致[11]。造影后NTNBC结节大多显示边缘欠清晰,结节增强范围较二维图像增大,结节的测量值增大。超声造影可对良恶性肿瘤进行初步判断,联合超声造影定性和定量研究,可提高恶性肿瘤的检出率及鉴别TNBC与NTNBC的能力。本研究发现TNBC的二维超声及造影表现相较NTNBC更倾向于良性肿瘤的特征,可能与基因的表达不同有关[12-13]。相关基因及其表达可影响肿瘤的生物学行为[14]。本研究结果显示CK5/6表达阳性的结节多倾向于边界不清、边缘毛刺,病灶形态多呈分叶状、不规则或者混合型,呈浸润性生长,体积较大,内部有微钙化,存在淋巴结的转移,造影后结节测量值较造影前增大。但杨洁等[15]研究发现微小钙化与三阴性乳腺癌CK5/6表达无明显相关性。由此考虑CK5/6阳性表达在TNBC不同病程的时期是否会造成不同的影响。本研究P53在TNBC中表达阳性的概率高,病灶的血供丰富,在超声造影检查中表现结节呈高增强、且穿支血流丰富。生物学的指标影响病灶的超声表现,而超声诊断直接影响临床的诊断治疗以及预后的评估。TNBC的超声以及造影的征象与CK5/6、P53的表达有一定相关性,故不同的基因可以作为新辅助化疗的不同靶点和预后观测的指标,为临床可提供诊疗依据。
本研究发现TNBC结节超声征象与AR、P63的表达无相关性。但有研究表明,AR表达与患者年龄显著相关,年龄大于50岁者更易检测到AR阳性[16-17]。由于本研究选择额的样本含量有限,AR、P63的表达水平在TNBC发生、发展中的作用及作为预后指标尚有争议,对这些免疫生物指标间的互相作用及影响研究的尚少,它们在肿瘤的生长过程中是否有相互调节的作用,值得进一步深入研究。

