多重实时荧光定量PCR方法在高危型人乳头瘤病毒E6/E7 mRNA检测中的应用
王晓明,戴卫健,余道军,刘宏钱(1.浙江中医药大学医学技术学院,杭州 310030;2.浙江大学医学院附属杭州市第一人民医院 a. 检验科,b. 输血科,杭州 310006)
高危型人乳头瘤病毒(high-risk human papillomavirus,hrHPV)的感染与宫颈癌的发生密切相关。据统计,有近95%的宫颈癌由hrHPV的持续感染导致,而且hrHPV的持续感染是宫颈癌发生发展的必要条件[1-2]。
大多数女性的HPV感染属于短暂的一过性感染,只有10%的感染长期持续[3]。虽然HPV DNA检测的分析灵敏度很高,但其临床特异性较低,导致其在临床诊断中存在一定的局限性[4]。hrHPV感染宿主后的致癌过程需要其自身病毒基因组整合到宿主基因组中,当HPV自身的核酸整合进入宿主的基因组时,其转录水平将大幅度提高,预示着宫颈组织发生异常且在逐步恶化[5]。hrHPV E6/E7 mRNA的检测可对病毒的活动程度和疾病的进程进行监控,这有利于宫颈癌的早期预防和早期治疗,同时也为宫颈疾病提供更为可靠的临床诊断依据[5]。本研究运用多重实时荧光定量PCR技术(multiplex reverse transcript real time PCR, MRT-PCR)建立了一种简便、快速、准确、高效的hrHPV E6/E7 mRNA检测方法,可实现一步法单管检测14种hrHPV E6/E7 mRNA,为临床更有效更特异地筛查宫颈病变提供了可靠的技术手段。
1 材料与方法
1.1标本来源 收集2019年6—12月于杭州市第一人民医院进行HPV检测并经HPV DNA筛查试剂[人乳头瘤病毒基因分型(23型)检测试剂盒(PCR-反向点杂交法)]筛查为HPV 14种高危亚型(HPV 16、18、31、33、35、39、52、45、51、56、58、59、66、68)阳性的宫颈分泌物标本223例,患者年龄25~79岁。标本采集后于2~8 ℃保存,72 h内进行检测。单纯疱疹病毒Ⅱ型、梅毒螺旋体、解脲支原体、人型支原体阳性分泌物标本、淋病奈瑟菌、白念珠菌、大肠埃希菌、金黄色葡萄球菌等保存菌种均来自杭州市第一人民医院检验科。
1.2主要仪器和试剂 数字PCR仪QX200TMDroplet DigitalTM(美国Bio-Rad公司),荧光定量PCR仪Lightcycler 480(瑞士Roche公司);HPV 6、11、16、18、26、31、33、35、39、40、42、43、44、45、51、52、53、54、56、58、59、61、66、67、68、69、70、71、72、73、81、82、83、CP8304全基因组参考品(中国食品药品检定研究院),HPV DNA筛查试剂人乳头瘤病毒基因分型(23型)检测试剂盒(PCR-反向点杂交法,深圳亚能公司),Aptima®HPV检测系统(美国Hologic公司),DNA/RNA提取试剂盒TIANamp Virus DNA/RNA Kit(北京天根公司),数字PCR试剂2×Preamplification Supermix(美国Bio-Rad公司),DNase Ⅰ、RevertAid逆转录酶、Taq酶、Ribonuclease Inhibitor、dNTP(大连TaKaRa公司)。引物和探针委托上海生工公司合成,其中HPV 16、18、31、33、35、39、52的探针为羧基荧光素(FAM)标记,HPV 45、51、56、58、59、66、68的探针为六氯荧光素(HEX)标记,内参基因GAPDH的探针为吲哚二羧菁(Cy5)标记。
1.3方法
1.3.1薄层液基细胞学检测(thinprep cytologic test,TCT) 用ThinPrep2000制片系统对所采集的223例HPV疑似感染患者样本进行液基薄层细胞制片技术处理,固定及染色后进行镜检。检查结果采用TBS系统进行细胞分类诊断。鳞状细胞划分等级包括:正常、没有明确诊断意义的不典型鳞状上皮细胞(ASCUS)、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)、鳞状细胞癌(SCC)、腺癌(AC)。
1.3.2宫颈组织病理学检测 所有223例患者均行阴道镜下多点活检并在规定时间内进行病理检查。宫颈组织病理学检测是宫颈病变鉴定的“金标准”。宫颈组织病理依据《病理学》标准分为:正常或炎症、异型上皮细胞局限于宫颈上皮的下1/3(CIN Ⅰ)、异型上皮细胞累及宫颈上皮的下1/3~2/3(CIN Ⅱ)、异型上皮细胞超过宫颈上皮全层的2/3或累及全层宫颈腺但未突破基底膜(CIN Ⅲ)以及浸润癌。病理检查为CIN Ⅱ及以上级别被认为是宫颈癌前病变。TBS分类和组织病理学相对应的节点分别是:LSIL对应CIN Ⅰ,HSIL对应CIN Ⅱ和CIN Ⅲ。
1.3.3HPV E6/E7 mRNA标准品的制备 HPV E6/E7 mRNA标准品的制备与验证参考黄杰等[6]所用方法并经过测序验证,PCR模板采用14种hrHPV全基因组参考品。
1.3.4Aptima®HPV检测HPV E6/E7 mRNA 用转录介导等温核酸扩增(TMA)技术检测14种hrHPV E6/E7 mRNA,包括HPV 16、18、31、33、35、39、45、51、52、56、58、59、66和68。按照Aptima®HPV试剂说明书进行。
1.3.5一步法MRT-PCR法检测HPV E6/E7 mRNA 用TIANamp Virus DNA/RNA Kit提取RNA,按照试剂盒说明书操作,用50 μL DEPC水洗脱。取提取的RNA 9 μL,加入2×DNase Ⅰ buffer 10 μL, DNase Ⅰ 1 μL,37 ℃ 30 min。一步法MRT-PCR反应总体积为40 μL,包括消化好的RNA模板2 μL,5×RT Buffer 4 μL,25 mmol/L MgCl24 μL,10 mmol/L dNTP 1 μL,30条10 μmol/L的扩增引物各0.4 μL,15条10 μmol/L探针各0.2 μL,200 U/μL逆转录酶0.5 μL,5 U/μL Taq酶1 μL,用RNase Free H2O补足40 μL。引物及探针序列见表1,其中GAPDH-F、GAPDH-R、GAPDH-P分别为内参的扩增引物和探针。反应条件为:42 ℃ 30 min,80 ℃ 2 min,94 ℃ 2 min,40个循环(94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s),并于72 ℃采集FAM、HEX、Cy5 3个通道荧光信号,反应均在LightCycler 480 PCR仪上完成,以循环阈值(Ct)<38作为标本和内参阳性判断阈值,内参Ct值>38作为标本不合格阈值。

表1 引物及探针序列
1.3.6一步法MRT-PCR的灵敏度与特异性 制备的14种hrHPV E6/E7 mRNA标准品中提取的RNA用数字PCR进行定量,根据测得的拷贝数将其用含10 ng/mL人基因组的TE溶液按10倍梯度稀释成1×108copies/μL至1×101copies/μL。每个梯度取2 μL RNA作为模板进行MRT-PCR反应,以测定其灵敏度,每个梯度重复检测20次,以20次重复检测中19次为阳性的浓度梯度作为该型别的检出限。
用TIANamp Virus DNA/RNA Kit提取淋病奈瑟菌、白念珠菌、大肠埃希菌、金黄色葡萄球菌以及单纯疱疹病毒Ⅱ型、梅毒螺旋体、解脲支原体、人型支原体阳性分泌物标本核酸,不经过DNaseⅠ处理,取2 μL作为模板,同时取HPV 6、11、26、40、42、43、44、54、61、67、69、70、71、72、73、81、82、83全基因组参考品2 μL作为模板,进行MRT-PCR反应,以评估其特异性。
1.4统计学分析 用Kappa检验进行统计分析,计算Kappa值来评判2种方法检测结果的一致性。Kappa≥0.75,说明2种方法检测结果的一致性较好;0.4≤Kappa<0.75,说明一致性一般;Kappa<0.4,说明一致性较差。
2 结果
2.1MRT-PCR检测的灵敏度与特异性分析 以梯度稀释的14种hrHPV标准品RNA为模板,进行多重PCR检测。其中,HPV 16、18、31、33、35、39、45、66、68等9种型别能最低检测至10 copies/μL,而HPV 51、52、56、59、58等5种型别最低检测至100 copies/μL(图1)。用MRT-PCR法检测14种高危型以外的其余18种HPV型别以及女性生殖道中其他常见病原体包括淋病奈瑟菌、白念珠菌、大肠埃希菌、金黄色葡萄球菌、单纯疱疹病毒Ⅱ型、梅毒螺旋体、解脲支原体、人型支原体阳性等的核酸,检测结果均为阴性,表现出良好的检测特异性。
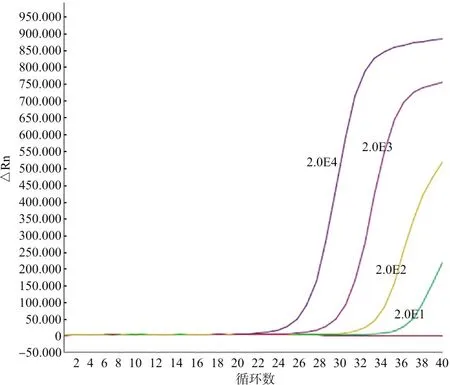
图1 多重实时荧光定量PCR检测HPV16 RNA的敏感性
2.2TCT检测和组织病理学诊断 223例临床样本的TCT检测和组织病理学诊断结果见表2。

表2 组织病理学诊断结果
2.32种HPV E6/E7 mRNA检测方法比较 结果见表3。2种检测方法的总符合率分析结果显示,Kappa值为0.910(95%置信区间)。
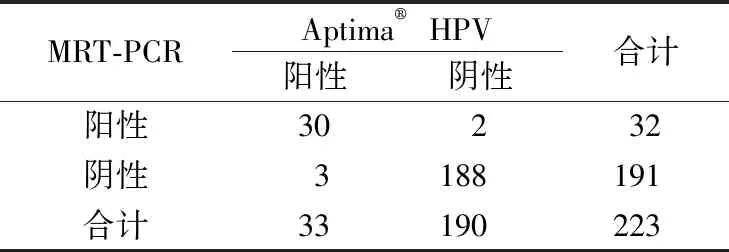
表3 MRT-PCR与Aptima® HPV的分组情况
2.4HPV E6/E7 mRNA与宫颈病变关联性分析 Aptima®HPV检测结果显示,223例标本中共有33例样本为阳性,包括12例(6.06%)正常样本,13例(81.25%)CIN Ⅰ级样本,6例(85.71%)介于CIN Ⅱ级和CIN Ⅲ级样本以及2例(100%)SCC样本。以组织病理结果为CIN Ⅰ及以上的作为阳性,Aptima®HPV临床检测敏感性为84.0%,特异性为94.0%,阳性预测值为63.6%,阴性预测值为97.9%。223例样本使用一步法MRT-PCR进行hrHPV E6/E7 mRNA的检测,结果为阳性的样本有32例,包括包括11例(5.56%)正常样本,13例(81.25%)CIN Ⅰ级样本,6例(85.7%)介于CIN Ⅱ级和CIN Ⅲ级样本以及2例(100%)SCC样本。以组织病理结果为CIN Ⅱ及以上的作为阳性,MRT-PCR检测方法临床检测敏感性为84.0%,特异性为94.4%,阳性预测值为65.6%,阴性预测值为97.9%。
3 讨论
目前市场上已有几种HPV E6/E7 mRNA检测的产品。其中Hologic Gen-Probe 的Aptima HPV Assay是目前美国食品药品监督管理局最新并且是唯一批准的检测14种hrHPV E6/E7 mRNA的新一代检测产品,但其检测设备呈封闭式,国内的普及率低。PRETECT HPV-Proofer产品检测的型别偏少,只能检测5种hrHPV E6/E7 mRNA,包括HPV 16、18、31、33和45。另外, Kodia的hrHPV E6/E7 mRNA定量检测试剂盒是我国国家食品药品管理局唯一批准的HPV E6/E7 mRNA检测产品,由于采用的为b-DNA信号放大法,操作步骤比较繁琐,操作时间较长。本研究建立的MRT-PCR法适用于几乎所有荧光定量PCR仪,可检测14种hrHPV E6/E7 mRNA且检测时间短,操作简便。分别采用MRT-PCR法及Aptima®HPV检测系统对223例临床标本中14种hrHPV E6/E7 mRNA进行检测,结果表明2种方法检测结果具有较好的一致性。此外,223例临床标本 hrHPV E6/E7 mRNA检测结果与细胞病理学以及组织病理学检测结果比较,发现随着细胞学病变程度的加重,hrHPV E6/E7 mRNA的阳性检出率也逐渐升高。这也进一步证明HPV E6/E7 mRNA转录水平与宫颈细胞病变的严重程度相关。
综上所述,本研究建立了一种操作简便、适用普遍、检测快速兼具高临床灵敏度和特异性的hrHPV E6/E7 mRNA检测方法,为临床上宫颈病变筛查提供了一种可靠的手段,在宫颈病变筛查中具有重要的临床应用价值。

