反应温度及催化剂金属氧化物负载量对1-甲基萘加氢裂化制BTX反应性能的影响
杜佳楠, 张燕挺, 吴 韬, 陈江锋, 陈胜利
(中国石油大学(北京)重质油国家重点实验室,北京 102249)
催化裂化柴油(LCO)是催化裂化(FCC)工艺中一种十分重要的产品,其含有大量的双环芳烃和多环芳烃(共约70%~90%)。随着全球原油性质的逐渐恶化,越来越多的重油和渣油组分成为FCC装置的原料[1],使得LCO的产品质量日益变差,氮、硫含量增加,十六烷值降低[2]。同时柴油质量标准需求不断提高,通过加氢处理LCO用于调和柴油产品难以满足柴油质量要求[3]。而且目前中国柴油市场已经逐渐饱和,LCO的转化利用成为炼油界急需解决的重要问题。
另一方面,近些年中国化工行业对苯、甲苯和二甲苯(BTX)的需求量激增,市场上呈现供不应求的局面[4-6]。考虑到LCO中富含芳烃,利用LCO加氢裂化生产BTX不仅可以解决中国柴油产能过剩的问题,还能解决BTX短缺的局面,具有非常高的工业应用潜力。
目前,工业上利用LCO生产BTX的工艺流程主要分为三部分[7-10]:首先是将LCO加氢处理去除油品中的硫、氮杂质;然后是将油品进行加氢裂化处理,得到C2~C4轻烃、C6~C9芳烃和C5~C12液态饱和烃;最后对油品中的液态饱和烃(包括环烷烃)进行催化重整处理,以使过度加氢产物(环烷烃)转化为芳烃。若能大幅度提高第二步加氢裂化过程中BTX的选择性,则可以减少催化重整这一环节,从而简化工艺流程、提高经济效率。目前,针对提高BTX选择性的研究,主要集中在分子筛载体的改性和金属活性组分的调变上,但尚未发现有催化剂只催化多环芳烃而不对单环芳烃进行加氢裂化,故要实现多环芳烃的深度加氢必然会导致单环芳烃的过度加氢,从而降低BTX收率。加氢反应为强放热反应,因此提高反应温度可以抑制加氢反应的进行。有研究[11-13]表明:在相同反应温度下,单环芳烃加氢饱和反应的热力学平衡常数远小于双环芳烃中第一个芳环选择性加氢反应的热力学平衡常数。从热力学角度来说,提高反应温度可以更大程度地抑制单环芳烃深度加氢。目前工业及中试的加氢裂化反应温度大约在345~425 ℃,为了进一步提高BTX的选择性,笔者提出高反应温度(420~500 ℃)条件下的选择性加氢裂化;然而反应温度的改变会影响催化剂金属中心的加氢能力。LCO中的主要成分为双环芳烃,有研究者[14]采用1-甲基萘作为模型物对LCO进行研究,并认为Ni、W比较适合作为LCO及其模型物加氢裂化的加氢组分。故笔者以1-甲基萘作为催化柴油的模型化合物,研究催化剂中W、Ni金属氧化物负载量及配比对高温体系下加氢裂化反应性能的影响。
1 实验部分
1.1 原料和试剂
1-甲基萘(C11H10,质量分数96%),上海麦克林生化科技有限公司产品;铝酸钠(NaAlO2,CP,质量分数41%(以Al2O3计))、偏钨酸铵([NH4]6W7O24·6H2O,AR,质量分数85%~89%),国药集团化学试剂有限公司产品;硅胶(工业级),青岛海洋化工有限公司产品;氢氧化钠(NaOH,AR,质量分数96%),环己烷(C6H12,AR,质量分数99.5%),北京现代化工精细化学品有限公司产品;四乙基溴化铵(TEABr,质量分数98%),阿拉丁试剂(上海)有限公司产品;硝酸镍(Ni(NO3)2·6H2O, AR,质量分数98%)、氯化铵(NH4Cl,AR,质量分数99.5%),天津市光复精细化工研究所产品;二硫化碳(CS2,AR,质量分数99%),天津福晨化学试剂厂产品。
1.2 催化剂的制备
1.2.1 Beta分子筛载体的合成
n(SiO2)/n(Al2O3)=180的Beta分子筛的制备步骤如下:首先,将20 g四乙基氢氧化铵溶液(质量分数35%)、2.52 g NaOH以及12 g四乙基溴化铵加入到32 g的去离子水中,充分搅拌至溶液呈现清澈状态。接着向该溶液中加入20 g硅胶以及1.0 g Beta(n(SiO2)/n(Al2O3)=25)晶种,在常温下搅拌130 min。随后将凝胶溶液转移到含有聚四氟乙烯内衬的水热反应釜中,于140 ℃下晶化72 h。反应结束后骤冷、离心洗涤至pH值为8~9,在120 ℃烘箱中干燥240 min后,在550 ℃下焙烧 360 min 脱出有机模板剂。
以焙烧后的Beta分子筛与1 mol/L的NH4Cl溶液按质量比1/10混合,在90 ℃的水浴条件下进行离子交换240 min,将分子筛中的Na+转化为NH4+。随后离心洗涤去除溶液中多余的NH4+、Cl-和Na+等。将分子筛烘干,并在马弗炉中 550 ℃ 下焙烧180 min,从而将分子筛中NH4+转化为H+。重复上述离子交换和焙烧过程各1次,得到H-Beta分子筛样品。
1.2.2 加氢裂化催化剂的制备
以H-Beta分子筛为载体,采用等体积共浸渍方法制备双功能加氢裂化催化剂。具体制备过程如下:首先以偏钨酸铵为钨源、硝酸镍为镍源以一定配比配制共浸渍液,将其均匀地滴加到H-Beta分子筛上。将浸有偏钨酸铵和硝酸镍的H-Beta分子筛在常温下自然干燥,然后将H-Beta分子筛置于550 ℃下焙烧180 min得到加氢裂化催化剂。将催化剂压片、筛分,得到粒径380~830 μm催化剂样品,记为aW-bNi/Beta(a为WO3质量分数,b为NiO质量分数)。不同W-Ni负载量催化剂样品的金属组分及分子筛所占比例如表1所示。

表1 不同W、Ni金属氧化物负载量加氢裂化催化剂的化学组成Table 1 The chemical components of hydrocrackingcatalysts with different W-Ni loadings
1.3 催化剂的表征
采用Bruker D8 Advance型X射线衍射仪(XRD)表征催化剂样品的物相及结晶状况。测定条件:Cu靶,Kα射线,扫描角度2θ范围为5°~50°,扫描速率为1°/min,管电压40 kV,管电流40 mA,步长为0.02°。
为了考察催化剂硫化态金属在载体的分布情况,使用FEI Tecnai G2 F20透射电子显微镜(TEM)在200 kV下对硫化后的催化剂样品进行观察。每个催化剂样品拍取10张不同位置的TEM照片,在每张照片中选取约30个活性组分晶格条纹进行统计测量,通过式(1)和式(2)可以测得催化剂表面的金属硫化物条纹的分散度(D,nm)及平均长度(L,m)[15]。式(1) 和式(2)中,ni为金属硫化物条纹上活性金属原子数。
(1)
L=3.2×(2ni-1)
(2)
采用美国Micrometrics公司的ASAP2020型物理吸附仪表征催化剂的孔结构。催化剂样品先在250 ℃、1.33×10-3Pa脱气处理12 h,再降温至-196 ℃,进行N2吸附-脱附测试。
采用实验室自制氨-程序升温脱附(NH3-TPD)装置测量催化剂的酸量及酸强度。具体操作步骤:将500 mg催化剂样品(粒径380~830 μm)在600 ℃活化30 min,然后110 ℃下吸附氨气30 min;关闭氨气,基线平稳后以升温速率10 ℃/min将样品加热至600 ℃脱附。将脱附掉的氨气用标准HCl溶液吸收,并用标准NaOH溶液进行滴定,得到催化剂的总酸量。
采用德国Bruker公司生产的Tensor 27型红外光谱仪测定催化剂的酸性质,即测定催化剂上Lewis酸(L酸)、Brönsted酸(B酸)的含量。实验过程如下:将20 mg催化剂压成薄片,在1×10-5Pa的真空度下吸附吡啶30 min后,程序升温分别在200 ℃和350 ℃测试吡啶红外光谱。
采用上海美析仪器有限公司的UV-1800 S型紫外-可见光光度计(UV-Vis DRS)测定催化剂上金属的配位情况。光谱扫描范围为200~800 nm,扫描速率为100 nm/min,BaSO4作为参比标准物。
催化剂还原能力的测定在实验室自制的H2-程序升温还原(H2-TPR)装置上进行的。具体实验步骤如下:将30 mg的催化剂(粒径380~830 μm)在500 ℃氩气氛围下活化30 min,气流流速为40 mL/min,待冷却至110 ℃保持气流流速不变,将气体切换为体积分数为6%H2/Ar的混合气,并以10 ℃/min的升温速率,升至950 ℃。
1.4 催化剂加氢裂化反应性能的评价
以1-甲基萘作为催化柴油模型反应物,对制备的催化剂样品进行加氢裂化反应催化性能的评价,采用海安石油科研仪器有限公司生产的高温微型反应装置进行实验。反应器为内径9 mm、长度 500 mm 的不锈钢固定床反应器。使用前将粒径380~830 μm的催化剂样品和石英砂按照质量比 1/6 混合后,填装到反应管的中间恒温区间,并在反应管的两端填满石英砂。反应前需要将催化剂进行预硫化处理,使得金属氧化物转变成金属硫化物。具体操作为:首先以CS2为溶质,环己烷为溶剂,配置CS2质量分数为1.5%的预硫化溶液,在压力6 MPa、氢/油体积比为600的条件下进料,在进料过程中,反应温度以升温速率2 ℃/min升至320 ℃,并维持180 min完成催化剂的硫化。随后以升温速率5 ℃/min升至反应温度(420~500 ℃),进料切换为1-甲基萘,进行加氢裂化反应。反应压力维持在6 MPa,反应质量空速1~12 h-1,氢/油体积比1300。
1-甲基萘加氢裂化的产物比较复杂,有气相产物和液相产物。气相产物中主要为C1~C4烷烃,采用SP2100 型气相色谱仪分析,色谱柱为Al2O3毛细柱(30 m×0.530 mm);液相产物主要为C3~C11,采用SP3420 型气相色谱仪分析,色谱柱为PONA毛细柱(50 m×0.2 mm×0.5 μm)。采用HIR-944B型高频红外碳硫分析仪(无锡市高速分析仪器有限公司产品)测量催化剂的积炭含量。1-甲基萘转化率(x1-MN,%)、BTX收率(yBTX,%)和BTX选择性(sBTX,%)定义如式(3)~(5):
(3)
(4)
(5)
式(3)~(5)中,N1-MN,0、N1-MN,t为1-甲基萘进料和出料时的摩尔流速,mol/h;NBTX,t为出料物中BTX的摩尔流速,mol/h;摩尔流速为对应物质的质量流速和相对分子质量之比。
2 结果和讨论
2.1 不同W、Ni金属氧化物负载量催化剂的表征
图1为不同W、Ni金属氧化物负载量催化剂催化 1-甲基萘加氢裂化反应前后的XRD谱图。由图1(a)可见,与Beta分子筛的标准卡片(PDF#48-0074)相比,H-Beta分子筛样品具有典型的BEA拓扑结构,有很强的特征衍射峰,结晶度高且无杂晶。负载金属氧化物后,特征衍射峰的强度呈现明显下降的趋势,并且金属氧化物负载量越高,特征衍射峰的强度越低。这主要是由于金属氧化物负载量的增加,使催化剂中Beta分子筛的含量减少所致。而且根据WO3的标准卡片(PDF#32-1395)得知:当只负载WO3时,XRD谱图在2θ为23.143°、23.643°、24.366°、26.839°、33.576°、33.676°、33.915°和41.870°处出现明显的WO3特征衍射峰,此时WO3在载体上分散不均匀。当负载W、Ni双金属氧化物时,XRD谱图中WO3的特征衍射峰明显减弱甚至消失。显然,Ni作为助剂可以有助于WO3在分子筛载体上的分散,进而提高WO3的分散度。但是从图1(b)可以看出,负载WO3的催化剂,在反应后的XRD谱图中WO3的特征衍射峰明显下降,甚至消除。这主要由于在反应前的预硫化过程中,负载在分子筛上的WO3硫化为WS2的同时,发生了活性金属再分散[16]。
图2为不同W、Ni金属氧化物负载量催化剂的TEM照片。由图2可见,5种催化剂样品的TEM照片中均存在清晰的黑色线状条纹,为WS2条纹。通过式(1)和式(2)计算可以得到WS2在载体上的分散度(见表2)。不同W、Ni金属氧化物负载量催化剂样品的硫化条纹间的距离均为0.6 nm左右,且硫化态催化剂的硫化条纹长度和分散度也大致相同。
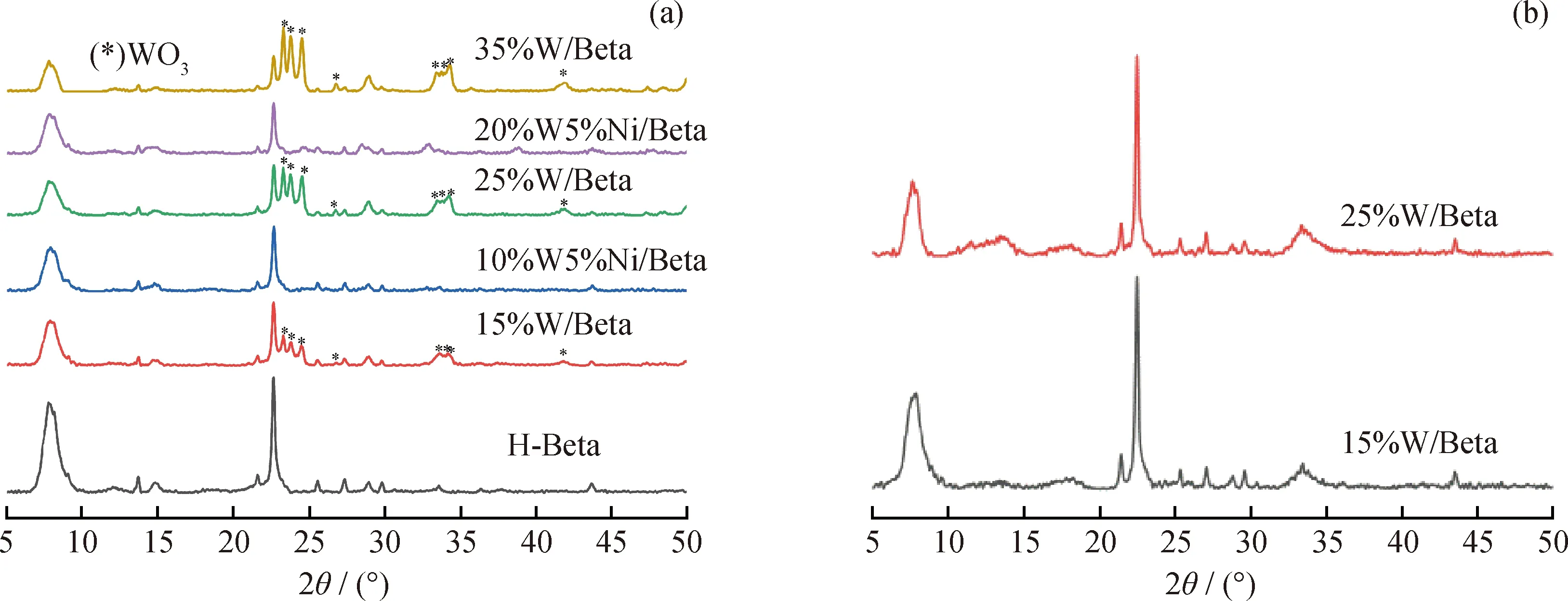
图1 不同W、Ni金属氧化物负载量催化剂在1-甲基萘加氢裂化反应前后的XRD谱图Fig.1 XRD patterns of the catalysts with different loadings of W and Ni metal oxides before andafter 1-methylnaphthalene hydrocracking reaction(a) Before reaction; (b) After reaction

图2 硫化后不同W、Ni金属氧化物负载量催化剂的TEM照片Fig.2 TEM images of sulfide catalysts with different loadings of W and Ni metal oxides(a) 10%W-5%Ni/Beta; (b) 15%W/Beta; (c) 20%W-5%Ni/Beta; (d) 25%W/Beta; (e) 35%W/Beta

表2 WS2条纹平均长度(L)及其在催化剂表面的分散度(D)Table 2 The length (L) and dispersion (D) ofWS2 on the surface of the catalysts
图3为不同W、Ni金属氧化物负载量催化剂的N2吸附-脱附曲线及孔径分布。由图3可见,催化剂样品均在低压(p/p0<0.1)发生显著的吸收,随后快速到达一个吸附平台,为典型的Ⅰ型等温曲线。表3为不同金属氧化物负载量催化剂的孔结构参数。从表3可以看出,与H-Beta分子筛相比,负载金属氧化物后催化剂的介孔和微孔比表面积及孔体积均减小。这主要是因为催化剂中含有质量分数25%的金属氧化物,造成部分孔道覆盖或变窄,使催化剂的比表面积和孔体积均明显小于Beta分子筛[17]。
图4为不同W、Ni金属氧化物负载量催化剂的NH3-TPD谱图。由图4可见,当Beta分子筛负载上W、Ni金属氧化物后,弱酸峰(220~240 ℃)向高温方向偏移,强酸峰(380~400 ℃)向低温方向偏移,说明负载W-Ni使得催化剂样品的弱酸强度小幅度增强,强酸强度小幅度减弱。表4为不同金属氧化物负载量催化剂的酸量分布表。由表4可见,当Beta分子筛负载上W、Ni金属氧化物后,催化剂的酸量会明显增加,但随着金属氧化物负载量的进一步增加,催化剂的酸量呈现下降的趋势。这主要因为W、Ni金属氧化物中含有大量的L酸(这点可以在图5中看到),使得负载W、Ni金属氧化物后催化剂的酸量会增加,而随着W、Ni金属氧化物负载量的增多,催化剂中Beta分子筛载体的占比减少,W、Ni金属氧化物会覆盖载体中的部分酸性位,因此催化剂的酸量减弱。
图5为不同W、Ni金属氧化物负载催化剂的Py-IR谱图。由图5可见,所有催化剂样品均在1450、1490和1540 cm-1处存在吡啶的脱附峰,其中1450 cm-1处的峰为L酸作用的结果,1540 cm-1处的峰为B酸作用的结果,而1490 cm-1处的峰为L酸和B酸共同作用的结果。当负载上W、Ni金属氧化物后,催化剂上的L酸量明显增加。这是由W、Ni金属氧化物带有大量L酸导致的。当只负载W的氧化物或者同时负载W、Ni金属氧化物时,随着负载量的增加,L/B酸量比逐渐增加。W、Ni金属氧化物总负载量相同时(20%W-5%Ni/Beta和25%W/Beta;10%W-5%Ni/Beta和15%W/Beta),W-Ni/Beta 的L/B酸量比明显高于W/Beta的L/B酸量比。这是由于NiO的L酸量比WO3的高。
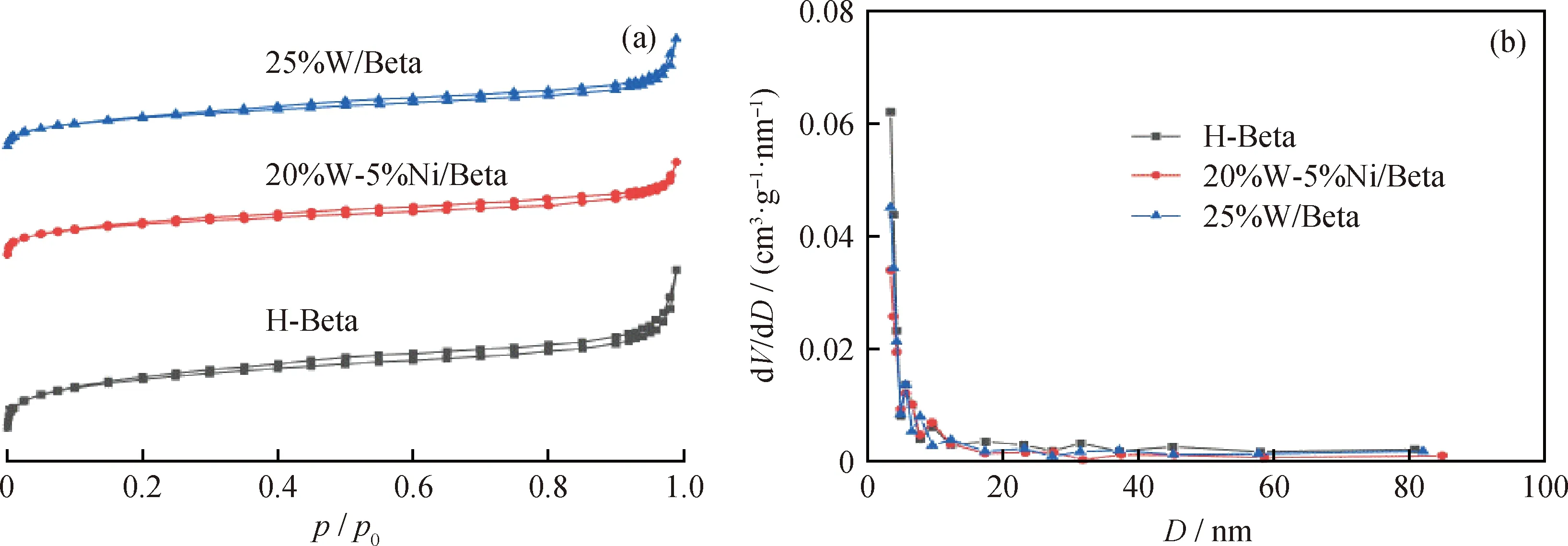
图3 不同W、Ni金属氧化物负载量催化剂的N2吸附-脱附等温线和孔径分布Fig.3 N2 adsorption-desorption isotherm and pore size distribution of the catalysts withdifferent loadings of W and Ni metal oxides(a) N2 adsorption-desorption isotherm; (b) Pore size distribution

表3 不同W、Ni金属氧化物负载催化剂的孔结构参数Table 3 Pore structure of the catalysts with different loadings of W and Ni metal oxides
图6为不同W、Ni金属氧化物负载量催化剂的UV-Vis积分球漫反射谱图。由图6可见,在 260~280 nm 处的峰为四面体配位W氧化物的吸收峰,在280~330 nm处的峰为八面体配位W氧化物的吸收峰[18],在420~460 nm处的峰为Ni氧化物的吸收峰[19]。当加入Ni作为助剂时,八面体W氧化物的吸收峰向低波数范围偏移;四面体W氧化物的吸收峰消失。由于八面体W氧化物更容易还原,因此加入Ni作为助剂时的催化剂具有更好的还原性和硫化性能。
图7为不同W、Ni金属氧化物负载量催化剂的H2-TPR谱图。浸渍在载体上的W、Ni金属氧化物对H2的还原能力与金属和载体的相互作用、金属占据载体的活性位有关。由图7可见,各催化剂样品的谱图中均出现2个还原峰,其中低温范围内的还原峰一般认为是由于八面体配位W的氧化物以及大部分Ni的氧化物发生还原造成的,而高温范围内的还原峰一般认为是四面体配位W的氧化物发生还原反应造成的[20]。相比于15%W/Beta、25%W/Beta的出峰位置向高温偏移,主要是因为金属氧化物负载量的增加使得其占据更多的酸性活性位,从而使得部分金属氧化物和Beta分子筛的相互作用更强;与25%W/Beta相比,Ni的加入使得20%W-5%Ni/Beta的峰位置大幅度向低温处偏移,还原能力大幅度提高。这主要是因为Ni的加入使得W的结合能下降[20],从而使得金属氧化物和分子筛酸性中心的作用减弱。
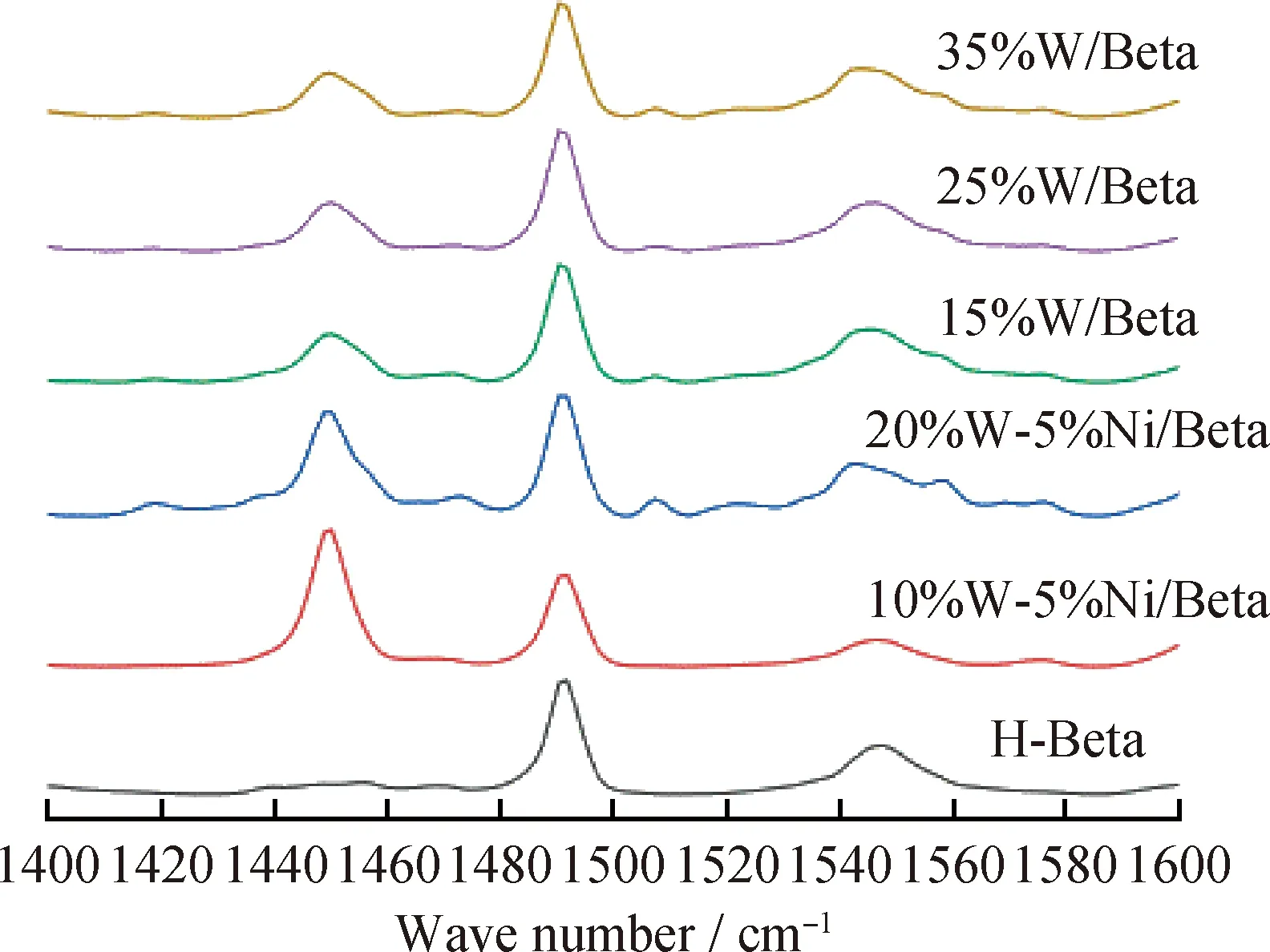
图5 不同W、Ni金属氧化物负载量催化剂的Py-IR谱图Fig.5 Py-IR spectra of catalysts with differentloadings of W and Ni metal oxides
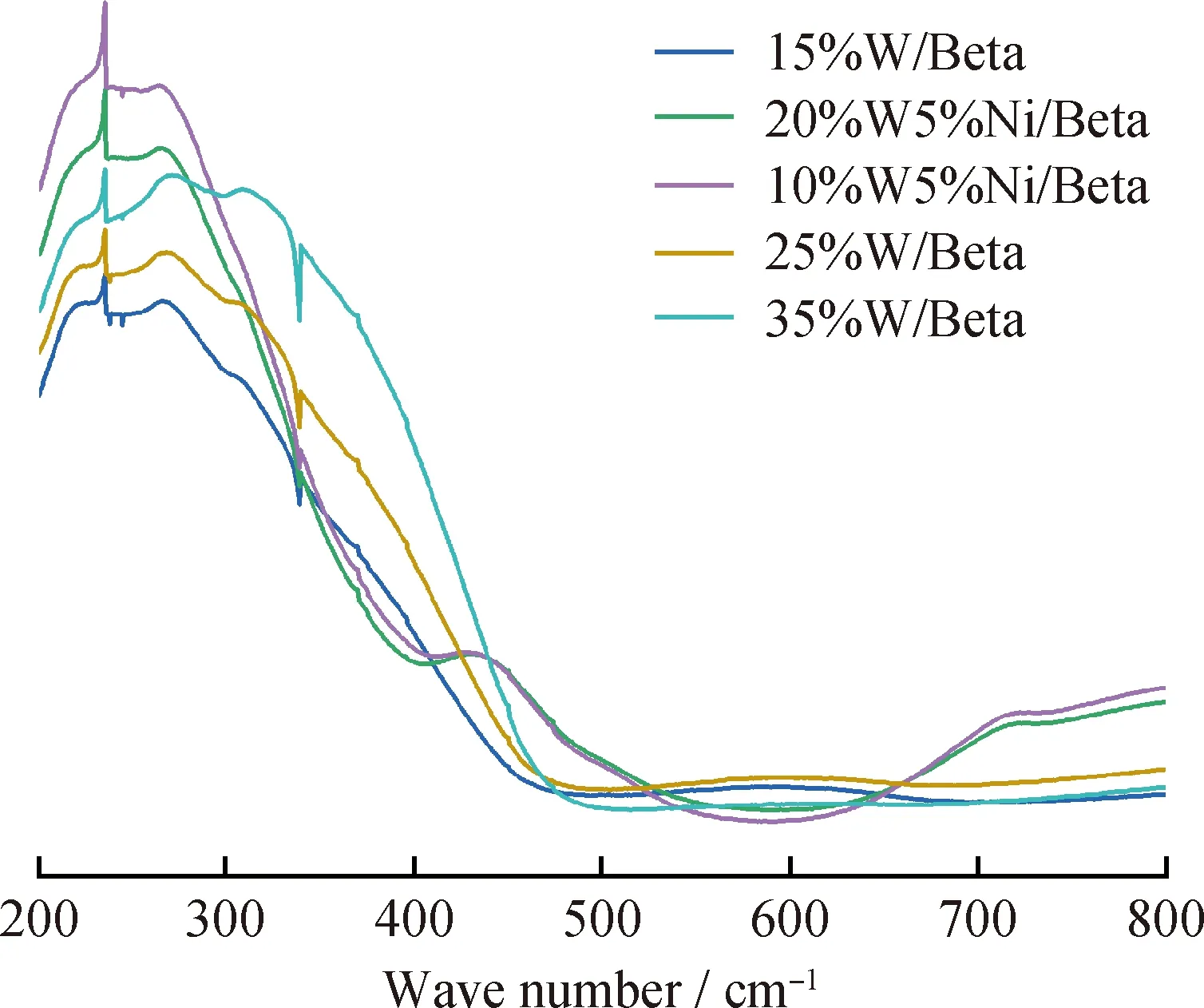
图6 不同W、Ni金属氧化物负载量催化剂的UV-Vis DRS谱图Fig.6 UV-Vis DRS spectra of the catalysts with differentloadings of W and Ni metal oxides
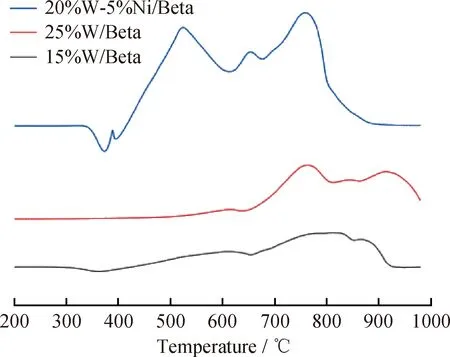
图7 不同W、Ni金属氧化物负载量催化剂的H2-TPR谱图Fig.7 H2-TPR profiles of the catalysts with differentloadings of W and Ni metal oxides
2.2 反应温度对1-甲基萘加氢裂化制备BTX反应性能的影响
为了考察反应温度对1-甲基萘加氢裂化制备BTX催化性能的影响,以10%W-5%Ni/Beta作为催化剂,分别在420、460和500 ℃下进行反应。通过测试反应后催化剂积炭含量发现:10%W-5%Ni/Beta催化剂的积炭含量在反应初始阶段(0~10 h)快速增加,随后增速明显下降,后趋于稳定[14]。故反应稳定10 h后再进行数据采集。不同温度下10%W-5%Ni/Beta催化剂的积炭含量如表5所示。由表5可以看出,反应结束时与开始取样时积炭量的差值很小(<0.6%),故可认为采集数据阶段反应稳定。同时随着反应温度的升高,催化剂的积炭含量增加。
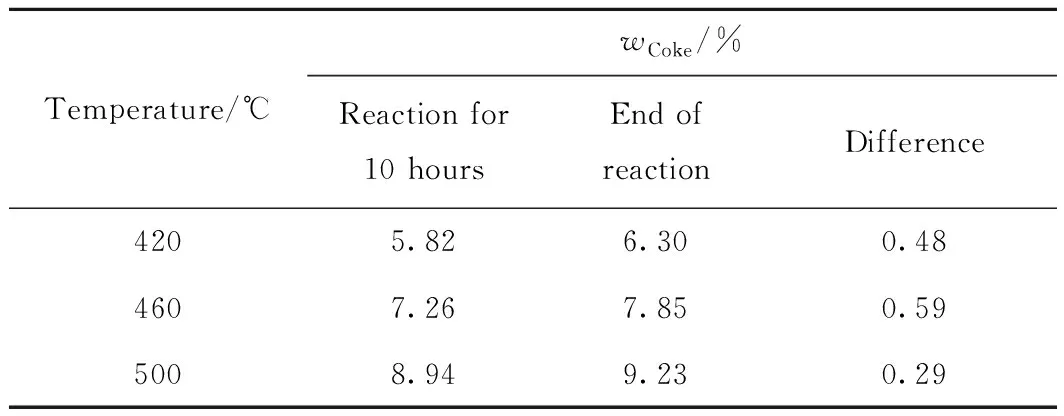
表5 不同反应温度下10%W-5%Ni/Beta催化剂的积炭质量分数Table 5 Coke mass fraction of 10%W-5%Ni/Beta catalystat different reaction temperatures
在催化剂稳定时期对其活性进行测试评价,实验结果如图8所示。由图8(a)可以看出:3个温度下1-甲基萘转化率的变化趋势相近。以460 ℃为例,在低质量空速(1.0~3.0 h-1)下1-甲基萘转化率接近100%;在高质量空速(>3.0 h-1)下,随着质量空速的增加,1-甲基萘转化率下降。反应温度越高,相同质量空速下的1-甲基萘转化率越高。而从图8(b)可以得到:由于BTX是加氢裂化过程中的中间产物,因此相同反应温度下,随着质量空速的增加,BTX收率呈现先增加后减小的趋势。随着反应温度的提高(从420 ℃到500 ℃),BTX的最大收率呈现明显增加的趋势(从61.03%到79.08%)。
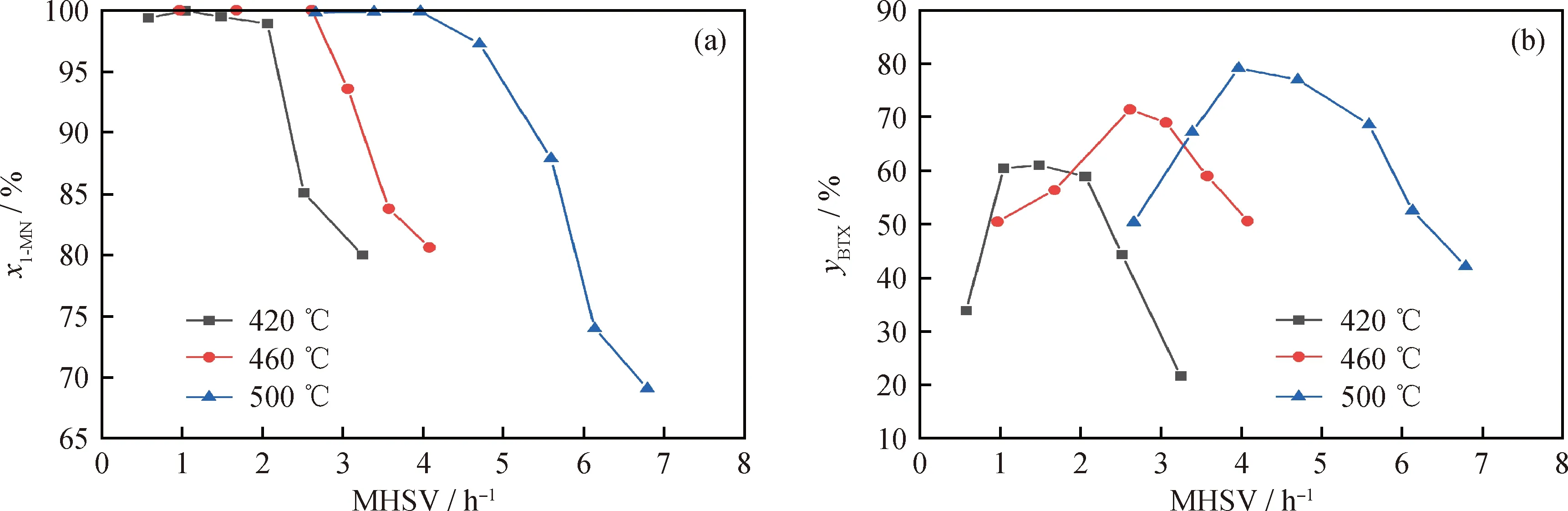
图8 不同反应温度下1-甲基萘的转化率(x1-MN)和BTX收率(yBTX)随质量空速(MHSV)的变化Fig.8 1-MN conversion (x1-MN) and BTX yield (yBTX) vs MHSV of 1-methylnaphthalenehydrocracking at different reaction temperatures(a) x1-MN; (b) yBTXReaction conditions: m(10%W-5%Ni/Beta)=1.5 g; reaction pressure 6 MPa; hydrogen/oil volume ratio 1300
1-甲基萘加氢裂化反应中BTX选择性随液相收率的变化如图9所示。可以看出,相同反应温度下,随着液相收率的增加,BTX选择性出现先升高再降低的趋势。低液体收率时,催化剂加氢裂化过度,原料过度裂解为低碳烷烃;而过高液体收率时质量空速高,中间产物反应不充分,导致BTX选择性降低。同时,随着反应温度的提高,相同液相收率下的BTX选择性提高。反应温度提高会抑制单环芳烃的进一步深度裂化,从而增加了液相产物中BTX含量,进而提高BTX选择性。
此结果可从热力学角度进行分析。使用热力学计算软件HSC 6.0对加氢裂化过程中的几个典型加氢反应的热力学常数Kp进行计算,结果见表6。可以看出,反应温度从420 ℃提高到500 ℃,萘第一个芳环加氢转化为四氢萘时,热力学平衡常数从1.67×10-3降低到1.54×10-4,降低了90.78%;
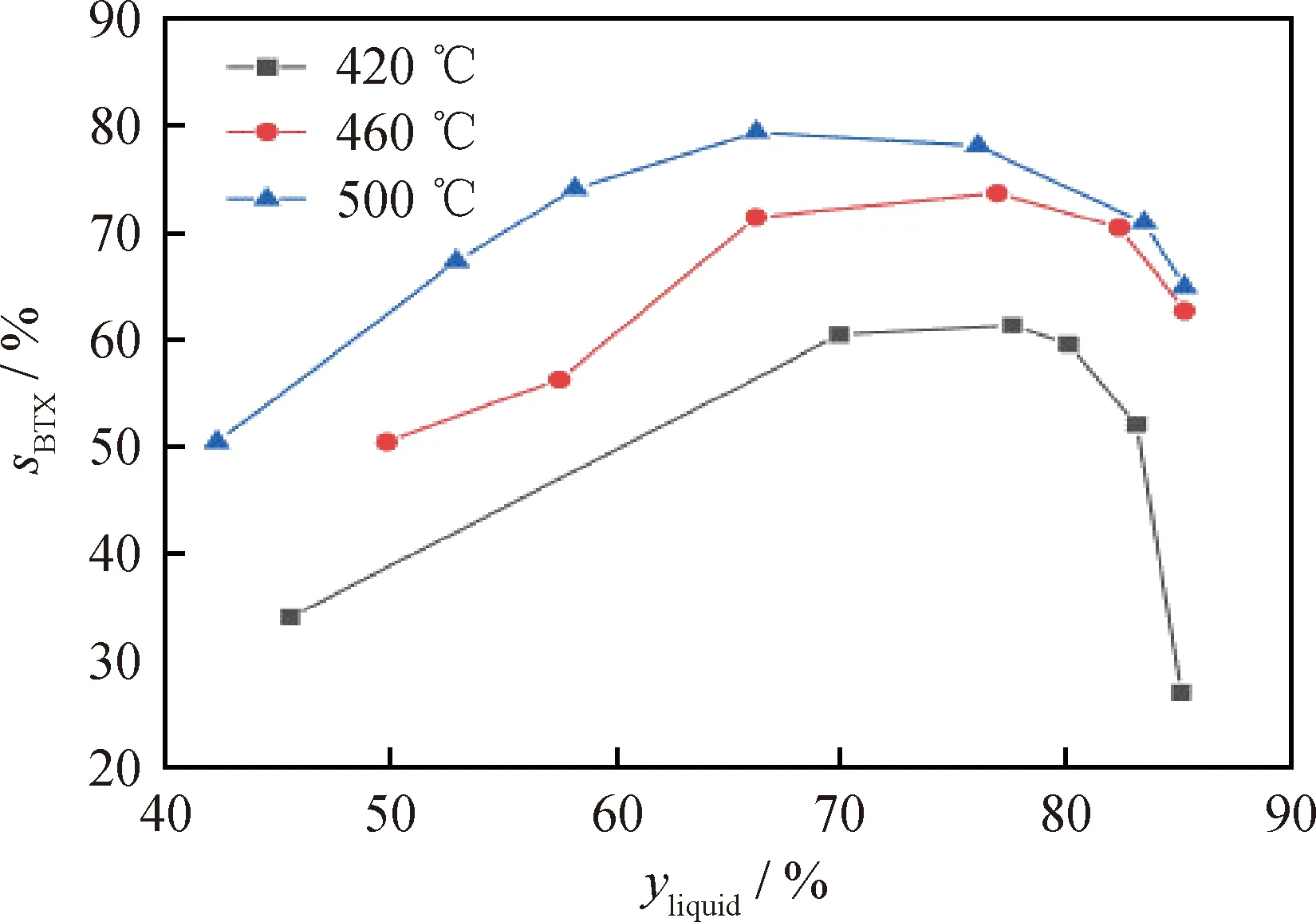
图9 不同反应温度下1-甲基萘加氢裂化反应中BTX选择性(sBTX)随液相收率(yliquid)的变化Fig.9 BTX selectivity (sBTX) vs liquid yield (yliquid) of1-methylnaphthalene hydrocracking atdifferent reaction temperaturesReaction conditions: m(10%W-5%Ni/Beta)=1.5 g;reaction pressure 6 MPa; hydrogen/oil volume ratio 1300

表6 加氢裂化过程中几种典型的加氢反应的热力学平衡常数(Kp)Table 6 Thermodynamic equilibrium constants (Kp) of several typical hydrogenation reactions during hydrocracking
而四氢萘加氢转化为十氢萘以及苯加氢转化为环己烷时,热力学平衡常数分别降低了98.32%和98.11%。相对于双环芳烃,反应温度提高对单环芳烃加氢反应的抑制作用更大。因此,提高反应温度可以更大程度地抑制BTX的深度加氢,从而进一步提高BTX的选择性。
2.3 催化剂上W、Ni金属氧化物负载量对1-甲基萘加氢裂化制备BTX反应性能的影响
以1-甲基萘为原料,在500 ℃条件下对制备的5种催化剂样品进行加氢裂化反应催化性能评价,反应结束后催化剂的积炭含量如表7所示。可以看出,不同W、Ni金属氧化物负载量催化剂的积炭质量分数均在10%左右,说明在实验数据采集过程中反应处于稳定阶段。
在稳定阶段对反应活性进行测试评价,图10为不同W、Ni金属氧化物负载量催化剂在高温下催化 1-甲基萘加氢裂化制备BTX反应的转化率和收率随质量空速的变化。从图10(a)可以得到,不同W、Ni金属氧化物负载量的催化剂有着不同的催化活性。

表7 1-甲基萘加氢裂化反应结束后不同W、Ni金属氧化物负载量催化剂的积炭量Table 7 Coke content of catalysts with differentloadings of W and Ni metal oxides after1-methylnaphthalene hydrocracking
这与各自金属组分的加氢能力、金属组分和分子筛酸性中心的相互作用有关。酸性中心和加氢中心之间存在一个最优相互匹配度,该匹配度下催化剂拥有最佳选择性。由图10(b)可见:25%W/Beta催化剂催化反应具有最高的BTX收率;在质量空速为3.34 h-1时,BTX的摩尔收率达到84.62%。不同W、Ni金属氧化物负载量催化剂在其催化反应最高BTX收率时的产物质量分布见表8。

图10 1-甲基萘的转化率(x1-MN)和BTX收率(yBTX)随质量空速(MHSV)的变化Fig.10 1-Methylnaphthalene conversion (x1-MN) and BTX yield (yBTX) vs MHSV(a) x1-MN; (b) yBTXReaction conditions: mcatalyst=1.5 g; reaction pressure 6 MPa; hydrogen/oil volume ratio 1300; reaction temperature 500 ℃

表8 不同催化剂最大BTX收率下加氢裂化反应的产物分布Table 8 Product distribution of hydrocracking reaction using different catalysts at maximum BTX yield
3 结 论
(1)采用等体积浸渍法制备了不同金属组分的Beta分子筛加氢裂化催化剂,表征结果表明:相比于单金属W的氧化物,W、Ni双金属氧化物在分子筛上的分散度更高,但预硫化后单金属W的硫化物会发生再分散。负载W、Ni金属氧化物后,催化剂的L酸大幅增加;随着W、Ni金属氧化物负载量的增加,催化剂总酸量减少,而L/B酸量比呈现增加的趋势。从H2-TPR谱图中得到:Ni的加氢活性极强,以Ni做助剂时,催化剂的加氢能力大幅度提高。
(2)高温有助于提高1-甲基萘加氢裂化生成BTX的选择性。在反应压力6 MPa,氢/油体积比为1300的反应条件下,使用10%W-5%Ni/Beta作为催化剂,随着反应温度的提高,BTX的摩尔收率从420 ℃的61.03%提高到了500 ℃的79.08%。
(3)对不同W、Ni金属氧化物配比和负载量的W-Ni/Beta催化剂进行1-甲基萘加氢裂化反应评价,结果表明:在反应压力6 MPa、反应温度为500 ℃、氢/油体积比为1300的反应条件下,25%W/Beta催化剂的加氢活性中心和裂化活性中心具有最好的匹配度,BTX摩尔收率高达84.62%。

