环境因素对人类疾病调控作用机制研究
谢明仁, 卢建珍, 王贤贤, 谢刘阳, YU Xin, 俞发荣,*
环境因素对人类疾病调控作用机制研究
谢明仁1, 卢建珍1, 王贤贤1, 谢刘阳1, YU Xin2, 俞发荣1,*
1. 甘肃政法大学 公安技术学院, 兰州 730070 2. Baylor College of Medicine, Houston, Texas, 77030, US
为了探索环境因素对人类疾病调控作用机制, 研究植物提取物二十碳烯酸对人食管癌细胞(EC56细胞)PI3K-Akt信号通路调控基因表达水平的影响, 分别给予EC56细胞 0.2,0.8,1.6 mg·L-1二十碳烯酸和5-FU培养48 h。用流式细胞仪检测EC56细胞凋亡率; 用酶联免疫吸附法(ELISA法)检测EC56细胞中脑源性神经营养因子(BDNF)、酪氨酸激酶受体B(TrkB)、粘着斑激酶(FAK)、蛋白激酶(Akt)表达水平。结果发现, 给予EC56细胞二十碳烯酸和5-FU培养48 h, 细胞凋亡率为15.46%, 21.52%, 23.13%和18.34, 与对照组比较, 细胞凋亡率有显著性差异(<0.01); BDNF、TrkB水平比对照组分别降低了22.76%, 43.90%, 56.91%, 40.65%和22.59%, 43.49%, 67.76%, 49.28%(<0.01); FAK和Akt水平比对照组分别降低了14.34%, 36.49%, 50.7%, 49.7% 和15.11%, 24.99%, 32.71%, 20.84%。结果提示, 植物提取物二十碳烯酸对EC56细胞增殖具有明显的抑制作用,其作用机制与PI3K-Akt信号转道通路中调控基因TrkB、BDNF、FAK和Akt表达水平下调和抑制EC56细胞分裂周期有关。实验结果为充分利用自然环境资源, 协调生态环境平衡, 提高人类身心健康研究提供了参考依据。
二十碳烯酸; 人食管癌细胞; 细胞分裂周期; 凋亡; PI3K-Akt信号通路
0 前言
人类生活在自然生态环境中, 人类的健康无时无刻不受自然环境因素的影响。当人类的活动影响或使生态环境平衡遭到破坏, 就直接或间接威胁人类健康, 诱发疾病生成。脑源性神经营养因子(BDNF)及其受体酪氨酸激酶受体B(TrkB) 在多种人体肿瘤中均有异常表达[1],在肿瘤发生、发展[2]和转移[3]过程中具有重要功能。TrkB介导的信号转导与肿瘤的发生发展密切相关,因此,阻断或者抑制TrkB活性, 可破坏肿瘤细胞的信号传递,从而达到抗肿瘤的目的[4]。以磷脂酰肌醇3-激酶(PI3K)和其下游分子蛋白激酶(Akt)所组成的信号转导通路关键分子为靶点的肿瘤治疗研究发现, PI3K-Akt信号通路与人类肿瘤的发生发展密切相关。该通路调节肿瘤细胞的增殖和存活,其活性异常不仅能导致细胞恶性转化,在组织血管生成和细胞生长,增殖,新陈代谢, 迁移, 分化和凋亡过程中起着至关重要的作用[5]。PI3K-Akt信号转导通路受BDNF、TrkB、局部粘着斑激酶(focal adhesion kinase, FAK)基因的调控。当BDNF、TrkB、FAK表达上调时, PI3K-Akt被激活[6], 促进细胞增殖[7]、迁移[8], 抑制细胞凋亡[9]。根据BDNF, TrkB, FAK在PI3K-Akt信号转导通路中调节特点, 在前期研究[10]的基础上, 将二十碳烯酸给予人食管癌细胞(EC56), 研究分析对PI3K- Akt信号转导通路中相关调控基因的作用, 为进一步研究环境因素对人类疾病调控作用及其机制积累资料。
1 材料与方法
1.1 药品与试剂
二十碳烯酸, 兰州大学化工学院天然植物研究所提供, 由中国科学院兰州化学物理研究所进行质量鉴定; 5-氟尿嘧啶( 5-FU), 批号20190306, 规格: 每支 5 mL, 南通精华制药有限公司生产; 二甲基亚砜(DMSO), 苏州联雄化工科技公司生产; 胎牛血清, 郑州九龙生物制品有限公司提供。脑源性神经营养因子(BDNF)试剂盒、酪氨酸激酶受体B(TrkB)试剂盒, 局部粘着斑激酶(FAK)试剂盒, 蛋白激酶(Akt)试剂盒, 购于北京索宝生物科技有限公司。
1.2 仪器
MULTISKAN MK3酶标仪, 上海雷勃分析仪器有限公司; 流式细胞仪, Coulter EPICS XL型, USA; ZHJH-C1112B型双人单面百级超净工作台, 上海智城分析仪器制造有限公司; 3552-2型全自动高温灭菌CO2培养箱, SHELDON MFG INC.; Olympus数码显微镜, 奥林巴斯(中国)投资有限公司; 100X-640X倒置显微镜, 北京佳源兴业科技有限公司; 96孔板, USA.
1.3 人食管癌细胞(EC56)
甘肃省医学科学研究院药理毒理实验中心惠赠。
2 实验方法
2.1 人食管癌细胞(EC56)培养
将EC56细胞加入含RPMI1640培养液、10%的胎牛血清、2 mmol·L-1谷氨酰胺、1×105U·L-1青霉素、1×105U·L-1链霉素的培养瓶中, 放入CO2培养箱中传代培养。
2.2 分组和给药
取EC56细胞(细胞密度为2×106个·L–1)接种于96孔培养板, 每孔90 µL。给药组分为低剂量组(L): 每孔加入0.2 mg·L–1二十碳烯酸 10 µL; 中剂量组(M): 每孔加入0.8 mg·L–1二十碳烯酸 10 µL; 高剂量组(H): 每孔加入1.6 mg·L–1二十碳烯酸 10 µL; 5-FU组: 每孔加5-FU(10 mg·L–1)10 µL; 对照组: 每孔加DMSO(30 µL·L–1)10 µL。各设4个重复孔。5%CO2, 37℃, 饱和湿度条件中培养48 h, 用酶标仪在450 nm波长下检测各组细胞吸光度(OD), ELISA法测BDNF、TrkB、FAK、Akt表达水平。
2.3 二十碳烯酸对EC56细胞分裂周期影响
取EC56细胞2 mL, 加入含RPMI1640液6 mL的培养瓶,给药组分别加入二十碳烯酸 0.2,0.8, 1.6·L-1和5-Fu各0.8 mL; 对照组加DMSO(30 µL·L-1)0.8 mL, 培养48 h, 离心收集细胞, 用流式细胞仪检测分裂期细胞数和细胞凋亡率。
2.4 直线回归方程制作
取BDNF, TrkB, FAK, Akt试剂盒中标准品50 uL分别加入酶标板, 用酶标仪在450 nm波长下测定吸光度(OD值), 以标准品的浓度为横坐标, 对应的吸光度(OD值)为纵坐标计算出标准曲线的直线回归方程。
2.5 统计学处理
实验数据采用SPSS 20.0软件进行统计学处理。计数资料用百分率(%)表示, 组间比较用单因素方差分析, 以<0.05为差异有统计学意义。
3 结果
3.1 二十碳烯酸对EC56细胞分裂周期的影响
L、M、H浓度二十碳烯酸组和5-FU组EC56细胞用流式细胞仪测得凋亡率分别为15.46%, 21.52%, 23.13%和18.34%, 二十碳烯酸组和5-FU组细胞的凋亡率比对照组显著升高(<0.01); H组比5-FU组细胞凋亡率显著升高(<0.01), 见表1。
Tabel 1 The effect of eicosenoic acidon EC56 cells division cycle
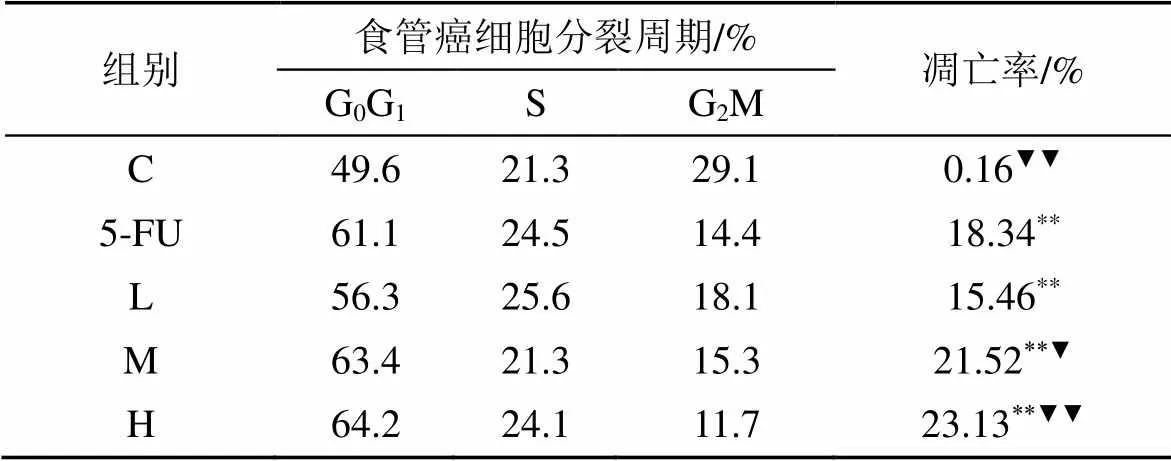
表1 二十碳烯酸对EC56细胞分裂周期的影响
与对照组比:**<0.01; 与5-FU组比:▼<0.05,▼▼<0.01。
3.2 二十碳烯酸对EC56细胞BDNF表达水平的影响
BDNF标准曲线的直线回归方程为:=1.1× 10-3+1.15×10-2,2=0.9997。L、M、H组和5-FU组的BDNF水平分别为215.91±1.33, 156.82±1.24, 120.45±1.04和165.91±2.03, 比对照组BDNF水平(279.55±2.07)分别降低了22.76%, 43.90%, 56.91%和40.65% (<0.01)。见图1。
3.3 二十碳烯酸对EC56细胞TrkB表达水平的影响
TrkB标准曲线的直线回归方程为:=1.1× 10-3+1.33×10-2,2=0.9998。L、M、H组和5-FU组的TrkB水平分别为171.36±2.12, 125.91±1.97, 71.36±1.53和112.27±2.81, 比对照组TrkB水平(221.36±1.65)分别降低了22.59%, 43.49%, 67.76%和49.28%(<0.01)。见图2。
3.4 二十碳烯酸对EC56细胞FAK表达水平的影响
FAK标准曲线的直线回归方程为:=1.5× 10-2+1.1×10-2,2=0.9994。L、M、H组和5-FU的FAK水平分别为72.06±0.41, 53.42±0.19, 41.47±0.18和42.31±0.33, 比对照组FAK水平(84.12±0.22)分别降低了14.34%, 36.49%, 50.70%和49.70%。见图3。
3.5 二十碳烯酸对EC56细胞Akt表达水平的影响
Akt标准曲线的直线回归方程为:=1.19×10-2+ 2.32×10-2,2=0.9996。L、M、H组和5-FU组的Akt水平分别为52.14±0.32, 46.07±0.45, 41.33± 0.53和48.62±0.22, 比对照组Akt水平(61.42±0.36)分别降低了15.11%, 24.99%, 32.71%和20.84%。见图4。

图1 二十碳烯酸对EC56细胞BDNF表达水平的影响(与C比: **P<0.01)
Figure 1 Effect ofeicosenoic acid on BDNF expression level in EC56 cells(**<0.01C group)

图2 二十碳烯酸对EC56细胞TrkB表达水平的影响(与C比: **P<0.01)
Figure 2 Effect ofeicosenoic acid on TrkB expression level in EC56 cells(**<0.01C group)
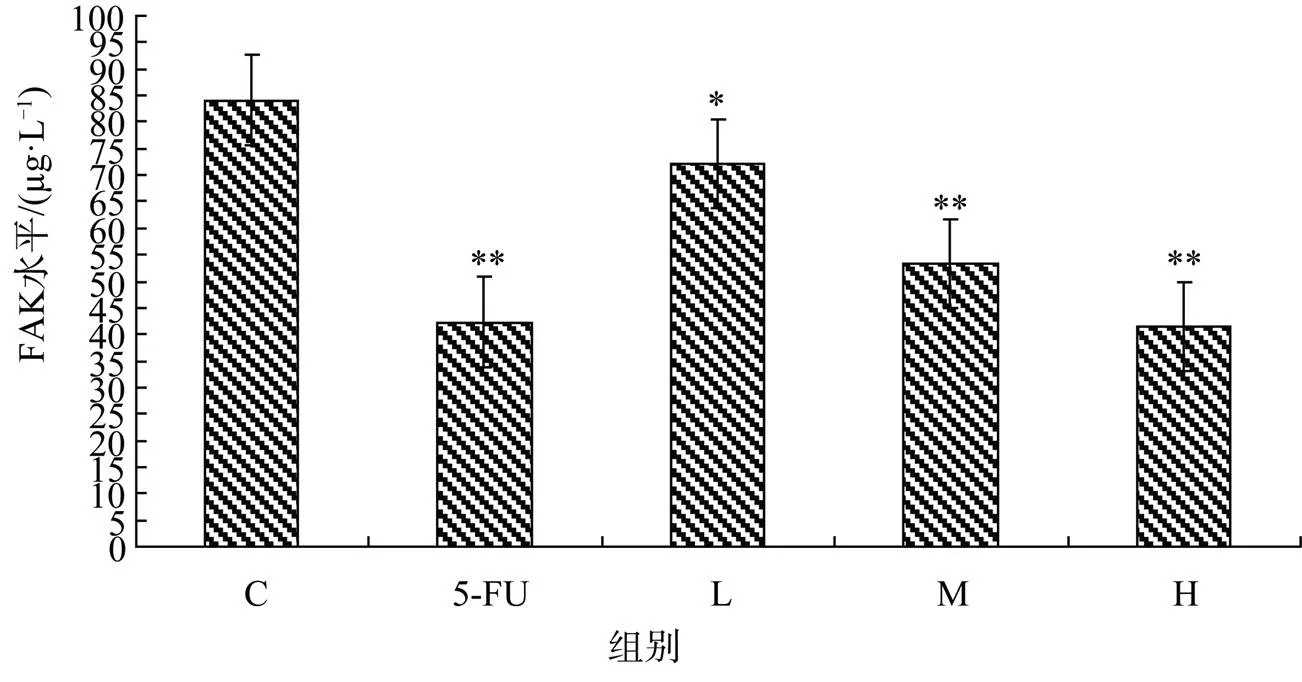
图3 二十碳烯酸对EC56细胞FAK表达水平的影响(与C比: *P<0.05, **P<0.01)
Figure 3 Effect ofeicosenoic acid on FAK expression in EC56 cells(*<0.05,**<0.01C group)
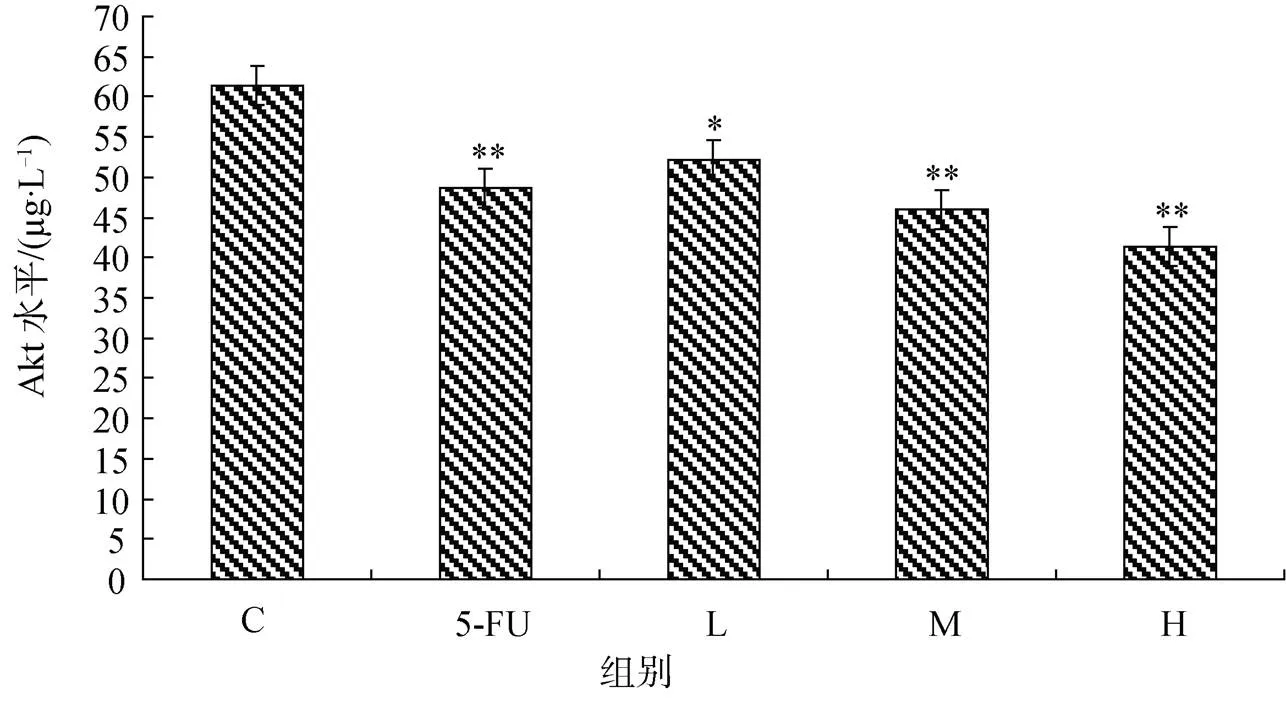
图4 二十碳烯酸对EC56细胞Akt表达水平的影响(与对照组比: *P<0.05, **P<0.01)
Figure 4 Effect of eicosenoic acid on Akt expression in EC56 cells(*<0.05,**<0.01C group)
4 讨论
研究报道, 酪氨酸激酶受体介导的信号转导与肿瘤的发生发展密切相关, 酪氨酸激酶受体可促进多种肿瘤[11]的生长、侵袭、转移。因此, 抑制酪氨酸激酶受体活性, 可阻断肿瘤细胞的信号传递, 抑制肿瘤形成, 从而达到抗肿瘤的目的[4]。提示酪氨酸激酶受体可能成为抗肿瘤治疗的潜在靶点,酪氨酸激酶受体抑制剂的应用可能成为抗肿瘤治疗的新策略[12]。李坤等[13]研究发现, 给予神经母细胞瘤(NB)细胞全反式维甲酸(ATRA)和脑源性神经营养因子(BDNF), 诱导酪氨酸激酶受体B(TrkB)高表达, TrkB进一步激活其下游PI3K /Akt通路, 促进NB细胞合成、分泌血管内皮生长因子(VEGF); 若给予酪氨酸蛋白激酶抑制剂(K252a)阻断TrkB-BDNF信号通路或给予PI3K 抑制剂(LY294002)阻断TrkB-BDNF信号下游通路PI3K/Akt均可有效抑制NB细胞合成分泌VEGF[14]。粘着斑激酶(FAK) 是细胞内一种非受体酪氨酸激酶, 在多种肿瘤细胞中均出现异常表达量[15], 在细胞存活[16]、粘附、迁移多种细胞信号通路中起着关键作用[17]。当FAK被激活时, 肿瘤细胞增殖、侵袭活性增加, 抑制细胞凋亡[9]。给予FAK抑制剂, 发现FAK表达或活性阻断使细胞增殖受到显著抑制, 这种抑制主要体现在G2/M期细胞比率的增加及S期细胞比率的下降[18]。上述研究成果表明, TrkB、BDNF、FAK水平调节控制着PI3K/Akt信号转道通路的活性。罗红[19]将二十碳五烯酸单独或联合视黄酸给予HL-60细胞, 细胞增殖抑制率为 24.38%或42.75 %, 可见二十碳五烯酸可抑制 HL- 60细胞增殖和诱导其分化, 与视黄酸联合应用效果更为明显, 这种联合效应可能与二十碳五烯酸减缓 HL-60细胞内视黄酸的代谢相关。沈桂芬[20]将由细胞色素P450表氧化酶从花生四烯酸合成环氧化二十碳三烯甘油酸给予人舌癌细胞(Tca-8113)培养72 h, S期和G2/M期细胞比对照组明显增多, Akt磷酸化水平显著增加, 表明PI3K/Akt细胞转导通路在细胞增殖过程中起重要作用。在前期实验中, 将十二碳稀酸[21], 十八碳稀酸[22], 不饱和脂肪酸(含二十碳稀酸)[23]分别给予不同肿瘤细胞, 结果发现均有抑制细胞增殖、促进细胞凋亡的作用, 但对其作用机制讨论较少。本文实验结果发现, 给予EC56细胞二十碳烯酸处理后, TrkB、BDNF、FAK和Akt表达水平明显下调, 细胞凋亡率随给药剂量的增加而升高, 其中G0/G1细胞比例增加, G2/M细胞比例明显减少, 进入M期的细胞减少, 细胞分裂增殖被抑制。实验结果与上述文献报道结果一致。结果提示, 二十碳稀酸对人食管癌细胞增殖具有明显的抑制作用, 其作用机制与抑制PI3K-Akt信号转道通路中调控基因TrkB、BDNF、FAK和Akt表达水平和抑制人食管癌细胞分裂周期有关。实验结果为充分利用自然环境资源, 协调生态环境平衡, 提高人类身心健康研究提供了参考依据。
[1] 窦维佳, 王景杰, 刘震雄. 胃癌中BDNF的表达特征及其临床意义[J]. 山西医科大学报, 2018, 49(4): 383–386.
[2] 刘志, 陶自坚. 受体酪氨酸激酶Eph基因与肿瘤微环境及相关治疗的研究进展[J]. 临床与实验病理学杂志, 2017, 33(11): 1241–1244.
[3] 吕博, 陈艳华. TrkB与肿瘤侵袭转移的研究进展[J]. 中国医药指南, 2015, 13(5): 47–48.
[4] 谢蒙蒙, 李莹文, 周吴, 等. 受体酪氨酸激酶ROS在肿瘤中作用的研究进展[J]. 肿瘤药学, 2016, 6(3): 166–172.
[5] POMAR S C, ARCARO A. The role of the PI3K/AKT/mTOR pathway in brain tumor metastasis[J]. Journal of Cancer Metastasis and Treatment, 2016, 2 (11): 80–89.
[6] SUN BG, MENG J, XIANG T, et al. Jianpijiedu fang improves survival of hepatocarcinoma mice by affecting phosphatase and tensin homolog, phosphoinositide 3-kinase, and focal adhesion kinase[J]. Journal of Tradiional Chinese Medicine, 2013, 33(4): 479–485.
[7] YU R, YU BX, CHEN JF, et al. Anti-tumor effects of Atractylenolide I on bladder cancer cells[J]. Journal of Experimental Clinical Cancer Research, 2016, 35(40): 1–10.
[8] 李博, 邓睿, 李栋, 等. 结肠癌组织中SphK1和FAK表达量与临床病理特征、上皮间质转化的相关性研究[J]. 海南医学院学报, 2018, 24(2): 202–205, 209.
[9] 李吉友, 贾栋. 抑制FAK的表达对人胃癌细胞SGC–7901凋亡的影响[J]. 现代肿瘤医学, 2017, 25(1): 34–37.
[10] 俞发荣, 连秀珍, 谢明仁, 等. 2-十二烯酸对人肝癌细胞毒性作用研究[J]. 中国临床药理学杂志, 2014, 30(12): 1108– 1110, 1123.
[11] 张义朋, 黄华艳, 仰昳婕, 等. 受体酪氨酸激酶AXL在肿瘤耐药中的作用研究进展[J]. 上海交通大学学报(医学版) , 2018, 38(7): 819–824.
[12] 唐小崧, 陈公琰. 受体酪氨酸激酶AXL在肿瘤中的研究进展[J]. 实用肿瘤学杂志, 2017, 31(3): 281–284.
[13] 李坤霞, 李爱敏, 张继红. TrkB-BDNF信号通路对神经母细胞瘤细胞分泌血管内皮生长因子的影响[J]. 中国当代儿科杂志, 2011, 13(3): 240–243.
[14] 刘建英. TrkB-BDNF的三条下游信号传导通路对神经母细胞瘤细胞耐药的影响[J]. 泰山医学院学报, 2013, 34(3): 179–182.
[15] LIN H M, BRIAN Y L, CASTILLO L, et al. Effect of FAK inhibitor VS–6063 (defactinib) on docetaxel efficacy in prostate cancer[J]. The Prostate, 2018, 78(4): 308–317.
[16] 杨超, 陈颖, 田巍, 等. 黏着斑激酶及其小分子抑制剂作为抗肿瘤药物的研究进展药学进展[J]. 2014, 38 (9): 649–655.
[17] 陈瑛, 王丹丹, 朱虹, 等. 抗肿瘤新靶点黏着斑激酶FAK及其抑制剂研究进展[J]. 中国现代应用药学, 2016, 33 (2): 255–260.
[18] THIYAGARAJAN V, TSAI M J, WENG C F. Antroquinonol targets FAK-Signaling pathway suppressed cell migration, iInvasion, and tumor growth of C6 glioma[J]. Plos one, 2015, 10(10): 1–14.
[19] 罗红, 糜漫天, 张乾勇, 等. 二十碳五烯酸联合视黄酸对HL-60细胞增殖与分化功能的影响[J]. 免疫学杂志, 2001, 17(5): 331– 333, 343.
[20] 沈桂芬, 蒋建刚, 付向宁, 等. 环氧化二十碳三烯甘油酸对肿瘤细胞增殖的影响[J]. 癌症, 2008, 27(11): 1130– 1136.
[21] 俞发荣, 连秀珍, 谢明仁, 等. 十二碳烯酸对人H4细胞毒性作用研究[J]. 中国现代应用药学, 2014, 31(2): 134– 136.
[22] 俞发荣, 杨博, 连秀珍, 等. 十八碳烯酸对人MGC-803细胞毒性作用机制研究[J]. 中国药理学通报, 2017, 33(6): 887–888.
[23] 俞发荣, 李建军, YU Xin, 等. 不饱和脂肪酸对人胃癌细胞PI3K-Akt 信号通路中相关基因表达的影响[J]. 生态科学, 2019, 38(6): 60–63.
The mechanism of environmental factors on the regulation of human diseases
XIE Mingren1,LU Jianzhen1,WANG Xianxian1, XIE Liuyang1, YU Xin2, YU Farong1,*
1. School of Public Security Technical, Gansu University of Political Science and Law, Lanzhou 730070, China 2. Baylor College of Medicine, Houston, Texas,77030, US
In order to explore the regulatory mechanism of environmental factors on human diseases, the effects of plant extract eicosaenoic acid on regulatory gene expression level of PI3K-Akt signaling pathway in human esophageal cancer cells (EC56 cells) were studied. EC56 cells were cultured with 0.2,0.8,1.6 mg·L-1eicosaenoic acid and 5-FU for 48 h. The apoptosis rate of EC56 cells was detected with flow cytometry; expression levels of brain-derived neurotrophic factor (BDNF), tyrosine kinase receptor B (TrkB), adhesion spot kinase (FAK) and protein kinase (Akt) in EC56 cells were determined by ELISA. The results showed that the apoptosis rate was 15.46%, 21.52%, 23.13% and 18.34; compared with the control group, the apoptosis rate was significantly different (<0.01). The levels of BDNF and TrkB decreased by 22.76%, 43.90%, 56.91%, 40.65% and 22.59%, 43.49%, 67.76%, 49.28%, respectively (<0.01). The levels of FAK and Akt decreased by 14.34%,36.49%,50.7%,49.7% and 15.11%, 24.99%, 32.71%, 20.84%, respectively. The results indicated that plant extracts eicosaenoic acid had a significant inhibitory effect on the proliferation of EC56 cells, and its mechanism was related to the down-regulation of the expression levels of the regulatory genes TrkB, BDNF, FAK and Akt in the PI3K-Akt signaling pathway and the inhibition of the EC56 cell division cycle. The experimental results provide a reference for the research of making full use of natural resources, coordinating the balance of ecological environment and improving the physical and mental health of human beings.
eicosenoic acid; human esophageal cancer cells; cell division cycle; apoptosis; PI3K-Akt signaling pathway
10.14108/j.cnki.1008-8873.2020.06.022
R915
A
1008-8873(2020)06-175-06
2020-04-05;
2020-04-24
甘肃省高校科技创新团队项目(2016C-09); 兰州市科技计划项目(2015-3-80; 2019-1-48); 甘肃政法大学省级特色学科建设项目; 甘肃政法大学重点项目(2016XZDLW04)
谢明仁(1977—), 男, 甘肃民勤人, 硕士, 副教授, 物证技术专业硕士生导师, 主要从事物证技术教学与研究, E-mail:xmr6700@gsli.edu.cn
俞发荣, 男, 博士, 研究员, 主要从事环境因素与人类健康的关系、药理毒理学研究, E-mail: tim9898@163.com
谢明仁, 卢建珍, 王贤贤, 等. 环境因素对人类疾病调控作用机制研究[J]. 生态科学, 2020, 39(6): 175–180.
XIE Mingren, LU Jianzhen, WANG Xianxian, et al. The mechanism of environmental factors on the regulation of human diseases[J]. Ecological Science, 2020, 39(6): 175–180.

