PI3K/Akt/mTOR信号通路相关蛋白在结直肠癌中的表达及与临床病理特征和预后的关系*
冯跃,张永涛,夏利锋,马永刚
(中国人民武装警察部队海警总队医院 外二科,浙江 嘉兴 314000)
结直肠癌是常见的恶性肿瘤之一,近年来我国结直肠癌发病率和病死率均呈明显的上升趋势,2015年我国结直肠癌估算新发和死亡病例数分别为37.6 万和19.1 万[1]。PI3K/Akt/mTOR 信号通路作为细胞生长、增殖和抗凋亡的重要调节通路,与癌症的发生、发展密切相关[2-3]。有研究显示,结直肠癌的恶化、转移与PI3K/Akt/mTOR 信号通路有关[4-5]。因此,本研究通过检测PI3K/Akt/mTOR 信号通路中人类第10 号染色体缺失的编码与PTEN、p-Akt、p-mTOR 在结直肠癌及癌旁正常组织中的表达,探究其相关蛋白对结直肠癌的影响及与临床病理特征和预后的关系。
1 资料与方法
1.1 一般资料
选取2016年1月—2017年12月中国人民武装警察部队海警总队医院52例外科手术切除或内镜完整切除的结直肠癌活检标本,并取相同患者的癌旁正常组织(距肿瘤切缘≥4 cm)作为对照,标本离体后用10%中性甲醛固定,常规石蜡包埋。患者男性30例,女性22例;年龄25 ~76 岁,平均(53.8±13.2)岁;无淋巴结转移38例,有淋巴结转移14例;浸润未达浆膜层32例,浸润达到浆膜层20例;低分化结直肠癌18例,中、高分化结直肠癌34例;根据美国癌症联合协会和国际抗癌联盟的结直肠癌分期标准[6],临床分期Ⅰ、Ⅱ期患者24例,Ⅲ、Ⅳ期患者28例。
1.2 主要试剂
鼠抗人PTEN、兔抗人p-Akt、兔抗人p-mTOR 单克隆抗体均购自德国默克公司,免疫组织化学SP 试剂盒、DAB 显色剂购自上海信裕生物科技有限公司。
1.3 免疫组织化学SP 法及结果判断
采用免疫组织化学SP 法检测PTEN、p-Akt、p-mTOR 在结直肠癌和癌旁正常组织中的表达。实验操作均严格按照说明书进行。细胞核出现棕黄色颗粒为p-mTOR 阳性,细胞核和细胞质中出现棕黄色颗粒为PTEN、p-Akt 阳性。随机选取10 个高倍镜视野,根据染色程度分为:无染色(-)、浅黄色(+)、棕黄色(++)、黄褐色(+++),分别代表0~3 分。根据视野内阳性细胞所占比例分为:≤10%(-)、>10%~25%(+)、>25%~50%(++)、>50%(+++),分别代表0~3 分。最终评分=染色强度评分×阳性细胞所占比例评分,最终评分≥3 分为阳性,≤2 分为阴性。
1.4 随访
随访时间截至2020年1月31日。通过电话、信函和查阅医院病案记录等方式随访。所有患者随访资料完整。
1.5 统计学方法
数据分析采用SPSS 21.0 统计软件。计数资料以率(%)表示,比较用χ2检验;Kaplan-Meier 法绘制生存曲线,多因素分析采用Logistic 回归模型,P<0.05 为差异有统计学意义。
2 结果
2.1 结直肠癌与癌旁正常组织中PTEN、p-Akt、p-mTOR 阳性率比较
结直肠癌与癌旁正常组织中PTEN、p-Akt、p-mTOR 阳性率比较,经χ2检验,差异有统计学意义(P<0.05),PTEN 阳性率低于癌旁正常组织,而p-Akt、p-mTOR 阳性率高于癌旁正常组织。见表1和图1。
2.2 结直肠癌患者PTEN、p-Akt、p-mTOR 表达与临床病理特征的关系
有淋巴结转移与无淋巴结转移患者的p-Akt 和p-mTOR 阳性率比较,经χ2检验,差异有统计学意义(P<0.05),有淋巴结转移患者较高。肿瘤浸润达到浆膜层与未达浆膜层患者的p-Akt 阳性率比较,差异有统计学意义(P<0.05),肿瘤浸润达到浆膜层患者较高。肿瘤低分化与高、中分化患者的p-Akt 阳性率比较,差异有统计学意义(P<0.05),低分化患者较高。临床分期Ⅲ期、Ⅳ期与Ⅰ期、Ⅱ期患者的p-Akt和p-mTOR 阳性率比较,差异有统计学意义(P<0.05),Ⅲ期、Ⅳ期患者较高。其余临床病理特征患者的PTEN、p-Akt、p-mTOR 阳性率比较,差异均无统计学意义(P>0.05)。见表2。

表1 结直肠癌与癌旁正常组织中PTEN、p-Akt、p-mTOR 阳性率比较 [n =52,例(%)]

图1 PTEN、p-Akt、p-mTOR 在结直肠癌和癌旁正常组织中的表达 (SP×100)

表2 不同临床病理特征结直肠癌患者的PTEN、p-Akt、p-mTOR 阳性率比较例(%)

续表2
2.3 p-Akt 表达与结直肠癌临床病理特征的多因素分析
以表2中差异有统计学意义的因素为自变量,p-Akt 是否阳性为因变量,进行一般多因素Logistic 回归分析(引入水准为0.05,剔除水准为0.10),结果显示:结直肠癌患者临床分期Ⅲ、Ⅳ期[=4.098(95% CI:2.337,7.134)]是p-Akt 阳性表达的影响因素(P<0.05),见表3。
2.4 PTEN、p-Akt、p-mTOR 表达与结直肠癌患者预后的关系
52例随访患者中,死亡30例。PTEN、p-Akt、p-mTOR 阳性与阴性患者的4年生存率比较,经χ2检验,差异有统计学意义(P<0.05),PTEN 阳性患者高于阴性患者,p-Akt、p-mTOR 阳性患者分别低于p-Akt、p-mTOR 阴性患者。见表4和图2~4。

表3 结直肠癌患者病理特征的多因素Logistic 回归分析参数

表4 PTEN、p-Akt、p-mTOR 阳性与阴性患者的4年生存率比较 %

图2 PTEN 阳性和阴性结直肠癌患者的生存曲线

图3 p-AkT 阳性和阴性结直肠癌患者的生存曲线
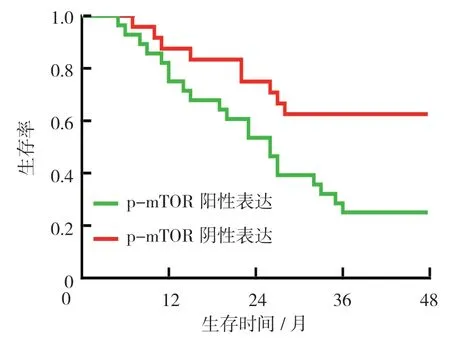
图4 p-mTOR 阳性和阴性结直肠癌患者的生存曲线
3 讨论
结直肠癌可以通过淋巴、血液循环及直接浸润等途径,播散到其他组织和脏器,因此治疗的关键在于早期发现、及时诊断和手术根治[7-8]。PI3K/Akt/mTOR 信号通路作为肿瘤领域的研究热点,在多种肿瘤中异常激活[9-11]。PI3K/Akt/mTOR 与结直肠癌细胞的增殖、侵袭、凋亡及细胞周期密切相关[12]。在结直肠癌进展过程中,c-FOS和PTEN可能是该通路的关键基因改变[13]。mTOR作为下游基因,活化后可以抑制癌细胞自噬。凋亡也是结直肠癌发生、发展的重要机制,PI3K/Akt 通路可以通过Caspase、Bcl、FOXO和mTOR基因抑制结直肠癌细胞的凋亡[14-15]。值得一提的是,PI3K/Akt/mTOR 通路还能通过调控血管形成而影响化疗药物的耐药性[16-17]。因此,探究PI3K/Akt/mTOR 信号转导蛋白在结直肠癌中的表达具有潜在价值。
PTEN抑癌基因具有双重特异性磷酸酶活性,能将三磷酸磷脂酰肌醇去磷酸化转化为磷脂酰肌醇二磷酸,是PI3K/Akt/mTOR 信号通路的负调节通路[18-19]。PTEN 在结直肠癌组织中的阳性率低于癌旁正常组织,说明PTEN 的低表达或不表达,导致结直肠细胞生长状态失控,进而使肿瘤发展成癌症的可能性增加。从临床病理特征上看,PTEN 在结直肠癌组织中的表达与患者年龄、性别、有无淋巴结转移、浸润程度、肿瘤分化程度、临床分期均无关。预后分析中,PTEN阳性患者4年生存率高于阴性患者,说明PTEN 与结直肠癌患者预后相关。
Akt 在多种细胞生长过程中发挥关键作用,如葡萄糖代谢、凋亡、细胞增殖、转录和细胞迁移,Thr308 和Ser743 位点可以被磷酸化,从而激活其底物mTOR[20]。在本研究中,p-Akt 在结直肠癌组织中的阳性率高于癌旁正常组织,说明Akt 的活化与结直肠癌发展相关。从临床病理特征上来看,Akt 的表达与有无淋巴结转移、浸润程度、肿瘤分化程度、临床分期有关,且与贺雅静[21]的研究中p-Akt 在其他消化道癌症中的作用吻合,进一步验证了p-Akt 在肿瘤发生、发展中的作用。Logistic 回归分析显示p-Akt 与结直肠癌患者的临床分期有独立影响关系,p-Akt 可以作为临床上判断结直肠癌恶性程度的重要指标之一,也是治疗结直肠癌的潜在靶点。同时,p-Akt 阳性患者4年生存率低于阴性患者,说明p-Akt 表达可能会加重结直肠癌患者预后不良。
哺乳动物雷帕霉素靶蛋白mTOR 活化后介导PI3K/Akt/mTOR 信号通路下游分子,影响细胞的生长、凋亡及代谢[22-23]。本研究中p-mTOR 在结直肠癌组织的阳性表达率高于癌旁正常组织,说明mTOR 磷酸化与结直肠细胞癌变有关。同时,p-mTOR 在结直肠组织中的阳性表达与有无淋巴结转移、临床分期有关,说明mTOR 功能失调与结直肠癌的发生、发展密切相关;p-mTOR 阳性患者4年生存率低于阴性患者,说明p-mTOR 表达可能导致结直肠癌患者预后恶化。
抑制PI3K/Akt/mTOR 通路对结直肠癌的治疗有重要意义[24-25]。目前已进入临床研究的药物,如PI3K 抑制药LY294002,PI3K 和mTOR 双重抑制药NVP-BEZ235,mTOR 抑制剂依维莫司和替西罗莫司等均显示出一定疗效。并且针对不同PI3K 亚型的特异性化合物也正在被开发,如p110β 特异性抑制药IC87114,p110γ 特异性抑制药AS-24252[16]。总之针对PI3K/Akt/mTOR 通路开发潜在靶向药势必会使结直肠癌患者受益。
综上所述,PI3K/Akt/mTOR 信号通路与结直肠癌密切相关,PTEN、p-Akt、p-mTOR 的表达都会影响到结直肠癌的发展,同时p-Akt、p-mTOR 与结直肠癌患者的一些临床病理特征有关,可以作为临床参考指标,并且PTEN、p-Akt、p-mTOR 与结直肠癌患者预后生存率有关,可以用于推测患者的预后。尽管PI3K/Akt/mTOR 信号通路中仍有许多相关蛋白和基因没有进行探究,影响机制尚不明确,但是本研究中的PI3K/Akt/mTOR 信号通路为临床提供了新的参考指标,PI3K/Akt/mTOR 信号通路中的p-Akt、p-mTOR蛋白有潜力作为结直肠癌的新治疗靶点。

