MicroRNA-212-3p与靶基因转化生长因子-β2基因3'UTR的关系研究*
马文静,徐浩铨,白冰心,吴梦婷,张亚楼
(1.新疆医科大学 中心实验室,新疆 乌鲁木齐 830011;2.新疆医科大学第五临床医学院,新疆 乌鲁木齐 830011;3.新疆医科大学基础医学院组织胚胎学教研室,新疆 乌鲁木齐 830011)
MicroRNA(miRNA)是一种小的非编码内源性RNA 分子(19 ~25 nt),通过靶向mRNA 来控制转录后基因的表达水平[1-2]。据推测>60%的人类基因编码蛋白质在非编码的3'UTR 中具有miRNA 结合位点区域,miRNA 通过与靶基因的3'UTR 部分序列互补结合后,抑制该基因的转录和蛋白翻译,从而实现对靶基因的调控[3]。
miRNA 在调节成骨细胞的增殖、分化及凋亡过程中发挥了重要作用。在成骨细胞凋亡的发生、发展的过程中,涉及转化生长因子β(transforming growth factor-β, TGF-β)、骨形态发生蛋白(bone morphogenetic protein, BMP)、Wnt 等多种转录途径,且上述转录途径受miRNA 严格调控。TGF-β2是TGF-β 超家族的成员之一,前期研究发现用氟化钠处理Saos-2 细胞48 h 后miR-212-3p 的表达上调[4],并且通过生物信息学软件Targetscan(http://www.targetscan.org/mamm_31/)预测发现TGF-β2基因是miR-212-3p 的潜在靶基因,且其3'UTR 与miR-212-3p 存在互补结合位点。但是目前尚未有TGF-β2与miR-212-3p 靶向关系的研究。因此本研究采用PCR扩增TGF-β23'UTR,并将其克隆至荧光素酶报告载体(pYr-MirTarget)上,构建TGF-β23'UTR 双荧光素酶报告重组载体,通过转染Saos-2 细胞,采用双荧光素酶报告系统、qRT-PCR 以及Western blotting 验证miR-212-3p 与TGF-β2的靶向关系,为进一步研究成骨细胞凋亡过程中miR-212-3p 调控作用的分子机制奠定基础。
1 材料与方法
1.1 研究材料
人成骨肉瘤细胞株Saos-2 由中国科学院上海细胞库提供,人TGF-β2克隆质粒由日本TaKaRa 公司提供。
1.1.1 主要试剂和仪器胎牛血清(FBS)、细胞培养基(DMEM)和转染试剂(Lipofectamine 2000)均购自美国Thermo Fisher 公司,miR-212-3p 核苷类(mimics)、阴性对照无核苷类(NC mimics)和抑制剂(inhibitor)成品购自德国Qiagen 公司,双荧光素酶检测试剂盒和蛋白酶抑制剂(PMSF)购自上海碧云天生物技术有限公司,pYr-MirTarget 购自长沙赢润生物技术有限公司,蛋白裂解液(RIPA)购自杭州弗德生物科技有限公司,TGF-β2(货号:8406LF)和GAPDH(货号:14C10)单克隆抗体均购自美国Cell Signaling Technology 公司,薄型琼脂糖凝胶DNA回收试剂盒和质粒提取试剂盒购自北京康为世纪生物科技有限公司,BCA 蛋白定量试剂盒购自北京博奥森生物技术有限公司,T4 DNA 连接酶(Ligase)、NotⅠ、XhoⅠ、TaKaRa TaqTM及RNA 提取试剂盒、逆转录试剂盒和SYBR 荧光定量PCR 试剂盒购自日本TaKaRa 公司。细胞培养箱和Nanodrop-2000 核酸定量仪购自美国Thermo Fisher 公司,高速冷冻离心机购自德国Eppendorf 公司,qRT-PCR 仪购自美国Life Technologies 公司。
1.1.2 引物设计与合成U6(内参)和hsa-miR-212的逆转录引物参照CHEN 等[5]的方法设计茎环结构逆转录引物,U6、hsa-miR-212、GAPDH(内参)和TGF-β2各设计1 对qRT-PCR 引物(见表1),引物的设计和合成由德国凯杰公司完成。
1.2 方法
1.2.1 构建荧光素酶报告基因载体通过Targetscan软件获取miR-212-3p与TGF-β2基因3'UTR 潜在的互补结合位点(3'UTR 全长3 257 bp,第746 ~753 位碱基存在miR-212-3p 的潜在结合位点),设计成对PCR 扩增引物(靶点上下游各100 bp 左右,共208 bp),在正向和反向引物5’端分别引入NotⅠ和XhoⅠ限制性内切酶酶切位点,构建含有miR-212-3p 应答序列的TGF-β23'UTR 片段。miR-212-3p 应答序列的TGF-β23'UTR 片段的正向引物(XhoⅠ):5'-GGCGCTCGAGTATATGACCGAGAAAGTCT-3', 反向引物(NotⅠ):5'-AATGCGGCCGCTTCAACATTTC ACTGGTTT-3'(下划线为XhoⅠ和NotⅠ的酶切位点序列,其前面的碱基为保护碱基)。
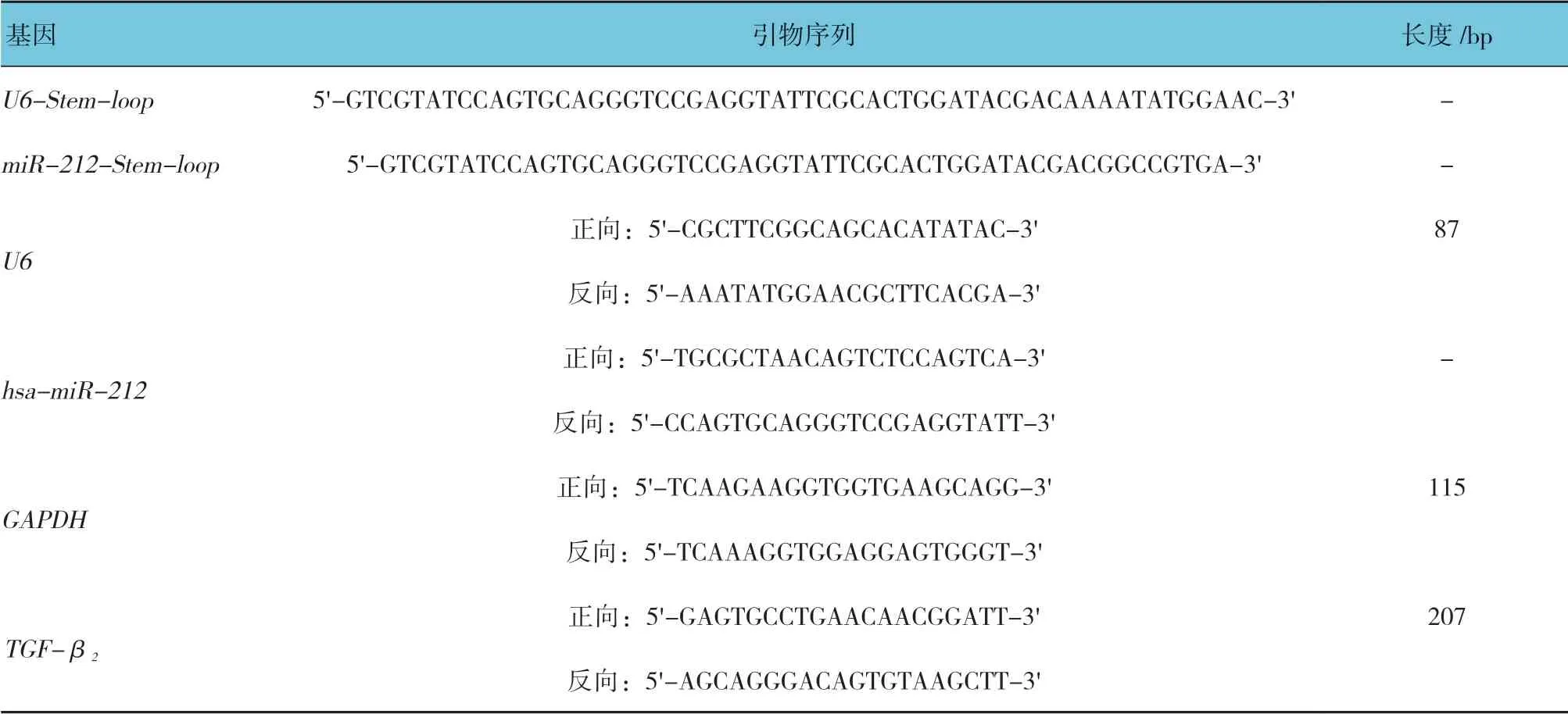
表1 引物序列
人TGF-β2克隆质粒经PCR 扩增后,将获得的PCR 产物与pYr-MirTarget 质粒经限制性内切酶NotⅠ和XhoⅠ切胶后回收,将回收纯化的目的片段TGF-β23'UTR 与回收纯化的载体pYr-MirTarget 用T4 连接酶连接过夜(16℃),连接产物转化DH5α 感受态细胞,涂布LB/氨苄青霉素平板,37℃温箱培养过夜,挑取单个菌摇菌37℃过夜,采用菌落PCR 法将鉴定正确的菌液采用通用引物测序,测序结果比对后将结果正确的菌液克隆于-80℃超低温冰箱保存,并大量制备pYr-MirTarget-TGF-β2 3'UTR 质粒,提取质粒并命名为TGF-β2-Luc。
1.2.2 miR-212-3p 与TGF-β2-Luc 共转染Saos-2细胞37℃水浴复苏Saos-2 细胞,加入DMEM 培养基(含10% FBS)后置于37℃、50%二氧化碳培养箱内培养。用DMEM 培养基(含10% FBS)制备Saos-2 单细胞悬液,按照2×105个/孔的密度将细胞均匀地接种到细胞培养板(12 孔),置于37℃、5%二氧化碳培养箱中培养,待细胞密度达1.8×105个/孔时,使用无血清DMEM 培养基培养2 h 后进行转染。使用LipofectamineTM2000 进行转染,对于每个转染样品均需用100μl 无血清opti-MEM 分别稀释2μg 质粒DNA,然后取4μl LipofectamineTM2000 稀释至100μl 无血清opti-MEM 中,将LipofectamineTM2000 和上述稀释液(总体积为200μl)轻轻混匀并在室温下静置20 min,每个培养孔加混合液200μl,前后轻轻摇动细胞培养板使混合液与培养板中培养液混匀,最后将细胞放置于细胞培养箱中培养,6 h 后吸出混合液换入正常培养基,置于培养箱中继续培养48 h 后收集细胞。按照以下分组转染细胞:miR-212-3p-mimics+TGF-β23'UTR 共 转 染 组、mimics NC+TGF-β2 3'UTR 共 转 染 组( 对 照 组)、miR-212-3p-inhibitor+TGF-β23'UTR 共 转 染 组、inhibitor NC+TGF-β23'UTR 共转染组、TGF-β23'UTR 转染组、pYr-MirTarget 空载质粒转染组、正常细胞组,每个转染组重复3 次。
1.2.3 双荧光素酶报告系统检测荧光素酶活性收集上述各转染组的Saos-2 细胞,弃去细胞培养液后加入300μl 细胞裂解液,充分裂解细胞后12 000 r/min离心5 min,吸取上清液用于测定其双荧光素酶活性。按照双荧光素酶报告基因检测试剂盒说明书测定萤火虫荧光素酶和海肾荧光素酶活性,各转染组检测相对荧光素酶活性3 次,取平均值。对3 次测定的实验数据进行统计分析,计算两者相对荧光强度的比值,以比值作为相对荧光素酶活性的结果。
1.2.4 qRT-PCR 检 测hsa-miR-212 和TGF-β2 mRNA当Saos-2 细胞密度达到1.8×105个/孔时,分别转染NC mimics、miR-212-3p mimics 及inhibitor,48 h 后收集细胞,采用日本TaKaRa 公司MiniBEST Universal RNA Extraction Kit(货 号:NO9767)提 取总RNA,Nanodrop-2000 紫外分光光度仪检测RNA 的浓度和质量,每组2.0μg RNA 逆转录为cDNA,U6 和hsa-miR-212 的逆转录引物采用茎环引物,GAPDH 和TGF-β2的引物采用Oligo(dT),逆转录条件:50℃逆转录mRNA 为cDNA 15 min,85 ℃灭活逆转录酶5 min,-20℃保存。分别以上述cDNA(稀释6 倍)为模板,4 个基因的PCR 引物进行qRT-PCR 反应,反应条件:50℃热启动2 min,95℃预变性10 min,95℃变性30 s,60℃退火30 s(采集荧光),共40 个循环。反应结束后根据扩增曲线分析扩增结果,设定阈值后确定每一管反应的CT 值,各个细胞处理组3 个复孔,按照2-△△Ct法计算目的基因和内参的mRNA相对表达量。
1.2.5 Western blotting检测TGF-β2蛋白按照1.2.4的方法获取细胞后加入RIPA 裂解(含PMSF,比例为1∶100),提取各转染组细胞蛋白,采用BCA 蛋白定量试剂盒测定各组蛋白含量,以20μg/孔蛋白上样量进行SDS-PAGE 电泳,然后将胶转移至同等大小的PVDF 上,恒压稳流(120 V、250 mA)转膜2 h,室温封闭孵育2 h,加入一抗后4℃过夜孵育,以GAPGH 为内参(TGF-β2和GAPDH 抗体稀释比例为1∶1 000,1×TBST 洗涤4 次,10 min/次),加入辣根过氧化物酶标记的二抗,室温孵育2 h 后,最后采用ECL 化学发光法检测蛋白表达,采集图像后使用Image J 软件确定目的蛋白和内参蛋白的灰度值,使用TGF-β2/GAPDH 来确定TGF-β2蛋白在各个转染组细胞中的表达情况。
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析,进一步的两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 成功构建荧光素酶报告基因载体
通过Targetscan软件预测miR-212-3p 与TGF-β2基因存在互补结合位点(见图1)。将TGF-β2基因3'UTR 基因片段(208 bp)克隆到pYr-MirTarget 报告载体测序后显示成功构建荧光素酶报告基因载体。见图2。

图1 miR-212-3p 与TGF-β2 基因互补结合的靶位点预测

图2 TGF-β2 3'UTR 载体构建测序序列比对
2.2 miR-212-3p 靶向结合TGF-β2 3'UTR 抑制荧光素酶活性
将TGF-β2-Luc 重组质粒、miR-212-3p mimics、NC mimics 及inhibitor 片段共转染Saos-2 细胞,每个转染组设置3 组平行实验组,使用双萤光素酶报告试剂盒检测和分析其荧光素酶活性。双荧光素酶活性检测结果表明,各组荧光素酶活性比较,差异有统计学意义(P<0.05)。进一步两两比较显示,miR-212-3p-mimics+TGF-β23'UTR 共转染组低于对照组(P<0.05);inhibitor NC+TGF-β23'UTR 共转染组和TGF-β23'UTR 转染组与对照组比较,差异无统计学意义(P>0.05);pYr-MirTarget 空载质粒转染组高于对照组(P<0.05)。见表2和图3。
2.3 miR-212-3p 靶向抑制TGF-β2 基因的表达
qRT-PCR 结果显示,以U6 为内参,各组hasmiR-212 mRNA 相对表达量比较,差异有统计学意义(P<0.05)。miR-212-3p-mimics+TGF-β23'UTR 共 转染组最高(P<0.05),miR-212-3p-inhibitor+TGF-β23'UTR 共转染组最低(P<0.05);对照组和inhibitor NC+TGF-β23'UTR 共转染组与正常细胞组比较,差异无统计学意义(P>0.05)。以GAPDH 为内参,各组TGF-β2mRNA 相对表达量比较,差异有统计学意义(P<0.05),miR-212-3p-mimics+TGF-β23'UTR 共 转染组最低(P<0.05),miR-212-3p-inhibitor+TGF-β2 3'UTR 共转染组最高(P<0.05)。对照组和inhibitor NC+TGF-β23'UTR 共转染组与正常细胞组比较,差异无统计学意义(P>0.05)。见表3和图4。
表2 各组Saos-2 细胞荧光素酶活性的比较 (n =3,±s)

表2 各组Saos-2 细胞荧光素酶活性的比较 (n =3,±s)
组别 荧光素酶活性miR-212-3p-mimics+TGF-β2 3'UTR 共转染组 7.7524±0.2024对照组 12.5994±0.3728 miR-212-3p-inhibitor+TGF-β2 3'UTR 共转染组 14.8676±0.3569 inhibitor NC+TGF-β2 3'UTR 共转染组 12.3573±0.1305 TGF-β2 3'UTR 转染组 13.0892±0.2979 pYr-MirTarget 空载质粒转染组 14.7066±0.3697正常细胞组 1.1264±0.1238 F 值 901.005 P 值 0.000

图3 各组Saos-2 细胞荧光素酶活性比较 (±s)
2.4 miR-212-3p 靶向抑制TGF-β2 蛋白的表达
各组TGF-β2蛋白相对表达量比较,差异有统计学意义(P<0.05)。miR-212-3p-inhibitor+TGF-β23'UTR 共转染组最高(P<0.05),miR-212-3p-mimics+TGF-β23'UTR 共转染组最低(P<0.05)。对照组和inhibitor NC+TGF-β23'UTR 共转染组与正常细胞组比较,差异无统计学意义(P>0.05)。见表4和图5。
表3 各组has-miR-212 和TGF-β2 mRNA 相对表达量比较 (n =3,±s)

表3 各组has-miR-212 和TGF-β2 mRNA 相对表达量比较 (n =3,±s)
组别 has-miR-212 mRNA TGFβ2 mRNA正常细胞组 1.007±0.148 1.006±0.142 miR-212-3p-mimics+TGF-β2 3'UTR 共转染组 2.727±0.245 0.550±0.077 miR-212-3p-inhibitor+TGF-β2 3'UTR 共转染组 0.283±0.025 1.398±0.197对照组 1.022±0.150 1.042±0.147 inhibitor NC+TGFβ2 3'UTR 共转染组 0.906±0.133 1.115±0.158 F 值 101.587 12.533 P 值 0.000 0.001
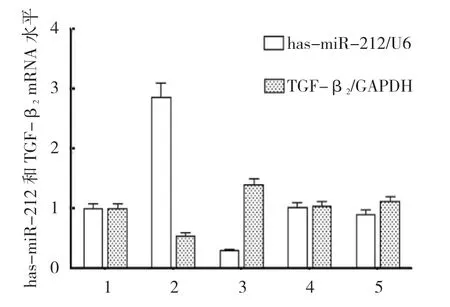
图4 各组has-miR-212 和TGF-β2 mRNA 相对表达量比较 (±s)
表4 各组TGFβ2 蛋白相对表达量比较 (n =3,±s)

表4 各组TGFβ2 蛋白相对表达量比较 (n =3,±s)
组别 TGF-β2 蛋白正常细胞组 0.475±0.026 miR-212-3p-mimics+TGF-β2 3'UTR 共转染组 0.217±0.019 miR-212-3p-inhibitor+TGF-β2 3'UTR 共转染组 0.648±0.023对照组 0.453±0.013 inhibitor NC+TGF-β2 3'UTR 共转染组 0.487±0.026 F 值 147.763 P 值 0.000
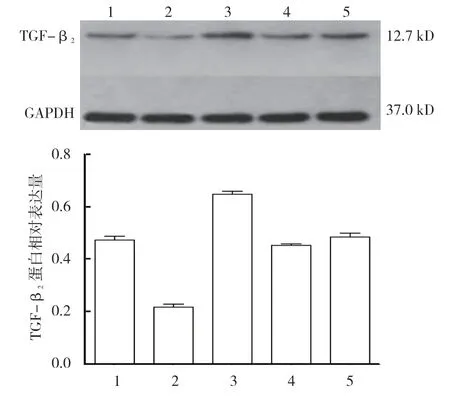
图5 各组TGF-β2 蛋白相对表达量比较 (±s)
3 讨论
miRNA 是小的内源性RNA 分子,单个miRNA 可作用于≥1 个靶mRNA,这依赖于miRNA 与靶mRNA碱基互补配对方式。大多数靶向的mRNA 通过其3'UTR 与miRNA 相互作用,根据互补程度,miRNA 可以通过切割磷酸二酯键直接破坏mRNA 或部分互补从而抑制其表达。在哺乳动物中,miRNA 和靶向mRNA的3'UTR 不能完全互补,通过翻译抑制靶向mRNA 的表达来发挥作用[6]。miRNA 对mRNA 翻译的抑制作用已经成为人成骨细胞的发育过程,参与成骨信号通路、成骨细胞生长、分化以及凋亡的重要调控因子。
近年来,氟中毒对骨骼危害的研究越来越多,小剂量的氟可以起到预防作用并刺激骨细胞的增殖,大剂量则可诱导细胞凋亡,引起骨质疏松或骨质硬化从而导致氟骨症。氟骨症主要的病理变化是成骨细胞发生凋亡,破坏破骨细胞与成骨细胞转换过程的平衡,但其具体的分子机制尚不明确。本课题组前期利用与成骨细胞凋亡相关的miRNA PCR 芯片技术发现氟化钠处理人成骨细胞48 h 后miR-212-3p 表达上调[4]。最初的研究发现miR-212-3p 参与神经元的形成、调节昼夜节律、控制药物成瘾和免疫调节[7],除了上述功能外,其在癌症的发生、发展中也发挥着重要作用,其抑制作用与细胞周期阻滞、上皮-间质转化过程和细胞凋亡相关[8-11]。例如其通过抑制结缔组织生长因子和转录因子叉头框蛋白A1(FOXA1)在人肝癌细胞中表达,从而抑制肝癌细胞的增殖和侵袭[12-13],靶向结合甲基化CpG 结合蛋白-2 并下调其表达,阻止早期神经发生[14]和参与感染诱导的早产[15],直接靶向有丝分裂原活化蛋白激酶3 来抑制卵巢癌进一步发展[16],在膀胱癌中靶向结合核因子IA 抑制癌细胞增殖并促进细胞凋亡[9]。此外,在骨肉瘤患者中已发现包括miR-212 在内的特定miRNA 的失调,LIU 等[17]研究发现miR-212 可以直接结合FOXA1 mRNA 3'UTR序列,并且在MG-63 和Saos-2 骨肉瘤细胞中负调控FOXA1 蛋白的表达。裴祎等[18]研究证实miR-212 可以直接作用于锌指蛋白133,通过抑制其表达从而抑制骨肉瘤细胞的增殖和迁移。
人们对成骨细胞凋亡过程中miR-212-3p 的调控机制及其靶基因了解甚少。故本研究前期通过生物信息学软件预测miR-212-3p 的靶基因时发现TGF-β2基因的3'UTR 与其存在潜在的互补结合位点,并且通过实验证实miR-212-3p 直接靶向TGF-β2并抑制其表达。TGF-β2是TGF-β 超家族成员之一,TGF-β超家族成员除包含TGF-βs(哺乳动物中TGF-β1、TGF-β2和TGF-β3)以外,还包括激活素、BMP 以及生长和分化因子等40 个成员[19-21]。TGF-β 是由多种细胞产生的,骨是TGF-β 主要的组织来源,被认为是用于调节成骨细胞和破骨细胞经典的耦合因子之一。可用于成骨细胞,调节其增殖和分化,一方面是因为成骨细胞自身可以合成分泌TGF-β,另一方面是因为成骨细胞细胞膜上有各个亚型的特异性受体。TGF-β 家族蛋白首先和细胞膜表面特异性的Ⅰ型和Ⅱ型丝氨酸/苏氨酸激酶受体结合形成异源复合物,Ⅱ型受体激活后,使得Ⅰ型受体磷酸化,活化的Ⅰ型受体通过磷酸化的Smad 蛋白和R-Smads 启动细胞内信号传导,随后活化的R-Smads 与co-Smad 和Smad4形成复合物,将信号从膜外传递到细胞核内开启转录应答。TGF-β2通过与骨髓间充质干细胞膜上的TGF-β2R Ⅰ和TGF-β2R Ⅱ结合形成复合物,激活后的TGF-βR Ⅰ通过Smad 蛋白促进成骨细胞的形成[22]。成骨细胞分化早期阶段的体外研究表明,TGF-β主要通过促进成骨细胞祖细胞的迁移并刺激其增殖来增加骨形成[23],在以后的阶段,TGF-β 以Smad3 依赖的方式阻断成骨细胞的分化和骨矿化[24-25]。TGF-β阻断成骨细胞的凋亡,从而在分化过程中维持成骨细胞的存活,由此可以推断TGF-β2参与并调控成骨细胞的凋亡。
综上所述,本研究通过双荧光素酶报告实验证实TGF-β2是miR-212-3p 的靶基因,miR-212-3p 可以与TGF-β23'UTR 靶向结合发挥负调控作用。此外Western blotting 和qRT-PCR 检测结果表明,Saos-2 细胞外源添加miR-212-3p 后,TGF-β2的mRNA 和蛋白相对表达量都明显下降,这些结果提示miR-212-3p 负向调控靶基因TGF-β2,这一结果为后续研究氟骨症中miR-212-3p 的作用提供了参考。目前,发现成骨细胞凋亡过程中miRNA 的数量逐渐增多,但仍需发现更多的miRNA 调控其靶基因中的分子机制,为成骨细胞的凋亡及过量氟中毒患者的临床治疗提供更多的方法和参考。

