术中直接电刺激运动诱发电位对脑干运动功能保护作用初探
陶晓蓉 王明然 王荣 李志保 樊星 张力伟 乔慧
脑干占位性病变特别是胶质瘤,由于与邻近脑组织界限不清,手术切除过程中可能造成脑神经核团和皮质脊髓束(CST)的牵拉损伤,易导致术后新发功能障碍[1]。术中直接电刺激运动诱发电位(DES⁃MEP)通过直接电刺激中央前回和皮质脊髓束,记录远端复合肌肉动作电位(CMAP),以监测运动神经传导通路功能,用于指导脑功能区肿瘤的切除已成为国内外共识,但仍缺乏术中DES⁃MEP评估脑干运动功能的研究。首都医科大学附属北京天坛医院神经外科近3年来共收治136例脑干肿瘤患者,通过术中常规电生理监测或常规电生理监测联合DES⁃MEP监测,结合运动功能评价对DES⁃MEP监测技术在脑干肿瘤切除手术中的应用价值进行初步探讨。
对象与方法
一、研究对象
1.纳入与排除标准 (1)术前经头部MRI证实为脑干肿瘤且累及皮质脊髓束,行脑干肿瘤切除术。(2)术中行电生理监测。(3)年龄5~ 65 岁。(4)术前四肢Lovett肌力分级≥3级。(5)排除既往有癫病史、颅内植入物等不宜行经颅电刺激患者,以及术前四肢Lovett肌力分级<3级或存在语言障碍无法配合肌力评价的患者。
2.一般资料 选择2017年1月至2020年5月在我院神经外科行脑干肿瘤切除术的患者共136例,男性72例,女性64例;年龄5~65岁,中位年龄26.50(15.00,38.75)岁;病程1~72 个月,中位病程为3(2,7)个月。术前头部MRI显示,肿瘤位于延髓37例(27.21%)、脑桥 58例(42.65%)、中脑 14例(10.29%)、脑桥和延髓21例(15.44%)、中脑和脑桥6例(4.41%);其中手术全切除37例(27.21%)、近全切除74例(54.41%)、部分切除25例(18.38%);术后病理分型为高级别(WHOⅢ~Ⅳ级)胶质瘤62例(45.59%)、低级别(WHOⅠ~Ⅱ级)57例(41.91%),海绵状血管瘤或其他类型肿瘤17例(12.50%)。根据术中皮质脊髓束监测方法,采用随机数字表法随机分为常规电生理监测联合神经导航技术组(对照组,68例)和常规电生理监测基础上加用直接电刺激联合神经导航技术组(联合监测组,68例)。两组患者一般资料比较,差异无统计学意义(均P>0.05,表1),均衡可比。
二、研究方法
1.麻醉方案 患者仰卧位,气管插管全身麻醉。以全凭静脉麻醉(TIVA)药物异丙酚2 mg/kg、舒芬太尼0.30 μg/kg和罗库溴铵0.60 mg/kg作为麻醉诱导,予以瑞芬太尼2 μg/(kg·min)和异丙酚4~6 mg/(kg·h)进行维持,脑电双频指数(BIS)45~55。
2.术前MRI检查 所有患者均于术前行MRI检查,采用Philips Ingenia CX MRI扫描仪行DTI扫描以重建锥体束三维结构,重复时间(TR)4000 ms、回波时间(TE)88 ms,翻转角(FA)90°,扫描视野(FOV)218 mm×200 mm,矩 阵 80×85,激 励 次 数(NEX)1次,b值 1000 s/mm2,层厚 2.50 mm、层间距为零,共60层,扫描时间405.50 s,范围覆盖全脑。同时联合美国Medtronic公司生产的神经导航系统显示肿瘤与锥体束及其周围神经纤维的三维解剖关系,通过导航工作站软件StealthViz version 1.3.0.34将导航扫描序列与DTI序列自动融合,勾画肿瘤轮廓,重建锥体束。
3.术中诱发电位监测 采用美国Cadwell公司生产的Cascade诱发电位监测仪行术中监测。(1)对照组:行常规诱发电位监测,包括经颅电刺激运动诱发电位(TceMEP)、体感诱发电位(SEP)和脑干听觉诱发电位(BAEP)。(2)联合监测组:术中行常规诱发电位与DES⁃MEP联合监测。DES⁃MEP监测的刺激电极为手持单极电刺激器,与导航系统万能注册器相连接,以单极刺激器代替导航定位探针作为阴极、单极针电极(置于Fz)作为阳极;采取5~8个串的脉冲刺激,脉冲波宽为200 μs、间隔2 ms,刺激频率500 Hz、强度为0.50~10 mA,自0.50 mA逐渐增加刺激强度直至引出复合肌肉动作电位,该刺激强度即为刺激阈值,以定位刺激点与脑干和皮质脊髓束的位置关系。记录电极为皮下针电极,上肢分别置于大鱼际肌和小鱼际肌、下肢置于展肌;滤波范围为30~1500 Hz,信号分析时间为100 ms,灵敏度为50 μV至1 mV。

表1 联合监测组与对照组患者一般资料的比较Table 1. Comparison of general data between combined monitoring group and control group
4.评价指标 (1)运动功能:分别于术前和术后2周,采用Lovett肌力分级标准对患者左侧和右侧、上肢和下肢肌力进行评价。0级,无可见或仅感觉到肌肉收缩;1级,可触及轻微肌肉收缩,但无关节活动;2级,可在消除重力的姿势下做全关节活动范围的运动;3级,可抗重力做全关节活动范围的运动,但无法抗阻力;4级,可抗重力和一定的阻力做运动;5级,可抗重力和充分的阻力做运动。除肌力评价,尚须记录四肢Lovett肌力分级最低值。根据手术前后肌力变化判断是否存在新发运动障碍,与术前相比,术后2周肌力无下降或下降程度≤1级,则为无严重的新发运动障碍;术后2周肌力降低≥2级,为存在严重的新发运动障碍。(2)DES⁃MEP 与运动功能的关系:根据术中DES⁃MEP监测结果和术后运动功能评价,定义DES⁃MEP监测结果。真阳性,DES⁃MEP监测呈阳性且无严重的新发运动障碍;假阳性,DES⁃MEP监测阳性,但存在严重的新发运动障碍;真阴性,DES⁃MEP监测呈阴性,且存在严重的新发运动障碍;假阴性,DES⁃MEP监测呈阴性,但无严重的新发运动障碍。(3)DES⁃MEP预测术后严重的新发运动障碍:根据DES⁃MEP监测结果,计算DES⁃MEP预测术后严重新发运动障碍的灵敏度与特异度、阳性预测值与阴性预测值、准确率。灵敏度=真阳性例数/(真阳性例数+假阴性例数)×100%,特异度=真阴性例数/(假阳性例数+真阴性例数)×100%,阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%,阴性预测值=真阴性例数/(假阴性例数+真阴性例数),准确率=(真阳性例数+真阴性例数)/总例数×100%。
5.统计分析方法 采用SPSS 23.0统计软件进行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验。呈非正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示,采用Mann⁃WhitneyU检验。以P≤0.05为差异具有统计学意义。
结 果
术后2周,对照组46例(67.65%)患者无严重新发运动障碍、22例(32.35%)存在严重新发运动障碍,联合监测组57例(83.82%)无严重新发运动障碍、11例(16.18%)存在严重新发运动障碍,组间差异具有统计学意义(χ2=4.841,P=0.028)。
联合监测组48例(70.59%)患者于大鱼际肌、小鱼际肌或展肌记录到DES⁃MEP波形,且波形与TceMEP波形相似,呈多相波(图1);20例(29.41%)未记录到异常波形。根据术中DES⁃MEP监测结果和术后运动功能评价,DES⁃MEP监测真阳性44例、假阳性4例、真阴性7例、假阴性13例,其预测术后严重新发运动障碍的灵敏度为77.19%(44/57)、特异度7/11,阳性预测值91.67%(44/48)、阴性预测值35%(7/20),诊断准确率为75%(51/68,表2)。
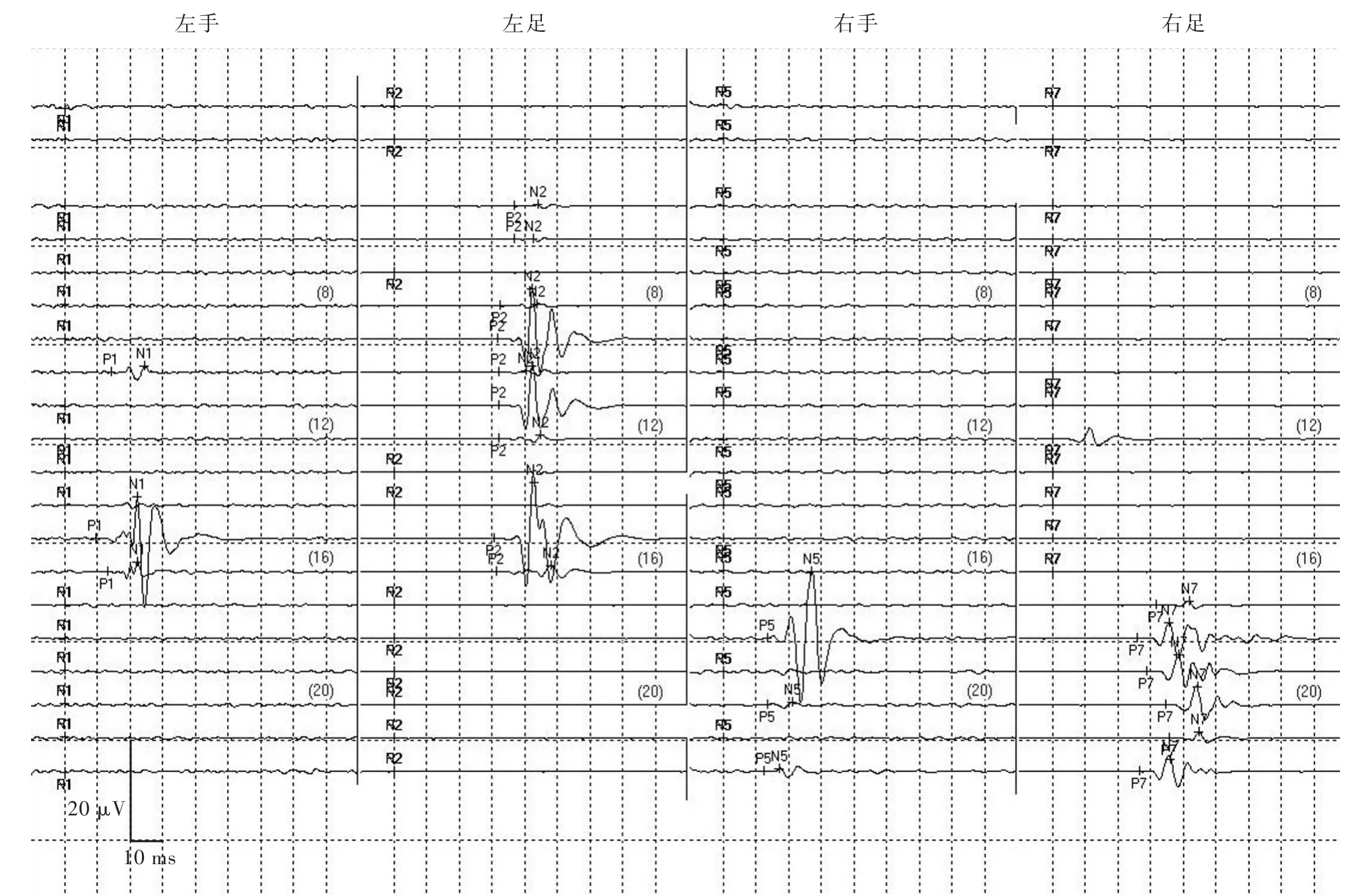
图1 女性患者,14岁。间歇性头痛2年余、加重1个月,临床诊断为脑干星形细胞瘤,行脑干肿瘤切除术。术中DES⁃MEP监测分别于左侧和右侧大鱼际肌、小鱼际肌和展肌记录到多相波,术后2周未见严重新发运动障碍Figure 1 A 14⁃year⁃old female patient with intermittent headache for more than 2 years and aggravating for 1 month,was clinically diagnosed as brainstem astrocytoma,and underwent resection of brainstem tumor.DES⁃MEP monitoring was performed during the operation.Multiphase waveforms were recorded in the left and right thenar muscles and musculi abductor hallucis respectively.No severe new dyskinesia occurred 2 weeks after operation.
讨 论
脑干手术是神经外科最具挑战性的手术,具有较高的病残率和病死率。脑干结构复杂,其间穿行运动和感觉传导通路,脑干手术存在增加术后神经功能缺损的高风险[2]。皮质脊髓束是脑干下行传导纤维中最大的纤维束,其神经元起源于皮质中央前回及其他区域,下行穿过脑干在延髓形成锥体,并大部分交叉至对侧,形成皮质脊髓侧束,最后止于脊髓前角;小部分在锥体未交叉的纤维则形成皮质脊髓前束,在脊髓前索下行,同样止于脊髓前角,其主要功能是支配骨骼肌并控制肢体随意运动,是术中最需保护的白质纤维束。如何在保护运动功能的前提下实现肿瘤的最大程度切除,仍是神经外科的一大难题[3⁃4]。目前,神经导航技术已广泛应用于神经外科手术,基于术前MRI可以准确定位病变,精确实现白质纤维束的可视化,并显示病变与白质纤维束的解剖关系,从而指导术前制定手术方案、确定手术切口和入路,以及术中避开重要解剖结构,以免造成不必要的手术损伤[5]。但该项监测技术不能实时反映运动功能,因此术中神经电生理监测仍是术中评价运动功能的“金标准”,指导神经外科手术[3,6]。
目前,广泛应用于脑干肿瘤切除手术中的电生理监测技术主要为脑干听觉诱发电位、体感诱发电位、TceMEP[7]和脑干神经核团 Mapping技术等的多模态联合,可以较为全面地反映运动神经核团的分布,以及皮质脊髓束、皮质延髓束等功能状态,为术者清晰地展示病灶周围重要神经结构,从而降低手术病残率。术中多模态神经电生理监测和现代影像学技术的发展及联合应用,为提高手术疗效、减轻术后神经功能缺损提供了有力支撑,但目前监测方法对运动功能的保护仍存不确定性,需进一步研究改进[8]。有文献报道,脑干听觉诱发电位联合体感诱发电位监测脑干功能的阳性率仅为20%[9],尽管TceMEP对评价皮质脊髓束功能状态和脑干缺血性损伤具有重要意义[10⁃11],但其主要是通过监测对侧肢体复合肌肉动作电位以反映皮质脊髓束完整性,这一神经传导通路经过多突触传递,极易受麻醉药物特别是肌松药的影响,波幅和潜伏期的变异性较大,与运动功能预后之间无线性相关关系[12]。在幕上肿瘤手术过程中,TceMEP的预警标准是复合肌肉动作电位波幅降低50%,而脊髓手术中波幅消失方需术者的高度警惕,由此可见,尚缺乏统一的脑干手术预警标准[13]。同时,TceMEP所诱发的稳定的复合肌肉动作电位所需刺激强度较高,术中易引发患者体动,进而增加手术风险。因此,脑干肿瘤手术亟需一种安全、高效的术中神经电生理监测技术,用于评估和保护患者运动功能,弥补现阶段术中神经电生理监测技术在皮质脊髓束功能保护方面的不足。DES⁃MEP可在降低假阴性率的同时,精准提供与运动传导束之间距离等信息,对于确定病灶切除范围具有重要意义,是一种比TceMEP更加安全、有效的保护运动功能的监测技术。本研究结果显示,联合监测组患者术后2周出现严重新发运动障碍(Lovett肌力分级降低≥2级)的比例为16.17%(11/68),低于常规电生理监测组的32.35%(22/68),结果表明术中常规电生理监测联合DES⁃MEP监测可以有效降低术后严重新发运动障碍的发生。
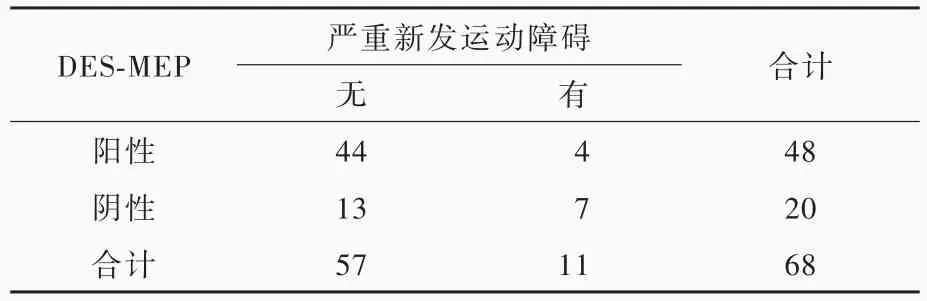
表2 DES⁃MEP监测结果预测术后严重新发运动障碍的灵敏度和特异度分析(例)Table 2. Sensitivity and specificity ofDES⁃MEP monitoring results in predicting postoperative severe new dyskinesia(case)
本研究联合监测组有48例(70.59%)患者于大鱼际肌、小鱼际肌和展肌记录到DES⁃MEP波形,其中44例术后2周未出现严重的新发运动障碍,DES⁃MEP监测阳性预测值为91.67%(44/48),提示术中DES⁃MEP监测呈阳性对术后运动功能有较好的预测价值;其余4例术后发生严重的新发运动障碍,推测可能是由于刺激位点邻近皮质脊髓束。Prabhu等[14]发现,刺激电极距离皮质脊髓束<5 mm时,可加重神经功能障碍。Cedzich等[15]于颞叶致灶切除术后首次以2~10 mA的单极电刺激直接刺激脑干诱发出运动诱发电位,因此认为,DES⁃MEP诱发脑干运动诱发电位的刺激强度(2~10 mA)低于皮质运动诱发电位(5~18 mA),推测可能与脑干运动传导神经更加局限有关。本研究是否存在因刺激位点距离皮质脊髓束过近或刺激强度过大而引发运动功能缺失的现象?尚待进一步研究加以验证。本研究联合监测组有20例(29.41%)患者未记录到DES⁃MEP波形,其中13例术后2周未出现严重的新发运动障碍,推测可能是由于刺激位点距离皮质脊髓束较远[1],未损伤运动功能;其余7例术后发生严重的新发运动障碍,DES⁃MEP监测的阴性预测值为35%(7/20)。本研究结果提示,DES⁃MEP监测的阳性结果对术后运动功能的预测价值高于阴性结果。
DES⁃MEP刺激强度是否与刺激部位和传导束之间的距离存在线性相关关系,尚存争议,主要是由于不同研究之间测量方法和统计分析方法不尽相同[16],这也是本研究的局限性,今后尚待对脑干DES⁃MEP的最佳刺激模式进行深入研究。
综上所述,脑干肿瘤手术中联合应用常规电生理监测和DES⁃MEP监测,可以实现对脑干运动功能的保护,弥补现阶段术中神经电生理监测技术在皮质脊髓束功能保护方面的不足。
利益冲突 无

