微量植物组织直接RT-PCR 反应检测4 种植物病毒的方法建立与优化
李 姣, 任秋蓉, 古 蕾, 朱晓换, 王亚男
(四川师范大学 生命科学学院,四川 成都610101)
为了控制植物病毒引起的植物病害发生和防止植物病毒在国家和地区之间传播,必须对植物进行病毒检测.植物病毒检测在无病毒植物组织培养的过程中(特别是在脱除病毒之后)是重要环节之一.长期以来,人们一直致力于开发简单有效的植物病毒检测方法,如酶联免疫吸附试验(ELISA)[1-4]、逆转录聚合酶链反应(RT -PCR)[5-7]、real -time RT -PCR[8-9]、逆转录环介导等温扩增反应(RT - loop - mediated isothermal amplification,RT-LAMP)[10-11]、微阵列[12]和下一代测序[13]等.其中,灵敏度高且操作较简便的方法是RT-PCR,已被广泛应用于病毒检测[14-18].
在采用RT - PCR 技术检测植物病毒的过程中,第一个步骤是通过分离和纯化RNA 获得RNA模板.RNA的分离是一项技术性强、耗时长的工作,需要一定量的植物材料和几个离心步骤.RNA提取后,还必须对RNA提取液进行纯化,以获得高质量的RNA模板.在提取和纯化的步骤中,操作人员的技术错误可能会导致RNA 污染或降解等问题,从而使检测结果出现假阴性、假阳性等错误[14,18].因此,目前RT -PCR 检测植物病毒的方法存在RNA模板制备较困难的缺点.
简化RNA模板的制备过程将有助于提高植物病毒检测的效率,降低检测成本,并能极大地促进RT-PCR在其他领域的应用.一种称为微量组织直接RT -PCR 反应(Microtissue direct RT -PCR)的简单快速的RNA模板制备方法最初由Hosokawa等[19]于2006 年提出,有效检测了菊花植株中的2种类病毒,即菊花矮化类病毒(CSVd)和菊花褪绿斑驳类病毒(CChMVd).他们的研究发现,无菌注射器针头(25 G)比剃刀更适合于CChMVd的检测,而且在高浓度和低浓度类病毒感染的菊花植株中均能检测到类病毒.然而,此后未有微量组织直接RT-PCR反应检测其他植物病毒的研究,由此人们对该方法产生了2 个疑问:该方法是否只局限于菊花类病毒检测?该方法可以应用于更多种类的植物病毒检测吗?为了解决这2 个问题,让微量组织直接RT-PCR反应方法应用到更多种类的植物病毒检测中,本研究建立与优化了该方法,可检测4种不同属植物病毒感染的4 种植物,即葡萄卷叶相关病毒3(Grapevine leafroll-associate virus-3,GLRaV-3)感染的葡萄、苹果茎沟病毒(Apple stem grooving virus,ASGV)感染的苹果、马铃薯卷叶病毒(Potato leafroll virus,PLRV)感染的马铃薯和百合花叶病毒(Cucumber mosaic virus,CMV)感染的百合.GLRaV-3、ASGV、PLRV和CMV分别是Ampelovirus属[20]、Capillovirus属[21]、Polerovirus属[22]和Cucumovirus属[23]病毒的成员.经正反向引物扩增所产生的特异性DNA条带的长度分别是:GLRaV -3为546 bp[24],ASGV 为524 bp[5],PLRV 约为600 bp[25],CMV为657 bp[26].本研究首先以GLRaV -3 感染的葡萄试管苗为实验材料进行微量组织直接RT-PCR反应,以优化RNA模板的制备工艺,然后应用于其他3 种植物病毒感染的3 种植物中,以检测微量组织直接RT - PCR 反应的敏感性和广谱性.
1 材料与方法
1.1 实验材料本研究以GLRaV -3 感染的葡萄品种“Cabernet Sauvignon”、ASGV 感染的苹果品种“Gala”、PLRV感染的马铃薯品种“紫花白”和CMV感染的百合品种“Siberia”为植物材料,在MS 培养基上进行离体组织培养,同时以相应的无病毒试管苗作为阴性对照.MS培养基添加了质量浓度30 g/L的蔗糖和质量浓度7 g/L的琼脂,pH值为5.8,在121 ℃高压灭菌20 min.离体组织培养的条件:光照由冷白色荧光管提供,光照周期为16 h 光照/8 h黑暗,光亮度为50 μmol·s /m2,温度为(24 ±2)℃.离体培养物每4 周进行一次继代培养.
1.2 实验方法
1.2.1 植物组织总RNA 提取 按照传统的RNA模板的制备方法,将植物组织(鲜质量0.5 g)放入事先盛有液氮的研钵中,充分研磨,然后按照北京庄盟国际生物基因科技有限公司提供的植物组织总RNA提取的说明书,用该公司提供的植物组织总RNA提取试剂盒进行操作.
根据修改过的Hosokawa 等[19]用微量组织直接制备RNA 模板的方法,用无菌注射器针(Terumo,日本)在立体显微镜下刺入GLRaV -3 感染的葡萄试管苗的茎中直到其到达茎的中间部分,具体步骤如下:
1)无菌注射器针头分别在茎、叶柄和根取样(如图1A所示);
2)无菌注射器针头刺入取样部位的中间部分,在那里停留2 ~3 s(如图1B所示);
3)在室温中将沾有组织液的针头直接浸入RT反应液中15 min.
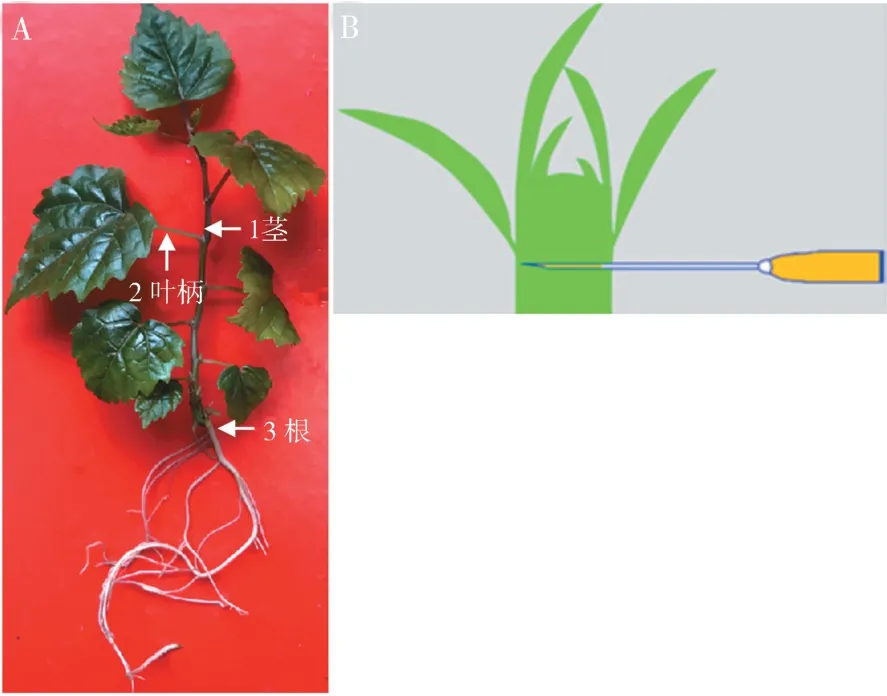
图1 微量组织直接RT-PCR反应检测GLRaV-3 感染的葡萄赤霞珠试管苗时RNA模板直接制备的方法示意图Fig. 1 Illustrations of microtissue direct preparation method of RNA template in in vitro grapevine“Cabernet Sauvignon”stock plantlets infected with GLRaV-3
本研究通过2 个实验优化了微量组织直接制备RNA模板的工艺.在第一个实验中,用3 种不同尺寸的无菌注射器针头刺入葡萄试管苗的茎中,以选择一种最佳尺寸的针头来获取组织液,制备RNA模板.这3 种尺寸分别为26 G(0. 45 ×16 RW -LB)、25 G(0.5 ×16 RW - LB)和23 G(0. 6 ×25 TW-LB).在第二个实验中(如图1A 所示),使用无菌注射器针头(26 G)从葡萄试管苗的不同部位(包括茎、叶柄、叶和根)来获取组织液,制备RNA模板,以确定哪些植物组织适合于用微量组织直接RT-PCR反应检测.
1.2.2 RT -PCR 反应 RT -PCR 反应首先对传统法提取的RNA模板或者微量组织汁液中含有的RNA进行RT反应,然后对RT 反应产物进行PCR扩增.
传统的RT 反应体系的总体积为20 μL,其中各成分含量为:1 μg RNA 和4 μL 5 × TRUE RT MasterMix(该试剂包含M -MLV 逆转录酶和一对随机引物).各成分配置完成后,以ddH2O 补齐至20 μL,于42 ℃恒温反应20 min,获得DNA 模板,随后于85 ℃放置5 s,使逆转录酶失活,终止反应.
微量组织直接RT 反应体系总体积为20 μL,其成分与传统的RT 反应体系的成分相同,只是不加RNA,以ddH2O补齐至20 μL.将黏附了组织汁液的针尖浸在RT反应体系中,室温反应15 min,获得DNA模板,随后于85 ℃放置5 s,使逆转录酶失活,终止反应.操作中,尽量使黏附了组织汁液的针尖完全浸在RT反应液中,并盖严管盖,否则会影响RT反应结果.
PCR反应体系总体积为25 μL,其中各成分含量为:12.5 μL 2 ×Utaq PCR MasterMix、10 μmol/mL正反向引物(表1)各1 μL、2 μL cDNA 模板.各成分配置完成后,以ddH2O补齐至25 μL,放入Bio-Rad PCR仪中进行PCR扩增.
用于检测GLRaV-3 的PCR反应条件:1)预变性:94 ℃,3 min;2)35 个循环:94 ℃,30 s;52 ℃,30 s;72 ℃,60 s;3)末次延伸:72 ℃,7 min.
用于检测ASGV 的PCR 反应条件:1)预变性:94 ℃,3 min;2)35 个循环:94 ℃,30 s;54 ℃,45 s;72 ℃,60 s;3)末次延伸:72 ℃,5 min.
用于检测PLRV的PCR反应条件:1)预变性:94 ℃,3 min;2)35 个循环:94 ℃,30 s;50 ℃,30 s;72 ℃,30 s;3)末次延伸:72 ℃,10 min.
用于检测CMV的PCR反应条件:1)预变性:94 ℃,3 min;2)30 个循环:94 ℃,15 s;54 ℃,30 s;72 ℃,30 s;3)末次延伸:72 ℃,5 min.

表1 用于微量组织直接RT-PCR反应和传统RT-PCR反应检测4 种植物病毒的引物序列及特异性条带长度Tab. 1 Primer sequences and the specific band sizes used for detection of 4 plant viruses by micro-tissue RT-PCR and RT-PCR
1.2.3 2%琼脂糖凝胶电泳成像 RT -PCR反应产物用质量分数2%琼脂糖凝胶电泳法检测.将0.6 g的琼脂糖放入30 mL TAE缓冲液(40 mmol/mL Trisacetate,1 mmol/mL EDTA,pH8.0)中溶解,滴入1.5 μL Goldview 核酸染料(5 μL 核酸染料/100 mL TAE缓冲液),倒入胶模中,室温静置约30 min,使胶完全凝固.把胶放入装有适量TAE缓冲液的Bio-Rad凝胶电泳仪的电泳槽内,分别往孔道中加入6 μL DL2000 DNA相对分子质量标准和6 μL RT -PCR反应产物的混合液(1 μL 反应产物/5 μL 上样缓冲液)后,盖上电泳槽,通电1 ~5 V/cm,使DNA向阳极移动.电泳完毕后,取出凝胶,在Bio -Rad 成像系统中检查凝胶并拍照.
1.2.4 数据处理 本研究中所有实验重复2 次,每次使用20 株同种植物的阴性对照(即无病毒感染)试管苗和20 株同种植物的阳性对照(即病毒感染)试管苗.所有数据采用Microsoft Office Excel 2013 软件进行统计.
2 结果与分析
2.1 以GLRaV -3 感染的葡萄试管苗为实验材料优化微量组织直接RT-PCR反应的工艺
2.1.1 26 G 针头最适用于微量组织直接RT -PCR反应 本研究首先以GLRaV -3 感染的葡萄试管苗为实验材料,通过2 个实验优化了微量组织直接制备RNA 模板的工艺.第一个实验结果如图2、表2 显示,图2 中M为分子标记,N为阴性对照,P为阳性对照,泳道1—3 为感染样本,泳道4 为健康样本。虽然3 种不同尺寸的无菌注射器针头刺入葡萄试管苗茎的中间部位时所采集的组织液都可以通过微量组织直接RT -PCR 反应检测到GLRaV-3 的特异性DNA条带(546 bp),但是能检测到该条带的样本数量和百分比在三者中差别很大.通过25和23 G针头制备的RNA模板直接RT-PCR反应分别检测到50%和25%样本中的GLRaV-3 条带,而通过26 G 针头制备的RNA 模板直接RT -PCR反应检测到100%样本中的GLRaV -3 条带(表2),说明在3 种不同尺寸的针头中,26 G 针头最适用于获取植物组织液,制备RNA模板.

图2 3 种规格的针头采集微量组织后直接RT-PCR反应检测葡萄赤霞珠试管苗茎中的GLRaV-3Fig. 2 Microtissue direct RT-PCR for detection of GLRaV-3 in stems of in vitro infected stock plantlets of grapevine“Cabernet Sauvignon”using three sizes of sterile syringe needles

表2 微量组织直接RT-PCR反应检测GLRaV-3,用3种不同尺寸的无菌注射器针头采集GLRaV-3 感染葡萄试管苗茎的组织液直接制备RNA模板的所产生的特异性条带(546 bp)的数量和百分比Tab. 2 Number and percentages of specific bands(546 bp)detected by RT-PCR in microtissue direct preparations of RNA templates of stems infected with GLRaV-3 using 3 sizes of sterile syringe needles
2.1.2 植物茎、叶柄或根是微量组织直接RT -PCR反应的适宜器官 第二个实验结果如图3 所示,M为分子标记,N 为阴性对照,P 为阳性对照,泳道1 为感染植株的茎,泳道2 为感染植株的叶柄,泳道3 为感染植株的根,泳道4 为健康茎.在葡萄试管苗茎、叶柄和根中都检测到了GLRaV -3 的DNA条带,说明植物任一部位都可以用于采集组织液,进行微量组织直接RT-PCR反应.

图3 微量组织直接RT-PCR反应检测GLRaV-3在葡萄赤霞珠试管苗不同组织中的表达Fig. 3 Detection of GLRaV-3 by microtissue direct RT-PCR in various tissues of in vitro infected stock plantlets of grapevine“Cabernet Sauvignon”
2.2 微量组织直接RT -PCR 反应与传统RT -PCR反应检测GLRaV-3 的敏感性比较本研究以传统的RT -PCR 检测植物病毒的方法为对照,将建立且优化的微量组织直接RT -PCR 检测方法的敏感性与之进行了比较.虽然微量组织直接RT -PCR反应产生的GLRaV-3 条带相对较弱,但是病毒被检测到的频率在两者之间没有差异,如图4 所示,M为分子标记,P 为阳性对照,N 为阴性对照,泳道1、2 为传统RT -PCR 的检测结果,泳道3、4为微量组织直接RT -PCR 的检测结果.结果表明其足以用于检测葡萄试管苗中的GLRaV-3.
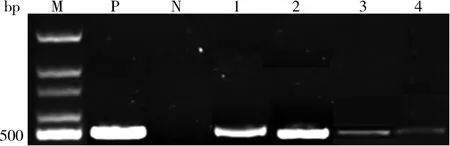
图4 微量组织直接RT-PCR反应与传统的RT-PCR反应在葡萄赤霞珠试管苗茎中检测GLRaV-3 的敏感性比较Fig. 4 Comparison in the sensitivity of detection of GLRaV-3 in stems of in vitro infected stock plantlets of grapevine“Cabernet Sauvignon”between the traditional RT-PCR and microtissue direct RT-PCR
2.3 微量组织直接RT -PCR 反应与传统RT -PCR反应检测ASGV、PLRV和CMV 的敏感性比较本研究把在葡萄试管苗已建立并且优化的微量组织直接RT-PCR检测方法进一步应用于其他3 种病毒的检测,获得了可信度高的检测结果.在检测ASGV 时,虽然微量组织直接RT -PCR 检测到的ASGV特异性DNA 条带(524 bp)比传统RT -PCR检测到的条带较弱,但是其检测到所有感染该病毒样本(样本量为20,百分比为100%)中的病毒条带(表3、图5),说明病毒被检测到的频率在两者之间没有差异.图中,M 为分子标记,P 为阳性对照,N 为阴性对照,泳道1、2 为RT -PCR 检测感染样本,泳道3、4为RT-PCR 检测健康样本,泳道5、6 为MD RT -PCR检测感染样本,泳道7、8 为MD RT-PCR检测健康样本.
图6 中,M 为分子标记,P 为阳性对照,N 为阴性对照,泳道1、2 为RT-PCR检测感染样本,泳道3、4 为MD RT-PCR检测感染样本.

表3 微量组织直接RT-PCR反应和传统RT-PCR反应检测4 种植物病毒的敏感性的比较Tab. 3 Comparison in the sensitivity of virus detection by microtissue direct RT-PCR and the traditional RT-PCR

图5 微量组织直接RT-PCR反应与传统RT-PCR反应在苹果“Gala”试管苗茎中检测ASGV的敏感性比较Fig. 5 Comparison in the sensitivity of detection of ASGV by traditional RT-PCR and microtissue direct RT-PCR in stems of in vitro infected stock plantlets of apple“Gala”

图6 微量组织直接RT-PCR反应与传统RT-PCR反应在马铃薯“紫花白”中检测PLRV的敏感性比较Fig. 6 Comparison of the sensitivity in detection of PLRV by traditional RT-PCR and microtissue direct RT-PCR in stems of in vitro infected stock plantlets of potato“Zihuabai”
图7 中,M 为分子标记,N 为阴性对照,P 为阳性对照,泳道1、2 为RT -PCR 检测感染样本,3、4条带为MD RT-PCR检测感染样本.
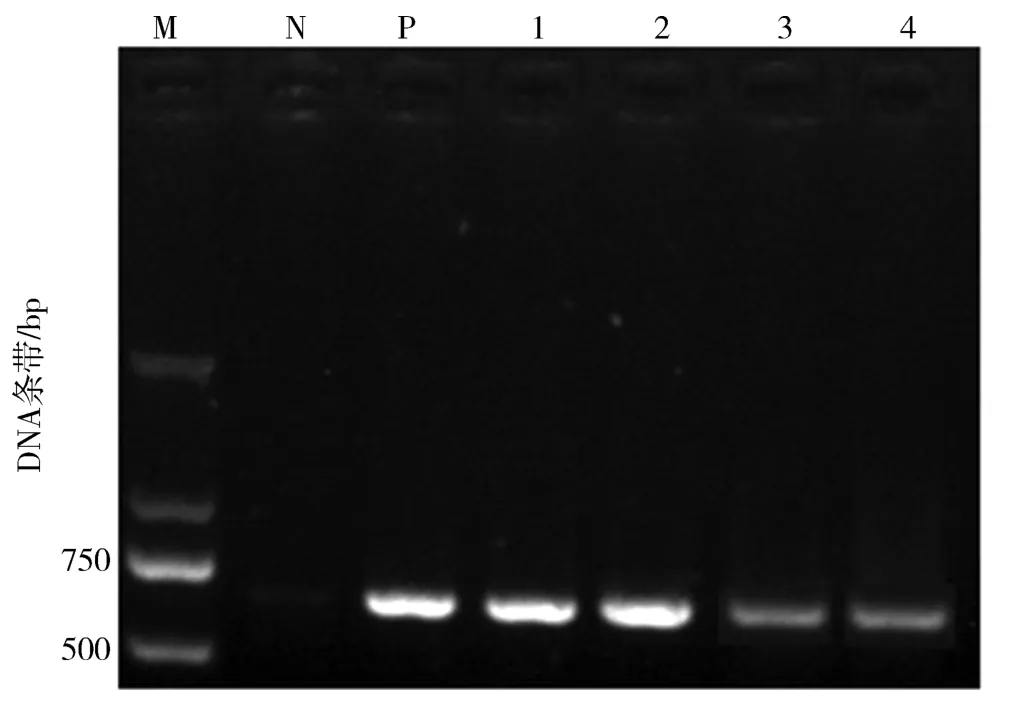
图7 微量组织直接RT-PCR反应与传统RT-PCR反应在百合“Siberia”试管苗茎中检测CMV的敏感性比较Fig. 7 Comparison of the sensitivity in detection of CMV by traditional RT-PCR and microtissue direct RT-PCR in stems of in vitro infected stock plantlets of Lilium Oriental hybrid“Siberia”
在应用微量组织直接RT-PCR检测PLRV(图6)和CMV(图7)时也获得了类似的结果.
根据每种病毒检测实验使用20 个阳性对照样本和20 个阴性对照样本的统计数据显示,与传统RT-PCR相比,4 种植物病毒被微量组织直接RTPCR检测到的频率无明显差异(表3),说明微量组织直接RT-PCR检测方法的敏感性足够用于检测这4 种不同属的植物病毒.
3 讨论
Hosokawa等[19]在使用微量组织直接RT -PCR反应检测CSVd 和CChMVd 时发现无菌注射器针头(25 G)比剃刀更适合于CChMVd的检测.本研究结果发现直径较大(26 G)的针头所制备的RNA模板通过RT-PCR反应检测到病毒的频率高于直径较小(25 和23 G)的针头.植物的茎、叶柄和根都是微量组织直接RT-PCR反应检测病毒的适宜器官.
本研究建立并优化的微量组织直接RT -PCR反应检测植物病毒的方法成功地应用于葡萄、苹果、马铃薯和百合试管苗的病毒检测,有效地检测了GLRaV-3、ASGV、PLRV和CMV.虽然该方法检测的病毒特异性DNA 条带比传统RT -PCR 检测到的条带较弱,但是病毒被检测到的频率在两者之间无明显差异,说明该方法的敏感性足以检测植物病毒.
这是首次基于RT-PCR反应直接利用植物组织液制备RNA模板在4 种试管苗中有效和快速检测4 个不同属植物病毒的方法.该方法消除了RNA模板制备过程中最麻烦的环节(即RNA 提取和纯化),节省了时间,降低了成本.因此,在海关等检疫机构检测植物病毒和无病毒植物组织培养中具有潜在的应用前景.接下来,本研究还会将该方法推广到大田等自然生长的植物的病毒检测中.

