胰腺囊性病变的影像表现与临床特点(下)
徐建国 唐光健 彭泰松 赵丽丽 于萍 任龙飞 许志高
3.4 胰腺导管内乳头状黏液瘤 胰腺导管内乳头状黏液瘤(intraductal papillary mucinous neoplasm,IPMN)实际上并不是囊性肿瘤,由于肿瘤分泌黏液,引起胰腺导管扩张,大体病理与影像表现为伴有囊的病变,故在胰腺囊性病变内一并讨论。
IPMN 是一种少见的胰腺外分泌性肿瘤,起自主胰管或分支胰腺导管上皮,为产黏液的柱状上皮增生向导管内生长,导致受累胰管黏液潴留扩张。20%~30%的肿瘤为多灶性,5%~10%呈弥漫性,确切的发生率不清楚,估计占胰腺囊性肿瘤的20%~50%[65]。根据病变发生的部位,IPMN 可分为3 型:①主胰管型,肿瘤主要分布于主胰管;②分支胰管型,肿瘤位于分支胰管,主胰管没有肿瘤;③混合型,主胰管与分支胰管均有肿瘤[66]。世界卫生组织依据肿瘤的异型性将IPMN 分为低中度异型性、高度异型性(原位癌)及伴有相关侵袭性癌3 类,而恶性IPMN 多见于主胰管,约占IPMN 的70%,分支胰管型仅占25%。组织学上,根据肿瘤上皮的不同结构与细胞学表现分为胃型、肠型、胰胆型与嗜酸细胞型4 种组织学亚型。分支胰管型IPMN 多见于胃上皮亚型,主胰管型IPMN 则多为肠上皮亚型。4 种组织学亚型IPMN 的存活时间明显不同,胃型的预后最好,肠型与胰胆型IPMN 预后差[67]。
IPMN 平均发病年龄为65 岁[68],男女患病比例约为2∶1[69]。大多数病人无症状,多为偶然发现;如有症状可出现复发性非特异性胰腺炎样症状,如腹部不适、腹痛、乏力、恶心呕吐,而体质量减轻、糖尿病及黄疸可见于侵袭性IPMN。实验室检查血液全项、肝功能、血淀粉酶及脂肪酶、CA19-9 与CEA 均在正常范围[70]。
影像检查是IPMN 的重要诊断方法,旨在检出病变,除外其他胰腺囊性病变,鉴别主胰管型IPMN与分支胰管型IPMN,确定恶性IPMN 的危险因素及评估肿瘤的可切除性。传统的内镜逆行性胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)一直是IPMN 的标准诊断方法,其特征影像表现包括:①主胰管型IPMN,胰腺导管弥漫性扩张,伴导管内黏液或乳头状肿瘤形成的充盈缺损;②分支胰管型IPMN,分支胰管囊样扩张,与主胰管交通。ERCP 腔镜下还可观察到增大的十二指肠乳头开口处有黏液凸出,称之为“鱼嘴样乳头”,此为主胰管型IPMN 的典型表现,但仅见于25%~50%的主胰管型IPMN。ERCP 诊断特异性高,但技术操作依赖性高且为微创性,同时由于病变的胰腺导管内充盈黏液后不显影而形成假阴性[71]。CT、MRI 等数字体层成像的空间与密度分辨力较高,已成为诊断胰腺IPMN 的主要手段。主胰管型IPMN 表现为主胰管受累扩张(直径>3 mm),影像表现类似于慢性胰腺炎,主要表现为主胰管全程轻度或明显扩张,相应胰腺实质正常或变薄,管腔内充满低密度或T2高信号黏液;由于黏液富含黏蛋白而阻碍了胰管内胰液的流动,导致胰管弥漫性扩张,但胰管扩张也可能是节段性的。肿瘤表现为扩张导管内的附壁结节,增强扫描后呈轻度强化,但由于肿瘤小而扁平,通常很难观察到(图16);部分病人可显示与主胰管相延续扩大的十二指肠大、小乳头凸入十二指肠肠腔。分支胰管型IPMN 常发生于胰头或钩突(图17),肿瘤可能局限于其中一个分支胰管,也可能累及多个分支胰管;影像表现为单囊,约30%呈多房状囊性病变,边缘呈分叶状,由多个5~20 mm 的囊构成,病灶内可见分隔(图18)及乳头状突起,可呈“葡萄串”状,病变与胰管间可见交通是分支胰管型IPMN 的特异性征象。由于黏蛋白的阻塞,主胰管也可以扩张,但较少见。混合型IPMN 病变范围相对较广,影像表现为主胰管IPMN 与分支胰管IPMN 同时出现,可有多个分支胰管型IPMN 分布于扩张的主胰管周围,与主胰管间可见交通。多层螺旋CT 薄层影像与MR 胆胰管成像原始薄层影像可以显示囊肿与胰管之间的交通[72]。

图16 主胰管型IPMN。病人男,61 岁,腹痛。A 图,胰体水平CT 增强静脉期,显示主胰管全程扩张,呈弥漫性水样密度改变(箭头);B 图,与A 图相同水平MR 抑脂T2WI,显示主胰管扩张,呈T2 高信号,胰腺实质萎缩变薄(箭头);C 图,MR 冠状面T2WI 影像,显示主胰管凸入十二指肠(箭头);D 图,MR 胆胰管成像影像,显示扩张的主胰管全貌(箭头)。
主胰管型IPMN 恶性发生率为70%(57%~92%),而分支胰管型IPMN 恶性率为25%(6%~46%)。主胰管扩张直径为10~18 mm(主胰管型)或囊性肿瘤最大直径为30~40 mm(分支胰管型),壁结节大于10 mm 或伴有胆道扩张提示病变可能为恶性[73]。
超声内镜(EUS)鉴别良、恶性IPMN 的准确度为40%~90%,高于常规超声、ERCP、CT 与MRI。其缺点是操作技术依赖性高,不能区分病变恶性部分与局限性炎症浸润。EUS 引导下细针抽吸(EUSFNA)的囊液黏滞度高,可无细胞或有黏液乳头状细胞[74],CEA 可>192 ng/dL,淀粉酶正常,不能与黏液性囊腺瘤区分,但可以区分黏液与非黏液性囊性肿瘤。
IPMN 治疗采取手术切除还是随访观察的主要依据是病人的临床症状与肿瘤恶性的可能性。所有有症状的IPMN 均应手术切除;无症状时,主胰管型与混合型IPMN、直径>3 cm 的分支胰管型IPMN 均应手术切除;直径<3 cm 的分支胰管型IPMN 同时具有影像上显示壁结节,EUS-FNA 囊液细胞学检查阳性以及随访时肿瘤增大>2 mm/年的高危指征时亦应行手术切除。无高危指征的分支胰管型IPMN 依肿瘤大小来确定随访间隔时间,直径1~2 cm的肿瘤随访间隔6~12 个月,直径>2 cm 时随访间隔3~6 个月[75]。
4 胰腺少见囊性肿瘤
一些胰腺少见的原发肿瘤也可表现为囊性,如淋巴管瘤、胰腺腺泡细胞囊腺癌等。其影像表现多无特异性,且由于预后不同,需与胰腺囊性占位性病变相鉴别。
4.1 胰腺淋巴管瘤 淋巴管血管瘤也称淋巴管瘤,是由于先天性或获得性淋巴引流阻塞引起淋巴管扩张而形成的囊性病变,由不同大小扩张的淋巴管构成,由纤维胶原基质形成薄的分隔。大体病理为柔软的多房囊性肿物,囊内为血清、血浆或淋巴液;镜下囊壁内覆内皮细胞,多呈扁平状,偶可见立方细胞[76-77]。淋巴管瘤多见于颈部与腋窝,其他少见部位包括胸膜、心包、纵隔、腹股沟与骨;淋巴管瘤在腹部少见,可发生于腹膜后(肾周)与肠系膜;原发于胰腺的淋巴管瘤罕见,占全身淋巴管瘤的不足1%[78],约占胰腺肿瘤的0.2%[79],至2015 年,英文文献报道不足60 例[80]。先天性胰腺淋巴管瘤可能与胚胎第2~3 周时背侧十二指肠系膜淋巴管异常发育有关;而获得性胰腺淋巴管瘤的发病原因包括外伤、炎症与手术或放疗,造成淋巴引流障碍,淋巴管进行性扩张而形成囊[81]。
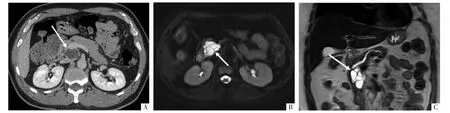

图18 胰腺分支胰管型IPMN。病人男,52 岁,体检超声发现胰头占位。A 图,钩突水平CT 平扫,显示胰腺钩突小水样密度囊,“无壁”,外缘略呈分叶状,囊内可见分隔(箭头);B 图,增强门静脉早期扫描(层厚5 mm),可见分隔与胰腺等强化(箭头);C 图,增强门静脉早期CT 薄层(1.5 mm)重组,沿主胰管曲面多平面重组(MPR)影像,显示略增宽的主胰管(箭头)与钩突囊性病变(未完全展示)间交通。
胰腺淋巴管囊肿病人多无症状,囊肿足够大时可出现腹痛、恶心、呕吐,上腹部可触及肿物,症状与病变位置及大小相关,胰腺囊肿也可合并感染、出血、破裂或小肠梗阻[82]。病变可发生于胰腺任何部位,Albright 等[83]研究29 例胰腺淋巴管囊肿,结果显示12 例发生于胰头,4 例位于胰体,6 例位于胰尾,7 例发生于胰腺颈部或占据全胰腺。
胰腺淋巴管囊肿影像表现无特异性。超声显示病变为无回声的囊,囊内可见多个分隔;CT 表现为均质的水样密度囊性肿物,囊内可见多发纤细分隔,壁薄可有强化,偶见静脉石样钙化;MRI 上病变T1WI 呈低信号、T2WI 呈高信号。鉴别诊断包括胰腺假性囊肿及囊性肿瘤。EUS-FNA 囊液内富含三酰甘油与淋巴细胞[84],故最终诊断需依靠病理。胰腺淋巴管囊肿通过手术完全切除可以达到治愈。
4.2 胰腺腺泡细胞囊腺癌 腺泡细胞是胰腺的主要组织成分,但由腺泡细胞分化而来的胰腺肿瘤相对少见,几乎所有胰腺腺泡细胞肿瘤均为恶性。胰腺腺泡细胞癌占成人胰腺肿瘤的1%~2%,占儿童胰腺肿瘤的15%。肿瘤表现为弥漫性大小不一的囊,囊内壁被覆肿瘤上皮细胞,囊间由薄的纤维组织分隔,大体切面呈海绵样[85]。肿瘤免疫组化显示α1 抗胰凝乳蛋白酶ACP 与α1 胰蛋白酶阳性,提示肿瘤的腺泡细胞特征。Aoto 等[86]报道10 例胰腺腺泡细胞囊腺癌,结果显示肿瘤平均大小为17 cm,3 例位于胰头,1 例发生于胰体,5 例位于胰腺体尾部,5例肿瘤发现时已有肝转移,2 例术中发现腹膜转移。10 例平均生存时间为14.3 个月。肿瘤的影像表现均为个案报道。CT 表现为胰腺软组织密度团块,强化不明显或轻度强化;MRI 显示T2高信号,肿瘤边界清楚,呈蜂窝状。尽管胰腺腺泡细胞囊腺癌罕见,但预后较差,也应与胰腺囊性病变进行鉴别诊断。
4.3 副节瘤 副节瘤起自神经嵴,交感与副交感神经节均可受累,发生于肾上腺髓质时称嗜铬细胞瘤,发生于其他部位称副节瘤[87]。副节瘤发生率约为全球人口的0.8/100 000,美国每年新发病例为500~1 600 例[88]。肿瘤富血供,主要见于颈动脉、颈静脉孔、中耳、主肺动脉区、后纵隔与腹主动脉旁,包括Zuckerkandl 器(主动脉旁体)[89]。约10%的副节瘤为恶性,恶性副节瘤的5 年生存率为50%[90]。胰腺副节瘤罕见,截止到目前文献报道不足35 例[91]。Horton等[92]报道8 例胰腺副节瘤,平均发病年龄67 岁(42~85 岁),7 例为女性,6 例肿瘤位于胰头,2 例位于胰体。肿瘤界限清楚,CT 呈明显强化伴低密度的囊;超声显示低回声肿块伴无回声囊;ERCP 显示主胰管受压移位,与胰腺神经内分泌瘤鉴别困难。有研究[93]显示肿瘤血供来自腹膜,肿瘤实性部分增强静脉期仍呈明显强化可能有鉴别意义。
4.4 血管瘤 成人胰腺血管瘤极罕见,1939—2009 年英文文献报道仅9 例,多为女性,平均年龄55 岁[94],临床可有腹痛。影像表现为胰腺大的囊性病变,CT密度不均匀,MRI 显示多房性T2高信号肿块,囊内可见分隔,无恶性表现。与IPMN、黏液性囊腺瘤、实性假乳头状瘤影像鉴别困难。中年女性胰腺出现大的囊性占位时应与胰腺血管瘤进行鉴别。胰腺血管瘤预后好,手术切除后无复发[95]。
5 小结
胰腺囊性病变种类众多,包括肿瘤性与非肿瘤性病变,良性与恶性病变,处理原则与预后不同,需要术前明确诊断,影像检查在术前诊断中起着重要作用。虽然多数胰腺囊性占位影像表现具有一定特征性,但相当多的胰腺囊性病变没有相对特异性影像表现,尤其是<1 cm 的囊性病变。因此,放射诊断医生除要熟悉常见及部分少见胰腺囊性病变的影像表现外,还应了解食管内超声与经食管内超声细针抽吸胰腺囊液的实验室检查方法、适应证与诊断意义,为临床提供更准确的诊断意见与建议。

