CT 征象对pGGN 样肺腺癌浸润性的诊断价值
余烨 张莹 张凤 傅奕铖 许建荣 吴华伟
随着高分辨力CT 的应用,磨玻璃结节(ground- glass nodule,GGN)的检出率越来越高。GGN 定义为局限性的肺密度增高伴支气管和血管影[1],其中纯磨玻璃结节(pure ground-glass nodule,pGGN)在肺窗表现为局限性淡薄稍高密度影,纵隔窗不显示,其内无实性成分[2],为多种病变的共同影像表现。持续存在的pGGN 病理结果常为不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinoma in situ,AIS)、微浸润腺癌(minimally invasive adenocarcinoma,MIA)、浸润性腺癌(invasive adenocarcinoma,IAC)、局灶性纤维化及机化性肺炎等。文献[3-4]报道,AIS 和MIA 的5 年无病生存率明显高于IAC。所有切除的pGGN 中有30%~50%是IAC[5-7]。尽管临床上有肺腺癌术中冰冻切片病理结果,但评估其浸润性时仍存在与术后病理结果的不一致,因此早期提高IAC 的诊断并在术前鉴别其浸润性尤为重要。既往有运用影像组学鉴别表现为pGGN 肺腺癌的浸润性,但目前不常用[8]。而且,依据CT 征象对表现为pGGN 肺腺癌浸润性进行诊断的研究结果尚无统一标准,且均为小样本分析。因此,本研究通过扩大样本量,探讨CT 征象鉴别pGGN 表现的肺腺癌浸润性及预测浸润性相关因素的能力。
1 资料与方法
1.1 一般资料 回顾性选取2016 年8 月—2019年10 月在上海交通大学医学院附属仁济医院胸部CT 检查表现为单发pGGN 并经病理证实为肺腺癌的病人148 例,其中男33 例、女115 例,年龄24~81岁,平均(56.02±12.72)岁。148 个pGGN 中有5 个AAH,24 个AIS,69 个MIA,50 个IA。所有病人按病理结果分为浸润前组(98 例)和浸润组(50 例)。纳入标准:①受试者有完整的CT 影像资料;②影像质量好,无伪影。排除标准:①病灶最大径≤0.8 cm或≥3.0 cm;②病人接受过化学药物治疗。
1.2 设备与方法 检查设备有美国GE Discovery CT750 HD、GE Discovery CT、GE LightSpeed VCT,德国西门子Somatom Defnition AS,日本东芝Toshiba Aquilion ONE,中国联影uCT760、uCT510 及荷兰飞利浦IQon Spectral CT。检查时病人取仰卧位,双手置于头顶,足先进,扫描范围上至肺尖部水平,下至肋膈角尖端水平。对所有病人进行适当的呼吸训练,各扫描序列均选取深吸气末屏气的平稳状态下完成。常规扫描采用管电压120 kV,管电流120~280 mA,层厚5.0~7.0 mm,层间距5~7 mm,螺距为1.375、0.984,旋转时间0.6 s/r、0.75 s/r。原始图像行1~1.25 mm 薄层后处理重组。平扫影像上观察病灶,肺窗为窗位-600 HU、窗宽1 600 HU(必要时进行手动调节,以显示病灶征象最为清晰),纵隔窗为窗宽350 HU、窗位40 HU,并均行冠状面与矢状面重组以全面显示分析pGGN 病灶各种CT 征象。
1.3 影像及数据分析 由2 名胸部影像诊断医师(分别具有10 年及18 年工作经验)在不知道病理结果的情况下独立阅片,诊断意见不同时经讨论后达成一致。记录病灶位置(右肺上、中、下叶及左肺上、下叶)并观察影像征象,包括分叶征、毛刺征、空泡征、胸膜凹陷征、血管集束征、空气支气管征(包含正常空气支气管征及支气管截断征)(图1)。选取横断面影像上病灶最大层面测量pGGN 的最大径,同时在该层面及其上下2 个连续层面上勾画圆形或类圆形兴趣区(ROI),选取时尽可能包括病灶,同时避开血管、气管、空泡等,计算3 个层面CT 值的平均值,最后取2 名观察者测量结果的平均值。
1.4 统计学方法 采用SPSS 22.0 及MedCalc12.0统计软件进行数据分析。采用Kolmogorov-Smirnov(K-S)检验进行正态性检验,符合正态分布的计量资料用均数±标准差()表示,2 组间比较采用独立样本t 检验;非正态分布的计量资料以中位数(四分位距)[M(P25,P75)]表示,2 组间比较采用Wilcoxon秩和检验。计数资料以例(%)表示,2 组间比较采用χ2检验。对所有单因素分析有统计学意义的CT 征象进行多因素Logistic 回归分析,采用受试者操作特征(ROC)曲线分析CT 征象预测pGGN 浸润性的诊断效能。P<0.05 为差异有统计学意义。
2 结果
2.1 2 组病灶CT 征象比较 浸润组病灶大小、CT值高于浸润前组,浸润组分叶征、血管集束征、空气支气管征的出现率均高于浸润前组(均P<0.05)。2组病灶位置以及毛刺征、空泡征、胸膜凹陷征出现率的差异均无统计学意义(均P>0.05),见表1。
2.2 多因素Logistic 回归分析 病灶CT 值、血管集束征和空气支气管征是表现为pGGN 肺腺癌浸润性的独立预测因子(均P<0.05),见表2。
2.3 ROC 曲线分析 病灶CT 征象鉴别pGGN 浸润性的诊断效能见表3,其ROC 曲线见图2。病灶CT 值、血管集束征和空气支气管征三者联合诊断的AUC(95%CI)[0.814(0.741~0.873)]和敏感度(90.0%)最高,特异度(59.18%)最低。
3 讨论
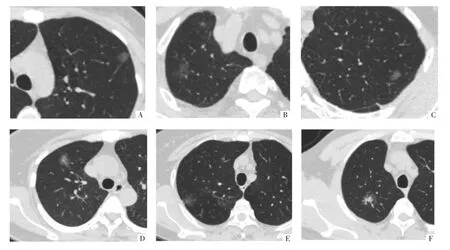
图1 表现为pGGN 肺腺癌的CT 征象。A 图,病人女,39 岁,横断面平扫,左肺上叶pGGN,可见血管穿行,病理诊断AIS。B 图,病人男,80 岁,横断面平扫,右肺上叶pGGN,可见小空泡,病理诊断IAC。C 图,病人女,56 岁,横断面增强扫描,左肺上叶pGGN,可见浅分叶征,病理诊断AIS。D 图,病人女,56 岁,横断面增强扫描,右肺上叶pGGN,可见浅分叶征,病理诊断IAC。E图,病人女,64 岁,横断面平扫,右肺上叶pGGN,可见胸膜凹陷征,病理诊断IAC。F 图,病人男,51 岁,横断面增强扫描,右肺上叶pGGN,可见血管集束征,病理诊断IAC。
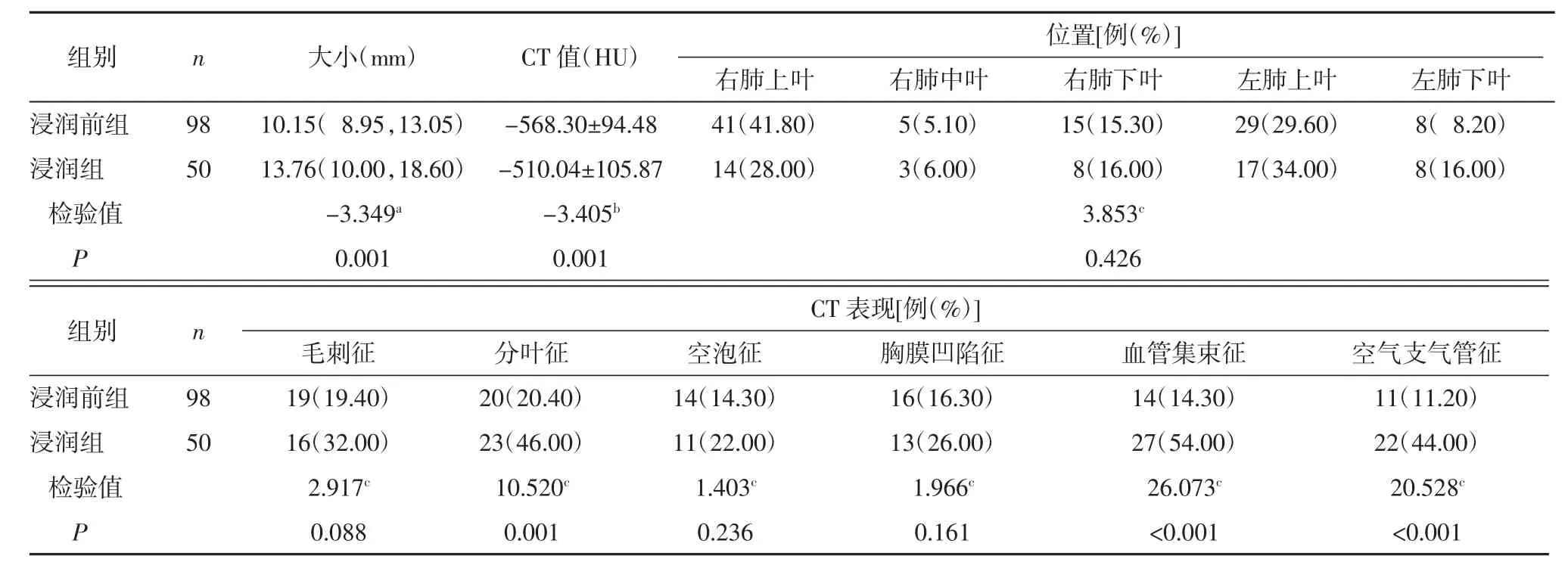
表1 2 组病灶CT 征象比较

表2 浸润组病灶CT 征象的多因素Logistic 回归分析
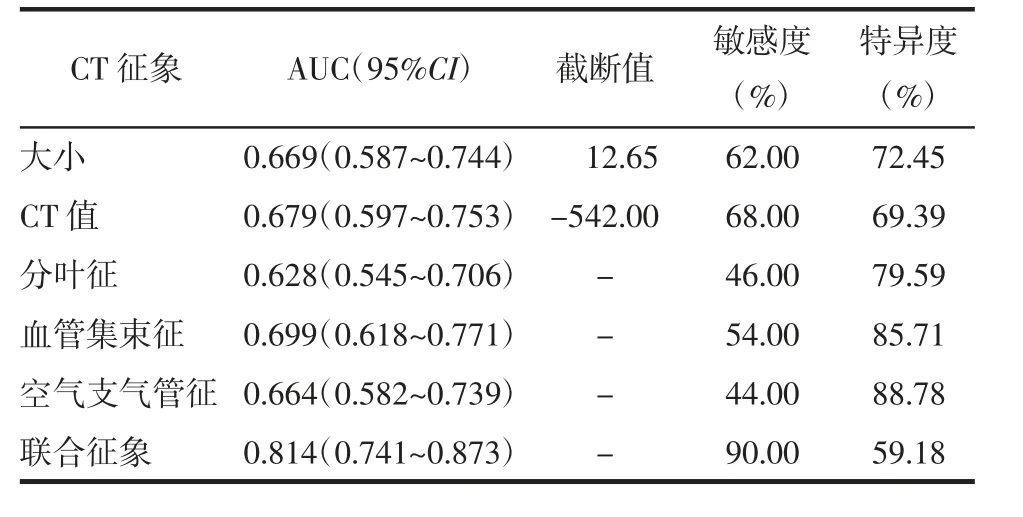
表3 病灶CT 征象鉴别pGGN 浸润性的诊断效能

图2 病灶CT 征象鉴别pGGN 浸润性的ROC 曲线
近年来随着CT 检查的普及,CT 影像上pGGN的检出率逐年增加。AAH、AIS 和MIA 5 年无病生存率达100%,临床一般采用楔形切除或段切除术,而IAC 的5 年无病生存率为49%~84%,常采用积极的手术如肺叶切除,这种手术方法使病人肺功能受损、住院时间延长、围手术期的发病率和死亡率也较高,虽然临床上有术前冰冻病理结果,但仍存在冰冻结果与最终病理结果评价浸润性不一致的情况,因此术前鉴别表现为pGGN 肺腺癌的浸润性尤为重要。本研究通过增加样本量,进一步分析CT 征象对表现为pGGN 肺腺癌浸润性的鉴别作用。
本研究中浸润组分叶征、血管集束征、空气支气管征的出现率均高于浸润前组。分叶征是指病灶表面凹凸不平呈多个弧形的轮廓,病理基础是由于肿瘤细胞向各个方向生长的速度不均衡或受肺支架结构的限制所致。本研究结果表明分叶征可用来鉴别表现为pGGN 肺腺癌的浸润性。Fan 等[9]结合影像组学特征与病灶形态学特征对表现为pGGN 肺腺癌的浸润性进行鉴别的结果表明分叶征是肺腺癌浸润性的独立预测因子,但本研究多因素Logistic回归分析表明,分叶征不是表现为pGGN 肺腺癌浸润性的独立预测因子。血管集束征指病灶周围的血管束向病灶集中或直接与病灶相连,病理基础为肿瘤细胞增殖破坏致使肺支架结构塌陷皱缩,造成对周围血管的牵拉或肿瘤细胞包绕穿过的血管,CT 上表现为一支或数支肺小血管受牵拉向病灶聚拢移位,在病灶处中断或贯穿病灶。本研究中血管集束征更易发生在浸润组,一方面表明浸润性病变存在更多的肿瘤细胞增殖及浸润,另一方面血管向病灶聚集也表明pGGN 可能存在血供,而Liu 等[10]通过比较GGN 的碘含量与同侧、对侧正常肺组织的碘含量发现,GGN 的碘含量明显高于正常肺组织的碘含量,表明GGN 存在血供。本研究结果显示,血管集束征也是表现为pGGN 肺腺癌浸润性的独立预测因子,因为浸润性越高,对周围血管牵拉能力越强,越容易出现血管集束征。空气支气管征指病灶内细条状、直径约1 mm 的空气密度影或见于连续数个相邻层面上的小泡状影,病理基础是扩张的细支气管。既往研究[11-13]显示空气支气管征不能作为诊断pGGN 肺腺癌浸润性的参数,Jin 等[6]研究表明空气支气管征与pGGN 病理组织学浸润性密切相关,Dai 等[14]通过对84 个pGGN 的随访观察发现,空气支气管征是肺pGGN 恶变的潜在危险因素之一,因此空气支气管征在鉴别pGGN 时尚存在争议,而本研究中空气支气管征在浸润组中多见且是pGGN肺腺癌浸润性的独立预测因子。
本研究中浸润组病灶大小、CT 值高于浸润前组,当病灶大小>12.65 mm 时,鉴别pGGN 表现的肺腺癌浸润性的AUC 为0.669,该结果与Zhang 等[15]研究结果相似(≥12.2 mm),但病灶大小不是pGGN肺腺癌浸润性的独立预测因子。当病灶CT 值>-542.00 HU 时,其鉴别表现为pGGN 肺腺癌浸润性的AUC 达0.679,罗等[16]研究显示,CT 值为-534.05 HU是表现为pGGN 肺腺癌浸润性的最佳截断值(敏感度80.00%,特异度84.00%),与本研究结果相仿。Zhan 等[17]研究显示,CT 值>-449.52 HU 是GGN 表现的肺腺癌浸润性的最佳截断值,该研究纳入的病灶大小为5~10 mm 且包括混合GGN,与本组病例纳入标准不同,但结果也显示浸润组GGN 的密度高于浸润前组,即随着浸润性的增高,GGN 的密度也增高。因为在GGN 中肿瘤细胞多呈贴壁生长,随着肿瘤细胞增多及浸润性增多,可取代正常肺组织使肺泡间隔增厚、肺泡萎陷、肺泡腔内气体减少,从而在CT 上显示密度增高。回归分析显示病灶CT 值是pGGN 表现的肺腺癌浸润性的独立预测因子,CT值越大,浸润性病变可能性越大。本组病例中女性病人较多(约占77.70%),以往文献[18]也报道pGGN更易出现在女性病人中,因此当女性病人合并肺GGN 时应警惕。本研究结果显示浸润组与浸润前组的结节位置差异无统计学意义,但2017 年Fleischner 协会指南指出当肺GGN 位于上叶时恶性可能性更大[19],因此当结节位于肺上叶时也应警惕。
本研究显示浸润组与浸润前组毛刺征、空泡征、胸膜凹陷征出现率的差异均无统计学意义。毛刺征指病灶边缘向周围放射状伸展的、无分支的直细短线影,其病理基础是肿瘤细胞向邻近支气管血管鞘及局部淋巴管的浸润,而周等[20]研究表明毛刺征可鉴别pGGN 表现的肺腺癌浸润性。空泡征指病灶内圆形或小条状的小灶性透光区(直径<5 mm,通常2~3 mm),单发或多发。Wu 等[21]通过对<10 mm pGGN 表现的肺腺癌的浸润性研究显示,空泡征在鉴别表现为pGGN 肺腺癌浸润性中差异无统计学意义,这与本研究结果相同。而Yue 等[22]研究显示空泡征对于pGGN 肺腺癌的浸润性具有鉴别意义,但不是浸润性的独立预测因子,由于该研究中纳入的IAC 病例几乎都是混合GGN,因此可能空泡征对于鉴别那些混合GGN 肺腺癌的浸润性具有一定意义。胸膜凹陷征指病灶与胸膜之间的线形或幕状阴影,也可为星状阴影,有研究[11]表明胸膜凹陷征可以用来鉴别pGGN 肺腺癌的浸润性,而且该征象更容易出现在IAC 中,而本研究中浸润组与浸润前组胸膜凹陷征出现率的差异无统计学意义,这可能与纳入的病例数及结节所在位置有关,靠近胸膜的病灶出现的概率可能更高。本研究发现病灶CT 值、血管集束征和空气支气管征是pGGN 表现的肺腺癌浸润性的独立预测因子,当病灶CT 值高于-542 HU且有血管集束征和空气支气管征时,诊断IAC 的效能明显提高。既往相关研究[16,20]尽管得出了鉴别诊断参数,但未做联合诊断的效能分析。本研究中的联合征象虽然诊断的特异度低,但高敏感度有利于检出IAC,便于临床进行积极的干预。
本研究存在一定局限性:①IAC 的病例相对较少,这可能与pGGN 的生长过程有关,因为pGGN生长缓慢,从AAH 进展到IAC 需很长时间;另一方面因为一部分病例可能在浸润前就已行手术切除,因此浸润性病变相对较少。②对CT 征象的观察记录主要依靠主观判断,可能受主观感受和经验影响而产生一定偏倚。③纳入的病例影像来源于多种CT设备,不同设备间的扫描方式不尽相同,可能会影响CT 征象的显示。④纳入的病例均为单发病灶的病例,临床中也存在多发病灶的病例,但完全进行手术切除的病例较少,今后可以继续收集相应病例,进行多发病灶的特点研究。
综上所述,本研究通过大量的病例进一步分析了CT 征象在鉴别pGGN 表现的肺腺癌浸润性的诊断效能,发现病灶CT 值、血管集束征和空气支气管征是其独立预测因子,三者联合诊断能明显提高其鉴别诊断效能,从而为临床决策提供更多信息。

