银杏酸毒副作用及朴树提取物对其减毒效果研究
房仙颖, 谢莹莹, 章祎唯, 曹福亮, 赵林果,*
(1.南京林业大学 化学工程学院,江苏 南京 210037; 2.南京林业大学南方现代林业协同创新中心,江苏 南京 210037)
银杏叶富含黄酮类化合物、萜内酯类化合物、聚戊烯醇等活性物质,可用作保健食品的原料,为充分发挥银杏叶的保健功效并让消费者更方便地食用,一些厂家将银杏叶制成银杏茶、饲料添加剂等产品[1],银杏叶提取物(EGB)的系列银杏制剂成为了当今开发最成功的植物药之一[2-3]。但银杏叶中除含有系列活性成分以外,还含有一定量的具有毒副作用的银杏酸。银杏酸为烃基取代水杨酸衍生物,根据取代烃基的长度及饱和度差异,银杏酸单体可分别命名为C13∶0、C15∶1和C17∶1等[4]。银杏酸可引起严重的炎症反应,并表现在肝损伤和致敏等方面[5-6]。所以,在国内外的EGB质量标准中,主要质控指标除规定了活性成分的含量外,还对银杏叶中银杏酸的含量进行了严格的限制[7]。2015版《中国药典》对银杏叶提取物中总银杏酸的要求是不得超过10 mg/kg。因此,在制备EGB的过程中,需要通过分离、纯化等工艺将产品中残留的银杏酸控制在质量标准范围内[8],但这些方法难以应用到银杏茶、白果[9]等银杏制品的加工工艺中,需要研发其他方法保证其食用的安全性。我国传统中药朴树可用于治疗漆酚导致的“漆疮”[10],而漆酚与银杏酸不仅结构非常相似,而且两者产生的副作用也很类似。漆酚导致的过敏属于胸腺依赖淋巴细胞(T细胞)介导的迟发型超敏反应[11],银杏酸接触皮肤后亦可导致变应原致敏性变态反应、CD4+T细胞的表达增加[12-13]。如果从朴树中寻找到某类或某些物质能够减轻肝损伤和抑制T细胞介导的炎症反应,则有望用于减轻银杏酸导致的毒副作用。本实验室前期研究表明,朴树叶中含有芦丁、异牡荆素、牡荆素和异荭草素等黄酮类物质,其中异牡荆素的含量最高,在碳苷黄酮中抗炎活性最好[14]。但朴树叶中其它成分,朴树枝、皮中有关组分是否能对银杏酸具有减毒作用,具有减毒效果的组分中具体成分是什么等系列问题仍需开展大量的深入研究。为此,本研究对银杏酸的潜在毒副作用展开了探索,对朴树叶、枝和皮中活性成分进行了提取和分离,比较了这些组分对银杏酸的减毒作用,筛选出能够减弱银杏酸的肝细胞毒性和抑制T细胞介导的炎症反应的活性组分,以期为进一步研究获得对银杏酸具有减毒作用的具体成分(或系列成分)及其作用机制提供基础数据。
1 材料与方法
1.1 材料、试剂与仪器
朴树(CeltissinensisPers.)树叶、树枝和树皮为2016年从贵州贵阳花溪区采摘,经南京林业大学国际品种登记中心鉴定为野生品种。银杏酸单体C13∶0、C15∶1、C17∶1和总银杏酸,南京景竹公司。
0.01 mol/L磷酸盐缓冲溶液(PBS),pH值7.2;二甲亚砜(DMSO);2,4-二硝基氯苯(DNCB);甲醇、乙酸乙酯、二氯甲烷和正丁醇等,均为市售分析纯。弗氏完全佐剂(FCA)、噻唑蓝(MTT), 美国Sigma公司;锥虫蓝,上海阿拉丁试剂公司;DMEM高糖培养基、RPMI 1640培养基,美国Gibco公司;胎牛血清(FBS), 美国Hyclone公司;胰酶消化液,上海碧云天生物技术公司;人肝癌细胞HepG2,购于中国科学院典型培养物保藏委员会细胞库。清洁级Balb/c小鼠,雌性,6周龄,体质量(20±2)g,由扬州大学比较医学中心提供。
Agilent 1260高效液相色谱(HPLC)仪,安捷伦XDB-C18色谱柱(250 mm×4.6 mm,5 μm),美国安捷伦公司;SpectraMax190酶标仪,美国Molecular Devices公司;KH3200B型超声波清洗器,昆山禾创超声仪器有限公司。
1.2 银杏酸的毒副作用
1.2.1MTT法检测HepG2细胞增殖 在96孔板中每孔接种4×103个HepG2细胞,100 μL DMEM完全培养基,置于37 ℃培养(5% CO2),待细胞贴壁6 h后,每孔加不同浓度药物(银杏酸)100 μL再培养72 h,空白对照组不加药仅补加100 μL培养基。终止培养前加入20 μL质量浓度4 g/L的MTT溶液,4 h 后吸去上清液,每孔加入200 μL DMSO,振荡,540 nm处检测吸光度,并记录读数,以细胞存活率为标准判断药物对HepG2细胞增殖的影响。银杏酸单体C13∶0、C15∶1和C17∶1的配制方法为:先用DMSO将各化合物溶解为100 mmol/L的储备液,然后再用DMEM完全培养基将储备液梯度稀释为200、 20、 2 μmol/L,加药后对应细胞培养孔中的药物终浓度分别为100、 10、 1 μmol/L。
1.2.2小鼠腘窝淋巴结模型 将小鼠随机分成2组,每组8只。分为假手术对照(Sham.)组、银杏酸皮下注射(S.c.)组,在(21±2) ℃、自由取食、自由饮水和12 h昼夜交替的条件下饲养。动物的实验操作严格遵照《关于善待实验动物的指导性意见》,实验过程中所有的操作,均尽可能减轻动物的痛苦、损伤和使用数量。
两组分别在小鼠右下足垫进行皮下注射,以此起点(D0)计算给药时间。银杏酸组给以50 g/L的总银杏酸/PBS溶液20 μL,对照组给以等体积溶剂。给药7天(D7)后,以颈椎脱臼法处死小鼠,迅速取出注射近端的腘窝淋巴结(PLN),去除脂肪组织,立刻称质量。
1.2.3小鼠接触性皮炎模型 将小鼠参照1.2.2节分为Sham.组和银杏酸S.c.组。
参考文献[13]对小鼠进行致敏实验。将0.15 mg总银杏酸溶于300 μL溶剂PBS/FCA混合液(体积比1 ∶1),超声波乳化,银杏酸组分别在起始日、给药第7天和给药第14天采用背部三点注射法给每只小鼠注射300 μL总银杏酸溶液,对照组采用同样的方法注射等量溶剂。
参考文献[13]对小鼠进行激发引起过敏反应实验。银杏酸组于最后一次致敏后的第7日,即D21,在小鼠右耳耳廓内外两侧涂3%总银杏酸的丙酮溶液,施药量50 μL/只,进行攻击,对照组涂等量溶剂。攻击24 h后,用螺旋测微仪量小鼠左右耳厚,根据右耳减去左耳的厚度差判断小鼠的皮炎程度。以颈椎脱臼法处死小鼠,迅速取出脾脏,立刻称质量。
1.3 朴树提取物的制备
1.3.1朴树叶提取物 将朴树叶进行除尘、晾干并烘干后,置于粉碎机中进行粉碎,粉碎成0.38 mm。向100 g朴树叶粉末中加入100 mL乙醇,静置过夜,次日按料液比 1 ∶4(g ∶mL)补加70%乙醇,于50 ℃回流提取3次,每次提取2 h。合并提取液经旋转蒸发除去乙醇,用体积比1 ∶1的二氯甲烷萃取3次,得到二氯甲烷萃取组分(CH2Cl2);然后,水溶液用乙酸乙酯萃取3次,得到乙酸乙酯萃取组分(EA);最后,水溶液用正丁醇萃取3次,得到正丁醇萃取组分(BA);剩下的为水溶性组分(Water)。
1.3.2朴树枝提取物 按朴树叶处理方法处理朴树枝,称朴树枝粉末质量,共3份,每份100 g,分别用30%、60%和90%的乙醇提取,料液比为 1 ∶20,回流提取4 h,过滤,得提取液。浓缩蒸至无醇味,将所得水溶液用20% HCl调至pH 值3~4,得到的溶液用等体积石油醚萃取,然后用20% NaOH将溶液调至pH值9.2,再用等体积二氯甲烷萃取。通过上述提取,共收集、干燥得到10个组分(Fr.1#~10#)。其中,预实验组30%乙醇提取液不经浓缩至无醇,后续按上述流程操作收集得到的CH2Cl2萃取物记为样品1#;30%乙醇提取按上述流程收集经CH2Cl2萃取后的上层水溶性成分记为样品3#;30%乙醇提取按上述流程收集得到的CH2Cl2萃取物记为样品5#;60%乙醇提取按上述流程收集经CH2Cl2萃取后的上层水溶性成分记为样品4#;60%乙醇提取按上述流程经CH2Cl2萃取后收集中间乳化层样品记为样品6#;60%乙醇提取按上述流程收集得到的CH2Cl2萃取物记为样品7#;90%乙醇提取按上述流程加NaOH后收集得到的沉淀物记为样品2#;90%乙醇提取按上述流程收集得到的CH2Cl2萃取物记为样品8#;90%乙醇提取按上述流程经CH2Cl2萃取后收集中间乳化层样品记为样品9#;90%乙醇提取按上述流程收集经CH2Cl2萃取后上层水溶性成分记为样品10#。
1.3.3朴树皮提取物的制备 按朴树叶处理方法处理朴树皮,称朴树皮粉末质量,用70%的乙醇按料液比为1 ∶20热回流提取4 h,过滤,得提取液。浓缩蒸至无醇味,将所得水溶液用20% HCl调至pH值3~4,得到的溶液用等体积石油醚萃取,然后用20% NaOH将溶液调至pH值9.2,再用等体积CH2Cl2萃取。共收集、干燥得到6个组分(Fr.11#~16#):按上述流程加NaOH后收集得到的沉淀物记为样品11#;石油醚萃取物记为样品12#;石油醚萃取后收集中间乳化层样品记为样品13#;CH2Cl2萃取后收集上层水溶性成分记为样品14#;CH2Cl2萃取后收集中间乳化层样品记为样品15#;收集CH2Cl2萃取物记为样品16#。
1.4 朴树提取物生物活性研究
1.4.1减毒效果研究 在朴树提取物的肝细胞减毒作用实验中,基本步骤同1.2.1节,细胞种板和加药方式调整如下:在96孔板中每孔接种4×103个HepG2细胞50 μL,待细胞贴壁6 h后先在每孔加入400 μmol/L的银杏酸单体50 μL溶液(最终200 μL体系中银杏酸的浓度为100 μmol/L),对照孔加50 μL 培养基;将朴树提取物用DMSO配制成100 g/L的储备液,然后用DMEM完全培养基将储备液梯度稀释为200、 20、 2 mg/L,向已加入银杏酸的孔中分别加入100 μL不同浓度的朴树提取物溶液,加药后对应细胞培养孔中的朴树提取物终浓度分别为100、 10、 1 mg/L,对照孔加入100 μL培养基;培养72 h 后按前面所述方法加入MTT并检测吸光度。
1.4.2朴树成分体外抗炎活性测定 取健康小鼠经断颈法处死,无菌摘取腋下、腹股沟和肠系膜等处的淋巴结,将淋巴结放入加有1 mL RPMI 1640完全培养基的60 mm培养皿中;用研棒研磨淋巴结释放出淋巴细胞,向培养皿中加入3 mL培养基,用枪头轻吹30~40次获得单细胞悬液;细胞悬液过筛网,收集过筛后的细胞悬液,3 000 r/min离心5 min,弃上清,获得T淋巴细胞。在96孔板中每孔5×105个T细胞,50 μL RPMI 1640完全培养基,置于37 ℃培养(5% CO2),随后每孔加入5 mg/L、50 μL 伴刀豆球蛋白A(Con A)溶液,对照孔补加50 μL培养基;将朴树提取物配置成所需浓度,向Con A活化的T细胞各孔分别加入不同浓度的朴树提取物 100 μL,对照孔补加100 μL培养基。培养箱培养48 h后,加入20 μL MTT(4 g/L)溶液。4 h后吸去上清,每孔加入200 μL DMSO,振荡,540 nm处检测吸光度,并记录读数。以细胞存活率为标准判断提取物对活化T细胞增殖的影响。
1.5 朴树成分分析
1.5.1总黄酮的提取和测定方法 参考文献[15]进行测定。取朴树叶粉末适量浸泡在70%的乙醇中,静置过夜,次日于50 ℃水浴热回流提取2 h,提取4次,合并4次提取液,即得总黄酮提取液,冷却备用。采用铝盐显色法进行定性分析,将提取液与5%三氯化铝溶液反应,生成黄色络合物(λmax=415 nm),并有荧光。采用芦丁法定量分析。
1.5.2生物碱的提取和鉴定 参考文献[16]进行测定。称取朴树叶粉末适量,用70%乙醇于50 ℃水浴热回流提取2 h,提取4次,合并4次提取液,加入5%的浓盐酸溶液,摇匀,充分反应,于4 000 r/min离心5 min,弃沉淀。取上清液用等体积二氯甲烷萃取3次,取水相,加氨水中和至 pH≥8.5,然后用等体积氯仿萃取3次,收集氯仿相,最后用旋转蒸发仪浓缩蒸干,得到总生物碱备用。用碘化铋钾沉淀显色法进行定性分析,称取7.3 g碘化铋钾,冰醋酸10 mL,加蒸馏水60 mL,充分搅拌溶解,冷藏保存备用。以碘化铋钾为沉淀试剂,生成橘红色或者红色沉淀,呈现阴性反应。
1.5.3皂苷的提取和测定 参考文献[17~18]进行测定。称取朴树叶粉末适量,加入50 mL乙醇,于50 ℃超声波提取50 min,过滤,将提取液定容至50 mL。分别用醋酐-浓硫酸(Liebermann-Burchard)法和沙尔科夫斯基(Salkowski)法定性分析,齐墩果酸法定量分析。
1.6 细胞存活率的计算
细胞存活率(η)按以下公式计算:
2 结果与分析
2.1 银杏酸对HepG2细胞的毒性
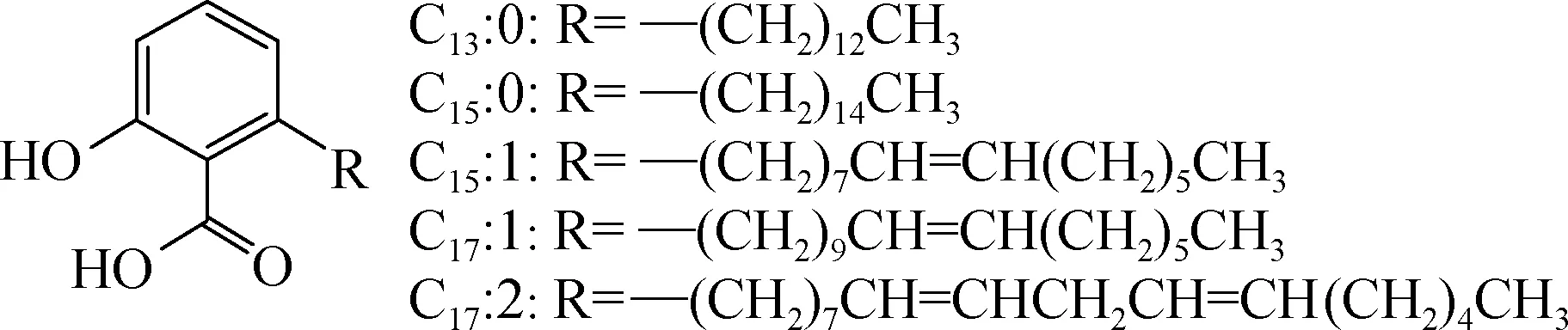
图1 银杏酸的化学结构Fig.1 Chemical structure of the ginkgolic acids
银杏叶中除了银杏黄酮和银杏内酯等活性物质[19],还含有银杏酸,银杏酸一般有C13∶0、C15∶0、C15∶1、C17∶1和C17∶2,结构如图1所示,其中以C13∶0、C15∶1和C17∶1 的含量最丰富[4]。
银杏类产品被报道的副作用主要为肝损伤和过敏反应,肝癌细胞HepG2是一种表型与肝细胞极为类似的细胞株,常被用作肝代谢、细胞毒分析等肝细胞功能研究的工具细胞[20]。因此,首先考察了银杏酸对HepG2肝癌细胞增殖的影响。实验结果表明:总银杏酸在100 mg/L的质量浓度下对HepG2细胞的体外增殖抑制作用高达90.08%;其中主要的细胞毒性成分可能为银杏酸C13∶0和C15∶1,银杏酸 C17∶1对HepG2细胞的增殖影响较小(表1)。
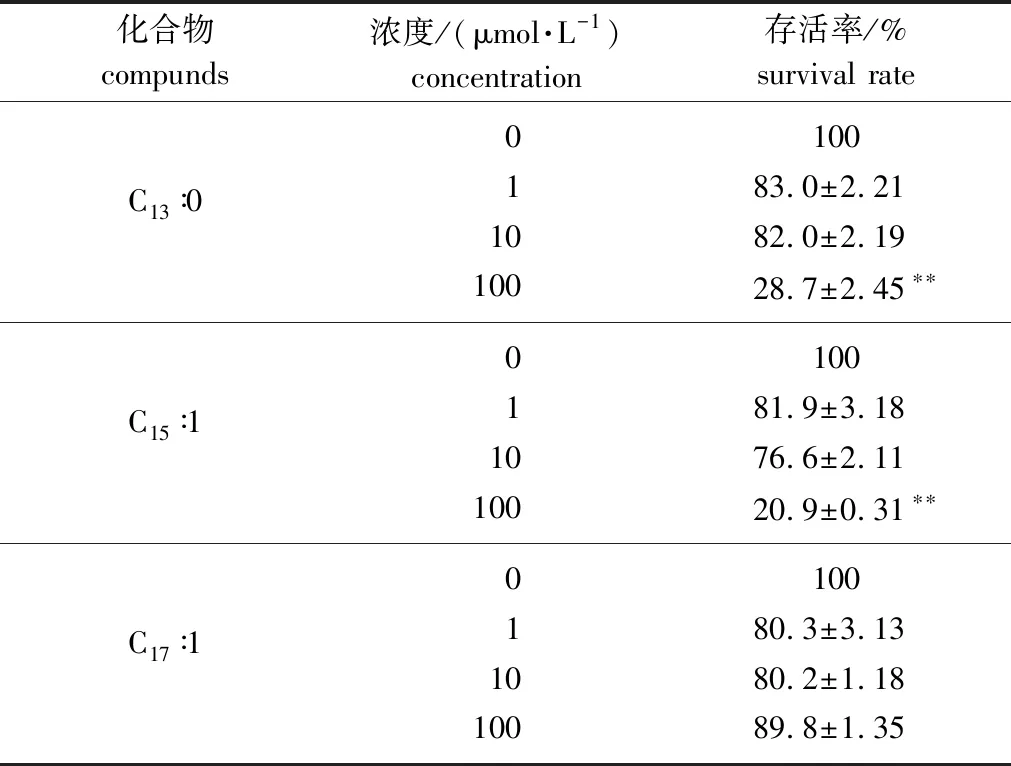
表1 银杏酸单体对HepG2细胞的毒性
2.2 银杏酸对免疫系统的影响
2.2.1小鼠腘窝淋巴结实验 过敏反应的本质为炎症,炎症的发生与淋巴细胞的活化和过度增殖密切相关,淋巴细胞过度增殖就会导致淋巴器官肿大[21]。将总银杏酸注射到小鼠足垫,7天后取足垫附近的腘窝淋巴结观察,发现银杏酸可导致淋巴结肿大。由表2可见,与注射等体积溶剂的对照组比较,注射了银杏酸的实验组小鼠的腘窝淋巴结质量显著升高;摘取淋巴结,分离淋巴细胞并计数,发现注射银杏酸可导致淋巴结中淋巴细胞数目显著增多。
2.2.2接触性过敏反应 采用小鼠耳肿胀模型,考察银杏酸能否导致小鼠接触性皮炎。先通过背部多点注射银杏酸的方式诱导,7天后将银杏酸涂耳朵攻击,于攻击24 h后量小鼠耳厚。表2结果表明银杏酸可导致小鼠耳肿胀;取小鼠脾脏称质量并拍照,结果如表2和图2所示,表明小鼠接触银杏酸后可导致脾脏质量增加并肿大。

表2 银杏酸对小鼠免疫系统的影响

图2 银杏酸对小鼠脾脏大小的影响Fig.2 Effect of ginkgolic acids on the spleen size
综上所述,银杏酸会对免疫系统产生刺激,引起炎症细胞过度增殖,导致外周免疫器官——淋巴结和脾脏的肿大,并在接触部位表现出炎症反应。
2.3 朴树提取物的肝细胞减毒作用
大量研究表明,朴树中含有黄酮类、皂苷、生物碱等成分[9]。因此,本研究分别按照黄酮类、皂苷和生物碱的提取方法对朴树叶、枝和皮中的化学成分进行提取和分离[15-18]。通过颜色反应,鉴定发现朴树叶中含有黄酮类、皂苷类成分,朴树皮和枝中含有生物碱类成分;用芦丁法计算得到,朴树叶中总黄酮质量分数约为10.76%;用齐墩果酸法计算得到,朴树叶中总三萜质量分数为2.38%。
从朴树叶、枝和皮提取、分离得到的各组分对HepG2细胞的减毒作用见表3。表3结果显示,HepG2细胞与100 μmol/L的银杏酸C13∶0共培养72 h后存活率仅有23.4%,与100 μmol/L的银杏酸C15∶1共培养72 h后存活率仅有26.7%,表明HepG2细胞增殖被显著抑制;将100 mg/L朴树叶的BA相、100 mg/L Water相、100 mg/L朴树枝2#、1 mg/L 6#和1 mg/L朴树皮的14#提取物加入培养体系后,可以将银杏酸C13∶0损伤的HepG2细胞存活率分别提高到28.8%、30.2%、63.0%、29.1%和33.0%,显著减轻了银杏酸C13∶0对HepG2 肝细胞增殖的抑制作用;将100 mg/L朴树叶的BA相、100 mg/L Water相、1 mg/L朴树枝的2#、100 mg/L 10#和100 mg/L朴树皮的14#提取物加入培养体系后,可以将银杏酸C15∶1损伤的HepG2细胞存活率分别提高到32.5%、35.5%、58.4%、56.9%和34.8%,显著减轻了银杏酸C15∶1对HepG2肝细胞增殖的抑制作用。同时,提取物的绝大多数虽然在本实验体系中未表现出对肝细胞损伤的减缓作用,但也并不会加重肝细胞损伤,提示朴树成分对肝细胞的安全性。
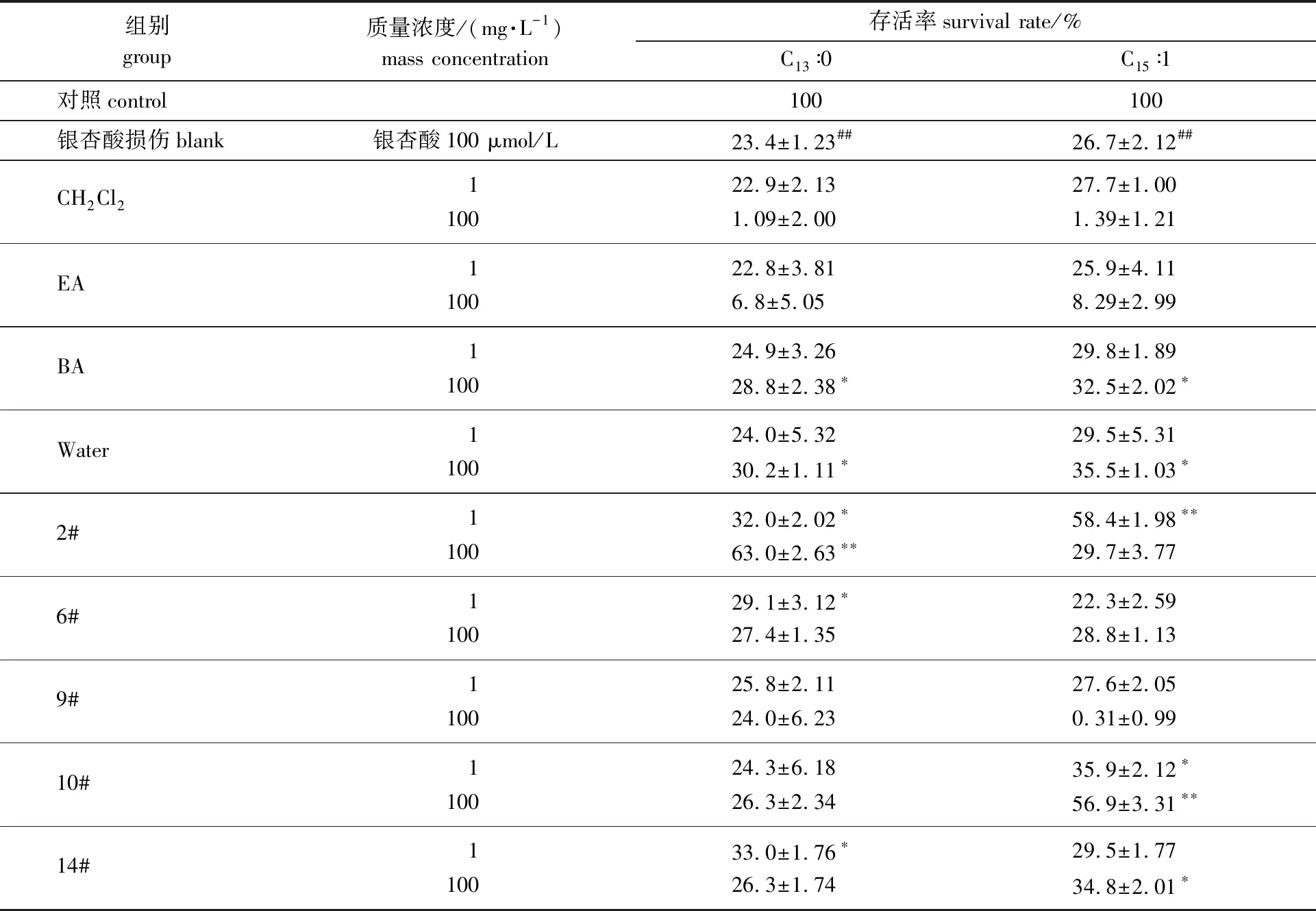
表3 朴树提取物对银杏酸导致的HepG2细胞毒的抑制作用
2.4 朴树提取物的抗炎活性
有研究表明,银杏酸导致的过敏反应与T细胞的过度活化相关[22],Con A诱导的T细胞活化增殖模型常用于体外抗炎药物的筛选[23]。将Con A活化48 h后T细胞存活率计为100%,表4结果显示,添加100 mg/L朴树枝的3#、4#、8#和朴树皮的13#、16#提取物后,Con A活化的T细胞存活率可分别降低至6.76%、6.80%、4.58%、56.9%和5.30%,表明朴树提取物对炎症性T细胞增殖有显著的抑制作用。其中,以8#和16#的抑制作用最好,在100 mg/L的浓度下对ConA活化的T细胞增殖的抑制率分别可达95.4%和94.7%,且呈现剂量依赖性,说明朴树中存在抗炎活性物质,有望用于抗银杏酸过敏的治疗。
2.5 讨 论
银杏叶富含黄酮类、内酯等活性成分,以及蛋白质、维生素、矿物质等多种营养物质,是极佳的保健食品原料。但以叶为原料直接制成的产品不同于银杏叶提取物制品,目前尚不能有效控制其中有毒成分(银杏酸)的含量;针对银杏酸导致的毒副作用,目前也缺乏针对性的治疗手段。所以,以“中药配伍、减毒增效”的理念提升银杏叶制品质量和保障银杏叶制品使用安全意义重大。下一步将深入研究朴树提取物各组分中对银杏酸具有减毒作用的具体成分(或系列成分)及其作用机制、适宜用量。研究结果将有助于解决银杏叶制品中因难以脱除银杏酸带来的毒副作用问题,为高品质的相关产品的开发利用奠定基础。
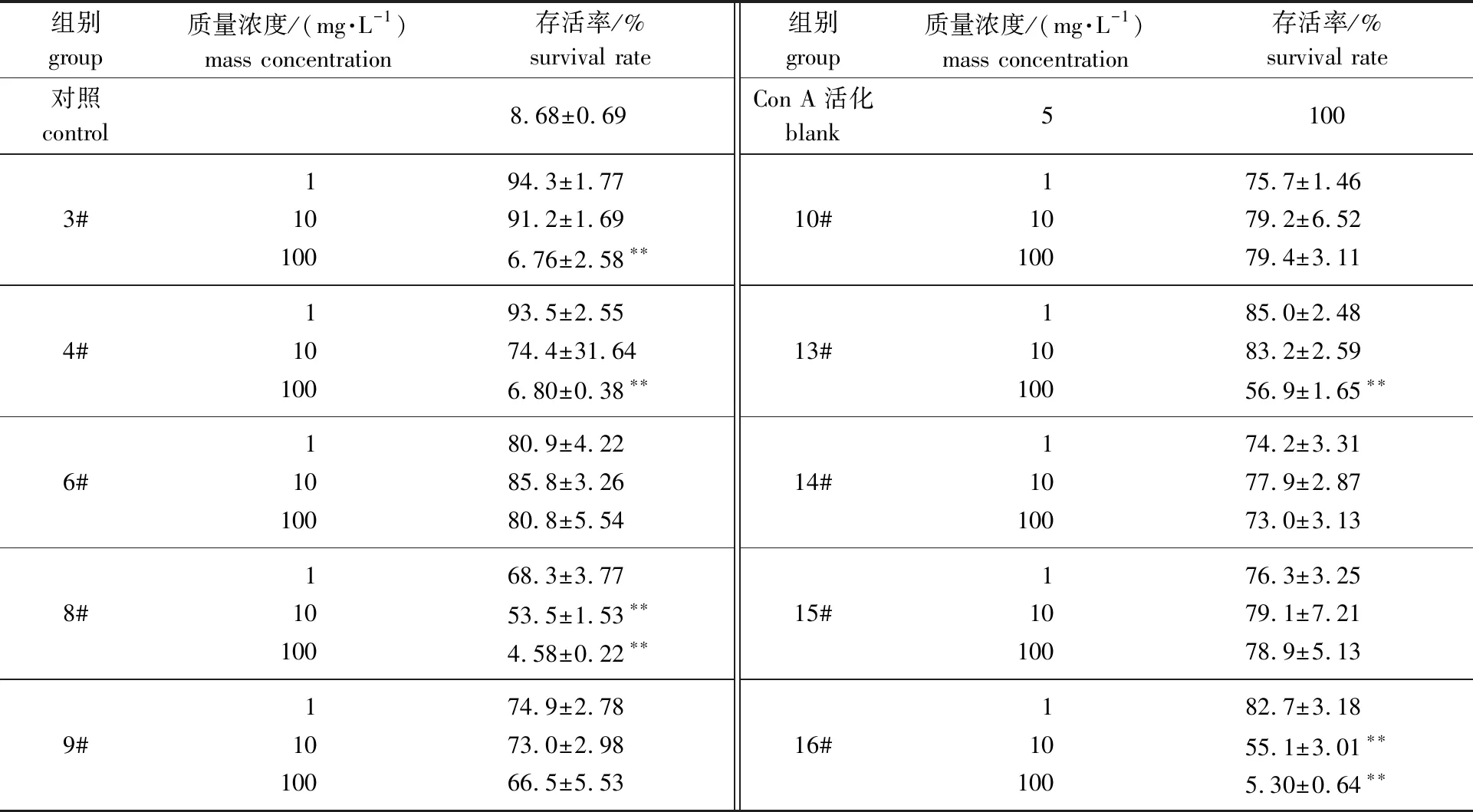
表4 朴树提取物对Con A活化的T细胞增殖的抑制作用
3 结 论
3.1考察了银杏酸对人HepG2肝细胞的毒性以及对免疫系统的影响。其中银杏酸C13∶0和C15∶1会显著抑制HepG2细胞的增殖;在小鼠实验模型中,总银杏酸会促进免疫系统的激活,导致淋巴结增大、脾脏肿大和接触性皮炎(过敏反应)等问题。
3.2对朴树成分进行提取和分离,共得到20个组分,研究并比较了这些组分对银杏酸的减毒作用。结果表明:朴树叶的BA相、Water相、朴树枝的2#和朴树皮的14#提取物能够减轻银杏酸对HepG2细胞的增殖抑制作用;朴树枝的8#和朴树皮的16#提取物对T细胞介导炎症反应有较好的抑制作用,有望用于治疗银杏酸导致的过敏反应。

