多黏菌素的群体药动学/药效学研究进展
刘家宝,陆 佳,阎 姝
多黏菌素是一类多肽类抗生素,临床主要应用多黏菌素B(polymyxin B,PMB)及多黏菌素E,多黏菌素E也称黏菌素(colistin)。二者具有相似的药理作用。临床用于治疗革兰阴性杆菌感染,特别是对许多抗生素类具有高水平的内在耐药性和获得耐药性能力的革兰阴性杆菌,如铜绿假单胞菌(PA)和鲍曼不动杆菌(AB)[1]。多黏菌素通过取代细胞膜阴离子脂多糖(LPS)分子中的钙(Ca2+)镁(Mg2+)离子(LPS分子稳定剂)使细菌细胞膜面积扩大,增加细胞膜的通透性,导致细胞内容物渗漏,进而导致细胞死亡。但同时多黏菌素可通过增加细胞膜通透性,导致阳离子、阴离子和水的大量涌入,使细胞肿胀和溶解引发急性肾衰竭的严重不良反应[2-3]。随着碳青霉烯类抗菌药物及替加环素的应用,临床不断培养出耐碳青霉烯的鲍曼不动杆菌外及铜绿假单胞菌,因此近年来,多黏菌素也被用于治疗耐多药(MDR)或只对多黏菌素敏感的革兰氏阴性细菌引起的医院感染的危重患者[4]。虽然多黏菌素被广泛应用于临床,但其大多数相关研究均在体外基础上进行,不能说明相关病生理因素对其体内代谢的影响。
群体药动学(population pharmacokinetics, PopPK)即药动学的群体研究方法,考察群体的药动学特征,不仅包括群体的典型值(typical value),更着重于研究群体中药动学变异的来源和相关性。其研究目的在于定量考察影响药物剂量、浓度关系的生理、病理等因素及影响程度,进而更有效地调整给药方案。目前针对多黏菌素的PopPK研究较多,本文综述了使用非线性混合效应模型(NONMEM)建模的多黏菌素B和多黏菌素E的群体药动学研究进展,并介绍了不同文献推荐的针对不同群体的用药方案,为临床用药提供参考。
1 多黏菌素的药效学
多黏菌素具有浓度依赖性的杀菌活性,其治疗效果严格依赖于峰值浓度与最低抑菌浓度(MIC)之比或曲线下面积与MIC之比(fAUC/MIC)[5-7]。在肾功能良好的患者中,多黏菌素B通常较多黏菌素甲磺酸盐(CMS)具有更高的fAUC/MIC值,因为CMS分布受肾功能的影响,而PMB受影响较小[7]。根据美国临床和实验室标准协会(CLSI)欧洲临床微生物和感染病学会药敏委员会(EUCAST)推荐对于98.9%的鲍曼不动杆菌,多黏菌素E及PMB药敏试验的折点PMS药敏试验的折点MIC≥4 μg/mL为耐药,MIC≤2 μg/mL为敏感。对于99.8%的铜绿假单胞菌,多黏菌素E及PMB药敏试验的折点PMS药敏试验的折点MIC≥8 μg/mL为耐药,MIC≤2 μgm/L为敏感。
2 多黏菌素的药动学
对于多黏菌素E的PopPK研究大多数采用了二室模型,对于PMB则多为一室模型。其中模型参数包含清除率(CL)、中央室分布容积(V1)、周围室分布容积(V2)、室间清除率(Q)、消除半衰期(t1/2)、表观清除率(CL/fm)和表观分布容积(V/fm)。
3 特殊人群特点
在发表的研究中,主要以重症患者、肾功能不全接受血液透析、烧伤的患者为研究亚组。其研究推荐的给药方案也不同。
3.1 重症患者 在Sandri等[8]的研究中,纳入24例重症患者,给予PMB治疗,提出总体重影响CL,肌酐清除率并不影响CL,这与Zavascki等[9]的研究结果一致。在Miglis等[10]的研究中,纳入52例重症患者,以治疗开始24 h内达到AUC/MIC≥50为有效性指标,提出体重影响CL及V,并且应根据调整后的体重而非总体重设置给药方案。同时该研究经过蒙特卡洛模拟得到了根据TBW和ABW调整下不同给药方案所产生的有效率和毒性反应发生率(表1),用以指导临床给药方案的设定。

表1 Cristina Miglis研究中对于不同TBW、ABW经蒙特卡洛模拟得到的有效率和毒性反应发生率
3.2 肾功能不全和肾脏替代治疗(RRT)患者 在Grégoire等[11]的研究中,纳入了73例重症患者,肌酐清除率(CLcr)范围为14~368 mL/min/1.73 m2,其报告肌酐清除率、体重、体温及血浆尿素浓度分别影响CLRCMS、VCMS、Vcol/fm、CLcol/fm值,该研究结果证实了CMS的剂量应根据患者的肾功能进行相应调整。并推荐临床应用9 MIU的负荷剂量及每日9 MIU每日的维持剂量(4.5 MIU q12h)。与Dalfino等[12-13]对于多黏菌素E临床药效学研究的结果一致。在Garonzik等[14]的研究中,纳入了105例不同程度肾功能的患者[CLcr为3~169 mL/min/1.73 m2],同时包括12例间歇性血液透析患者和4例连续肾脏替代疗法(CRRT)患者。其报告肌酐清除率及体重对于CL、V的影响,并针对不同重症患者类型提出了具体的给药剂量及给药间隔(表2)。该研究证实,在RRT患者中CMS和形成的多黏菌素E都可被清除[14-15]。同时CMS的药代动力学和形成的多黏菌素E含量,在肾功能不全和RRT的重症患者和正常肾功的重症患者中存在显著差异[14-15]。

表2 S.M.Garonzik推荐的剂量方案
但以每日9 MIU的剂量给予肌酐清除率>80 mL/min/1.73 m2的患者,多黏菌素E的平均稳态血药浓度很难达到2 mg/L,原因可能为正常肾功能患者中大部分CMS经肾清除,因此转化的多黏菌素E减少[16]。因此对于肌酐清除率>80 mL/min/1.73 m2的患者建议更高的维持剂量,以达到黏菌素浓度高于2 mg/L。
在Jacobs等[17]的研究中纳入8例重症患者,并根据研究中模拟的PK参数值将患者分为接受间接血液透析ICU患 者(ICU-HD组)、CLcr=85 mL/min或CLRCMS=68.5 mL/min的ICU患者(ICU-85组)、虚拟ICU患者(ICU-00),ICU-HD 患 者 的 CMS的 CLCMS值 为 113 mL/ min,VCMS为21 L,消除半衰期为2.1 h。多黏菌素E的表观清除率(CLcol/fm)为37.7 mL/min,表观分布容积(Vcol/fm)为28L,多黏菌素E的半衰期为9.8 h。ICU-HD患者的总清除率(CLCMS 113 mL/min)几乎与ICU-85患者相同(CLCMS112 mL/min)。该结果表明,HD患者的CMS非肾清除率(CLNRCMS)增加了约2倍(从43.7 mL/min增加到113 mL/min)。同时PopPK曲线表明,在ICU-HD患者中以1.5 MIU q12h应用 CMS后,稳态下的血浆黏菌素浓度应在3~4 mg/L,然而在间歇性血液透析结束时,黏菌素浓度将降至1至1.5 mg/L。在ICU急性肾功能衰竭患者中,间歇性血液透析间期CMS的肾排泄非常低。因此,大多数CMS可用于黏菌素形成(1-fe=100%),而对于具有保留肾功能的ICU患者,约61%的CMS以原形的形式经尿排泄(1-fe=39%)[11]。在该研究的模型中ICU-HD患者中多黏菌素E的表观清除率(CLcol/fm,33.3 mL/min)与在ICU-85患者中估计的相同(CLcol/fm,37.7 mL/min),同时ICU-HD患者的多黏菌素E的AUC值为ICU-85患者的3倍。
因此,ICU-HD患者的CMS给药方案除了考虑肾衰竭对黏菌素形成和消除的影响,同时还要考虑间歇性血液透析期间的CMS和多黏菌素E的清除。由于透析系统和透析膜的不同,CMS也将被不同程度地清除[18]。在Garonzik等[14]的研究中,在血液透析期间约55%的多黏菌素E被清除,Jacobs[17]等研究发现在血液透析期间约76%的多黏菌素E被清除。而在Jitmuang等[19]的研究中血液透析对于多黏菌素的浓度-时间曲线影响较小。这些差异可能是由于不同的测定方法(建模,透析液中回收的量,或膜前和膜后血浆样品中的浓度差异)或不同的血液透析特征而产生。以上结果提示,对于行间歇血液透析的患者,CMS或多黏菌素E血药浓度的管理更适宜在血液透析后立即进行,而不是在进行血液透析前。
Jacobs等[17]在研究中提出,对于MIC<1.5 mg/L(fAUC/MIC,>15)的非肺部感染或MIC<0.5 mg/L(fAUC/MIC,>50)的肺部感染患者,或对于ICU常见病原体,如MIC≥2 mg/L的鲍曼不动杆菌和MIC≥4 mg/L的铜绿假单胞菌和4%菌株MIC>4 mg/L的肺炎克雷伯菌感染,在接受间歇血液透析治疗时,无透析日建议日剂量为3 MIU,透析日增加到4.5 MIU,相当于透析日的日剂量较无透析日增加50%,在这种给药方案下,可以较好地维持多黏菌素E血药浓度在3~4 mg/L。同时对于肺部感染,Jacobs等[17]建议增大剂量同时联合气雾给药,考虑到较大的个体间差异,较高的给药剂量可能会导致更高的不良反应发生率和严重的毒性反应,因此在这种情况下,建议监测血浆浓度和不良反应体征[20-21]。同时,根据目前产品特性概述(SPC)中CMS的最高限量剂量,美国和欧洲共识推荐每日剂量为9~10 MIU。报告显示,接受剂量超过10MIU治疗的患者发生肾毒性的可能性高达69%[22-23]。
与CMS不同的是,临床研究发现肾功能并不会对PMB血浆浓度造成较大影响。根据Sandri等[8]的研究,在24例重症患者中(CLcr为10~143 mL/min)包括2例CRRT患者,与多黏菌素E类似,PMB在透析过程中也会被清除。在12 h给药间隔中,透析液中的原形形式的PMB为12.2%和5.62%,根据体重校正后的清除率分别为0.043和0.027 L/(h·kg)。然而,由于临床数据有限,因此目前不建议对CRRT患者进行PMB剂量调整。多黏菌素在肾功能不全重症患者群体药动学背景及药动学研究汇总见表3和表4。
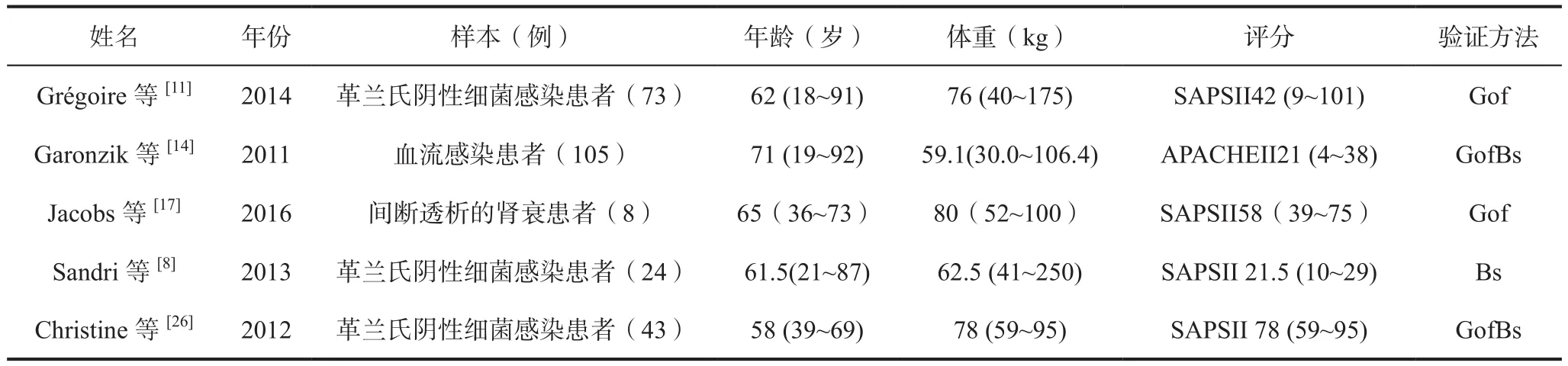
表3 多黏菌素在肾功能不全重症患者群体药动学背景
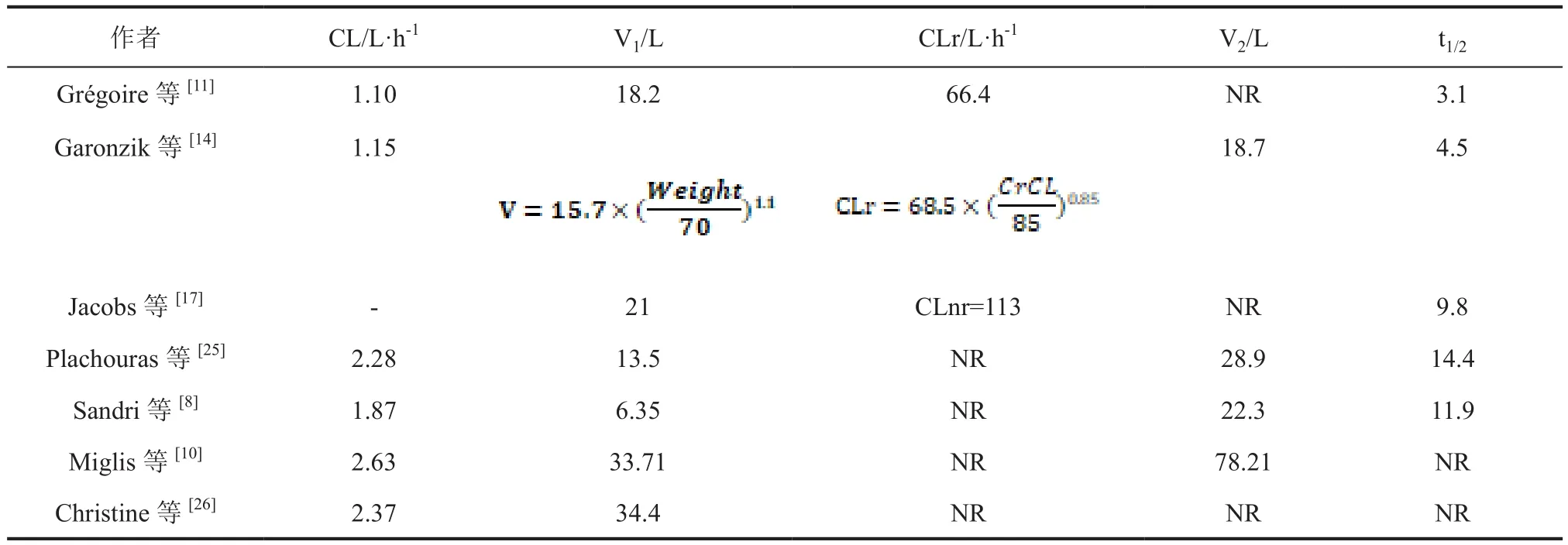
表4 多黏菌素在肾功能不全重症患者药动学研究汇总
3.3 烧伤患者 在烧伤患者群体中,烧伤48 h后将进入代谢亢进期,此时期肝脏和肾脏的血流量增多,对药物的水合作用增快,因此许多药物的CL和V均增大。但在Lee等[24]的研究中,纳入50例不同程度烧伤重症患者,模型得到CLcol=8.49L/h,Vcol=81.1L,其中CLcol与未烧伤患者无显著性差异,Vcol则约为未烧伤重症患者的2倍[25],因此表现为消除半衰期较未烧伤重症患者显著缩短(t1/2=6.6 h vs 14.4 h),但该研究未推荐具体给药方案。
3.4 肥胖患者 Christine等[26]研究纳入43例住院患者,其中12例超重患者(8例患者体重≥100 kg),研究发现总体重对于PMB的CL无影响,因此使用总体重对肥胖患者进行给药,有可能导致更严重的肾损伤。研究表明超过150~250 mg的总日剂量与肾毒性高度相关[27-28]。
4 结论
多黏菌素E是以多黏菌素甲磺酸盐(CMS)的前药来作为临床应用。CMS主要以原形形式经尿液排泄(70%),且部分转化为多黏菌素E(最多30%)[11,29],因此在肾功能不全的重症患者群体中建议根据肌酐清除率和多黏菌素E目标平均稳态浓度设置给药剂量和给药间隔。对于接受肾脏替代治疗的患者,由于透析过程将清除CMS及形成的多黏菌素,因此建议在血液透析最后1 h输入50%的日剂量,以维持目标平均稳态浓度。而PMB主要通过非肾脏途径消除,因此肌酐清除率对其CL、V影响较小;PMB的给药方案应根据体重进行调整,但对于肥胖患者的研究未显示出体重对PMB的CL的影响,同时高剂量PMB显示出更高的肾毒性,因此不推荐更高剂量的用药[30]。
以上研究仍存在例数有限,降低结果可信度以及具体影响程度的评价方式不一致等问题。未来的多黏菌素群体药动学/药效学研究需要更加关注儿童及老年患者群体,尽管目前已证实肌酐清除率对CL的影响,但对具有特殊代谢特征的群体,则需要更大样本的群体药动学/药效学研究及荟萃分析来指导临床给药方案的制定。

