复合核桃油的体外抗氧化活性
李清清,余旭亚,耿树香,马婷,宁德鲁,韩本勇
1(昆明理工大学 生命科学与技术学院,云南 昆明,650500)2(云南省林业和草原科学院,云南 昆明,650204)
核桃在我国资源丰富,品种繁多。据统计,2016年我国核桃种植面积723×104hm2,产量达365万t(干果),种植面积和产量均居世界首位[1]。作为一种重要的木本油料植物资源,核桃仁中的油脂含量高达60%~70%[2]。核桃油含有丰富的脂肪酸和天然生物活性成分,具有保健益智的作用,并可预防癌症和降低患心血管疾病的风险[3]。因此作为一种重要的功能性植物油脂,核桃油受到国内外研究学者的广泛关注[4]。然而高含量的多不饱和脂肪酸极易导致核桃油氧化酸败,影响其风味、品质及货架期[5]。所以核桃油在保存过程中的氧化与抗氧化是人们关注的焦点。
自由基具有极强的氧化作用,会氧化蛋白质、损害核酸和破坏细胞膜上的多糖结构,危害细胞和生物体,并诱发癌症、糖尿病、动脉粥样硬化和心脑血管疾病等[6]。植物油中有很多能够消除自由基的抗氧化类功能因子,如黄佳聪等[7]证明腾冲红花油茶籽油中的多酚类物质具有较强的自由基清除能力。油脂中的抗氧化成分对维持油脂体系的稳定具有重要意义,并对调节人体自由基代谢平衡、延缓衰老、预防心血管疾病和抗癌等有重要作用[8]。从膳食中摄取抗氧化成分,是预防疾病的最佳途径,而通过食用油脂补充抗氧化物质是一条理想途径[9]。
将核桃油与其他食用油进行调和可以提高营养价值[10]。美藤果油富含VE、多酚等天然抗氧化剂,具有比核桃油更强的氧化稳定性[11]。李清清等[12]证明添加20%(质量分数)美藤果油能够显著提高核桃油的氧化稳定性和品质。目前尚无对复合核桃油(添加20%美藤果油的核桃油)体外抗氧化活性研究的报道。
1 材料与方法
1.1 材料与试剂
核桃油,购自迪庆香格里拉舒达有机食品有限公司;美藤果油,购自西双版纳印奇生物资源开发有限公司。
FeCl3、无水乙醇、NaH2PO4、Na2HPO4、NaOH、FeSO4、三氯乙酸、30%H2O2等、H2O230%、水杨酸,分析纯,购于北京鼎国昌盛生物技术有限责任公司;HCl(分析纯),购于重庆川东化工有限公司;菲啰嗪一钠盐、DPPH自由基,购于上海蓝季科技发展有限公司;邻苯三酚,购于上海贤鼎生物科技有限公司;FeCl2、TBHQ,购于上海麦克林生化科技有限公司。
1.2 仪器与设备
DHG-9053A真空干燥箱,上海一恒科学仪器有限公司;FA2004 N分析天平,上海箐海仪器有限公司;Ultrospec 2100pro紫外可见分光光度计,Amersham Biosciences;5804R离心机,Eppendorf;DS.85 10DTH超声波微波组合体系,上海生析超声仪器有限公司;HHw—D6水浴锅,金坛双捷实验仪器厂。
1.3 试验方法
1.3.1 DPPH自由基清除能力测定[13]
采用减量法准确称取1.0 g TBHQ、复合核桃油和核桃油,用无水乙醇定容至100 mL,配制成10 mg/mL的母液备用,现配现用,下同。
用无水乙醇将TBHQ(阳性对照)、复合核桃油和核桃油母液(10 mg/mL)稀释成质量浓度分别为1、2、3、4、5、6 mg/mL的样品备用。参照参考文献[13]测定样品的DPPH自由基清除能力,计算如公式(1)所示:
(1)
式中:A1为2 mL样品溶液+2 mL DPPH溶液的吸光度;A2为2 mL样品溶液+2 mL无水乙醇的吸光度;A3为2 mL无水乙醇+2 mL DPPH 溶液的吸光度。
1.3.2 羟自由基清除能力
用无水乙醇将TBHQ(阳性对照)、复合核桃油和核桃油母液(10 mg/mL)稀释成质量浓度分别为1.0、1.2、1.4、1.6、1.8、2.0 mg/mL的样品备用。参照参考文献[14]测定样品的羟自由基清除能力,计算如公式(2)所示:
(2)
式中:A1为2 mL样品溶液+2 mL FeSO4溶液+2 mL H2O2溶液+2 mL水杨酸乙醇溶液的吸光度;A2为2 mL样品溶液+2 mL FeSO4溶液+2 mL H2O2溶液+2 mL 蒸馏水的吸光度;A3为2 mL蒸馏水+2 mL FeSO4溶液+2 mL H2O2溶液+2 mL水杨酸乙醇溶液的吸光度。
1.3.3 超氧阴离子自由基清除能力测定
用无水乙醇将TBHQ(阳性对照)、复合核桃油和核桃油母液(10 mg/mL)稀释成质量浓度分别为 1、2、3、4、5、6、7 mg/mL的样品备用。参照参考文献[15]测定样品的超氧阴离子自由基清除能力,计算如公式(3)所示:
(3)
式中:A0为1 mL蒸馏水+4.5 mL 50 mmol/L Tris-HCl(pH 8.2)缓冲液+0.4 mL 25 mmol/L邻苯三酚溶液+1 mL 8 mmol/L HCl的吸光度;A1为1 mL样品溶液+4.5 mL 50 mmol/L Tris-HCl(pH 8.2)缓冲液+0.4 mL 25 mmol/L邻苯三酚溶液+1 mL 8 mmol/L HCl的吸光度。
1.3.4 还原能力测定
采用铁氰化钾法测定。用无水乙醇将TBHQ(阳性对照)、复合核桃油和核桃油母液(10 mg/mL)稀释成质量浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7 mg/mL的样品备用。参照参考文献[15]测定样品的还原能力。
1.3.5 Fe2+鳌合能力测定[13]
用无水乙醇将TBHQ(阳性对照)、复合核桃油和核桃油母液(10 mg/mL)稀释成质量浓度分别为 1、2、3、4、5、6、7 mg/mL的样品备用。参照参考文献[13]测定样品的Fe2+鳌合能力,计算如公式(4)所示:

(4)
式中:A1为1 mL样品溶液+3.7 mL蒸馏水+0.1 mL FeCl2溶液+0.2 mL菲啰嗪溶液;A2为1 mL样品溶液+3.7 mL蒸馏水+0.1 mL 蒸馏水+0.2 mL菲啰嗪溶液;A2为1 mL蒸馏水+3.7 mL蒸馏水+0.1 mL FeCl2溶液+0.2 mL菲啰嗪溶液。
1.3.6 数据处理与分析
每个实验设置3组平行,使用ANOVA(SPSS 19.0)一步法分析实验数据。最小显著性差异进行多重比较检验调查不同试验的组间差异,图中“*”表示同一时间与其他组差异显著(P<0.05);“**”表示同一时间与其他组差异极显著(P<0.01)。
2 结果与分析
2.1 复合核桃油对DPPH自由基清除能力
DPPH自由基是十分稳定的以氮为中心的自由基,其乙醇溶液呈紫色,在波长517 nm处有强吸收。在抗氧化剂存在时,DPPH溶液颜色变浅,其在最大吸收波长517 nm处的吸光度减小,吸光度的下降程度越高,样品对DPPH自由基的清除能力越强[16]。该法快速稳定,已被广泛用于油品抗氧化能力的评价复合核桃油对DPPH自由基清除能力的影响如图1所示。

图1 复合核桃油对DPPH自由基清除能力Fig.1 DPPH radical scavenging ability of blend walnut oil
由图1可看出,纯核桃油、复合核桃油(核桃油+20%美藤果油)和TBHQ对DPPH自由基均有清除作用,且随着质量浓度的增加,纯核桃油和复合核桃油对DPPH自由基的清除率也在增加。TBHQ组的DPPH自由基的清除能力最强,其清除率稳定在92%左右。在1.0~6.0 mg/mL时,复合核桃油的DPPH自由基最大清除率为(59.86±3)%,显著高于纯核桃油最大清除率[(34.19±2.54)%],低于TBHQ[(92.33±2.06)%]。半抑制浓度IC50为自由基清除率为50%时所需抗氧化物质的质量浓度,IC50越小,表示其清除自由基的能力越强,抗氧化能力越强。复合核桃油对DPPH自由基清除率的IC50为2.72 mg/mL,极显著低于纯核桃油的IC50(62.21 mg/mL)。吴俏槿等[17]研究中美藤果油对DPPH自由基清除率的IC50为1.15 mg/mL,显著低于橄榄油、茶油、亚麻籽油和紫苏油,证明美藤果油具有较强的抗氧化能力。有研究表明几种坚果植物油的DPPH自由基清除能力与其含有的多酚、生育酚和甾醇含量相关,其中与生育酚的相关性最高[18]。赵贵兴[19]研究表明添加适量大豆天然生育酚可提高食用油的抗氧化能力。笔者之前研究表明添加20%美藤果油后,核桃油中的生育酚含量有所提高[12]。
因此,添加20%美藤果油后,核桃油中生育酚含量的增加,可能致使其对DPPH自由基清除率显著提高。
2.2 复合核桃油对羟自由基清除能力
作为活性氧的一类,羟自由基是机体内反应性和破坏性极强的自由基,与活细胞许多成分反应,直接损伤各种生物大分子和生物膜,引发各种疾病和加快机体衰老,对机体产生危害[20]。复合核桃油对羟自由基清除能力的影响如图2所示。

图2 复合核桃油对羟自由基清除能力Fig.2 Hydroxyl radical scavenging ability of blend walnut oil
由图2可看出,相比纯核桃油,复合核桃油对羟自由基具有较强的清除功能,且随着质量浓度的增加,其羟自由基清除率逐渐升高。在1.0~2.0 mg/mL 时,复合核桃油的羟自由基最大清除率为(85.86±1.54)%,显著高于纯核桃油最大清除率[(58.99±1.67)%],低于TBHQ[(96.92±2.3)%]。复合核桃油、核桃油和TBHQ的羟自由基清除能力IC50分别为0.8、1.5和0.5 mg/mL,可见复合核桃油的羟自由基清除能力略低于TBHQ,显著高于纯核桃油。植物油中的多酚物质与其氧自由基吸收能力呈正相关,对羟自由基有很强的清除能力[18]。这一结论在油茶籽毛油和橄榄油的研究中均被证实[21-22]。笔者之前的研究中,添加20%美藤果油后,核桃油中的多酚含量亦有显著性增加[12]。
因此,复合核桃油具有比纯核桃油更高的羟自由基清除率的原因可能是,20%美藤果油的添加提高了核桃油的多酚含量。
2.3 复合核桃油对超氧阴离子自由基清除能力
超氧阴离子自由基总量在机体内较少时,可有效杀伤侵入机体的有害菌,对机体有益;但其含量过多时,会破坏健康细胞,加快机体衰老,导致多种疾病发生[15]。超氧阴离子自由基是所有活性氧自由基中的第一个自由基,经过一系列反应可产生其他氧自由基,是评价物质抗氧化能力的重要指标之一[23]。
如图3所示,复合核桃油、核桃油和TBHQ的超氧阴离子自由基清除率在低质量浓度范围(1~2 mg/mL)增长明显,且在3 mg/mL后就稳定在75%以上,在1.0~7.0 mg/mL范围内,复合核桃油的超氧阴离子自由基最大清除率(89.77±1)%与TBHQ(91.35±2.06)%相当。复合核桃油、核桃油和TBHQ的超氧阴离子自由基清除能力IC50分别为0.9、1.7和0.4 mg/mL,可见复合核桃油的超氧阴离子自由基清除能力较差于TBHQ,大大强于核桃油。发芽糙米和牛油果等植物甾醇能够清除超氧阴离子自由基,原因可能为植物甾醇侧链的烯基参与了自由基清除反应,导致其具有超氧阴离子自由基清除能力[24-25]。在菜籽研究中,其多酚类物质对超氧阴离子自由基亦具有清除作用[26]。
因此,导致复合核桃油具有比核桃油更高的超氧阴离子自由基清除率的原因可能是,添加20%美藤果油后,核桃油中的甾醇和多酚含量增加,二者分别或协同对超氧阴离子自由基清除做出了贡献。
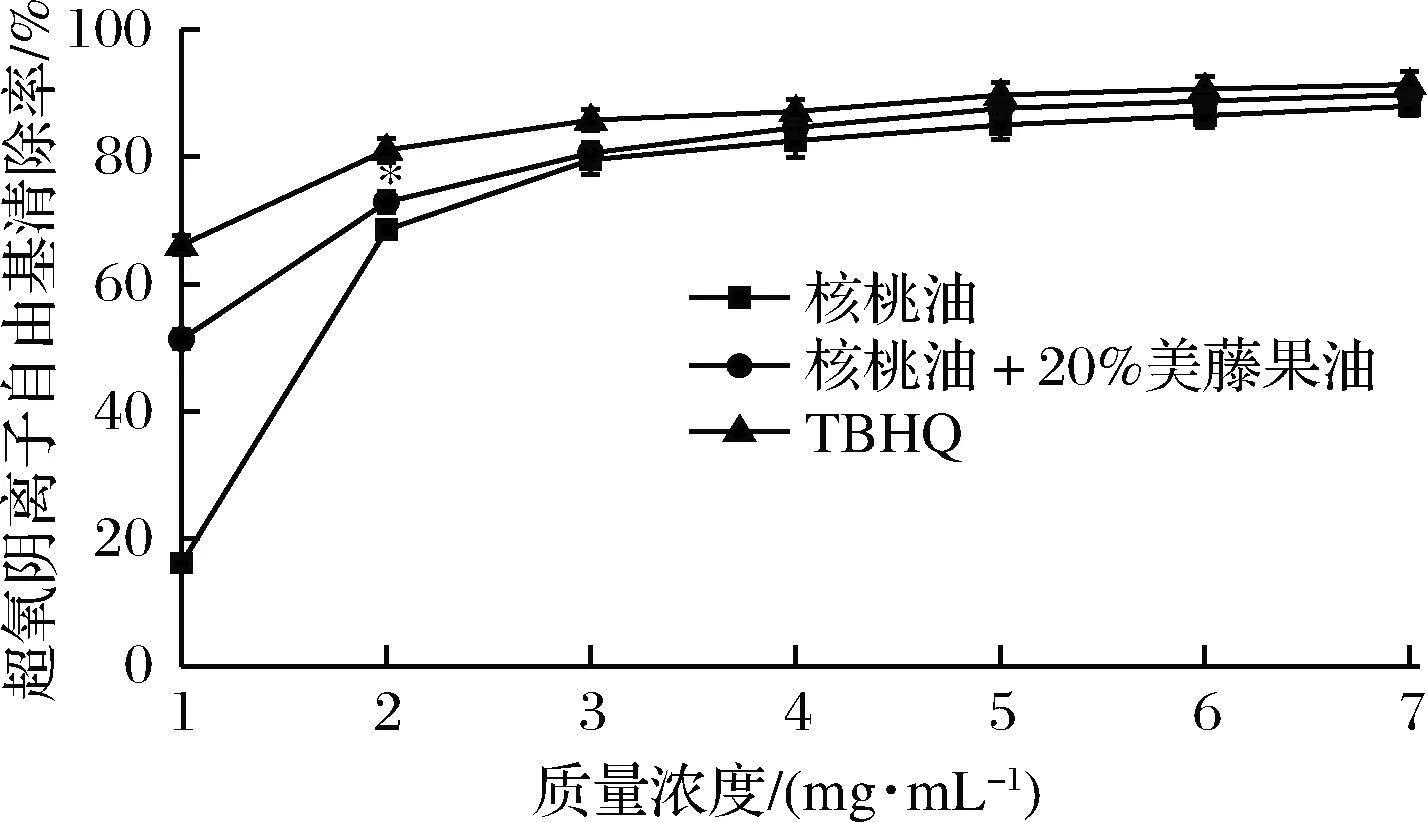
图3 复合核桃油对超氧阴离子自由基清除能力Fig.3 Superoxide anion scavenging ability of blend walnut oil
2.4 复合核桃油的还原能力
抗氧化剂利用自身还原能力给出电子,以达到清除自由基的作用,其还原能力与抗氧化活性存在一定的联系,还原能力越强,抗氧化活性越强[15]。因此,可通过测定油品的还原能力来表征其抗氧化活性的强弱。

图4 复合核桃油的还原能力Fig.4 The reduction capacity of blend walnut oil
由图4可看出,纯核桃油、复合核桃油和TBHQ对的还原能力随着质量浓度的增加而增强,呈现一定的线性增长关系。在0.1~0.7 mg/mL时,TBHQ组的还原能力最强(2.38±0.05),均高于核桃油(0.59±0.06)和复合核桃油(1.09±0.05)。尽管核桃油和复合核桃油的还原能力低于TBHQ,然而复合核桃油的还原能力却显著高于纯核桃油。多酚类物质是良好的电子供体,其供应的电子可使Fe3+还原成Fe2+,孙静涛等[27]证明石榴籽多酚类化合物的还原能力强于相同浓度下的抗坏血酸。结合笔者之前研究[12],复合核桃油的还原能力强于核桃油的原因可能是,20%美藤果油的添加增加了核桃油中的多酚含量。
2.5 复合核桃油的Fe2+螯合能力
金属离子可通过催化活性氧来氧化一些脂质、蛋白质和其他细胞组分,给机体造成氧化损伤[28]。因此,对金属离子螯合率的测定也是评价物质抗氧化活性的常用方法,螯合率越大,则说明物质的抗氧化活性越强[29]。复合核桃油的Fe2+螯合能力如图5所示。
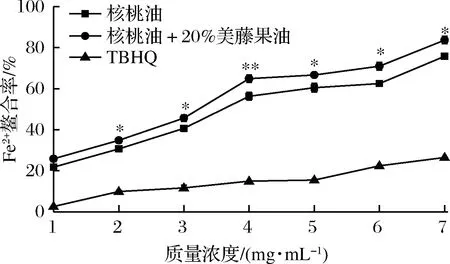
图5 复合核桃油的Fe2+螯合能力Fig.5 Fe2+ chelating capacity of blend walnut oil
由图5可见,随着复合核桃油、核桃油和TBHQ质量浓度的增大,对Fe2+螯合能力增强。在1.0~7.0 mg/mL时,复合核桃油、核桃油和TBHQ的Fe2+最大螯合率分别为(83.67±1.79)%、(75.74±1.11)%和(26.47±0.14)%,三者对Fe2+螯合能力的IC50分别为2.5、3.3和15.94 mg/mL,这表明相同质量浓度下Fe2+螯合能力大小为:复合核桃油>核桃油>TBHQ。植物多酚在植物油保护中,还扮演金属离子螯合剂的角色[18]。因此,添加20%美藤果油后,核桃油中多酚类物质的增加,可能致使复合核桃油的Fe2+螯合能力增加。
3 结论
本研究通过体外抗氧化实验,探明了复合核桃油(核桃油+20%美藤果油)的抗氧化能力。核桃油对DPPH自由基、羟自由基、超氧阴离子自由基清除能力和Fe2+螯合能力的IC50分别为62.21、1.5、1.7和3.3 mg/mL,添加了20%美藤果油的复合核桃油相应的IC50分别为2.72、0.8、0.9和2.5 mg/mL。结果显示,复合核桃油的抗氧化能力低于TBHQ,显著强于纯核桃油。复合核桃油的抗氧化能力强于核桃油的原因可能为:添加20%美藤果油后,核桃油中的多酚、生育酚和甾醇等微量组分的含量增加,导致复合核桃油的抗氧化活性发生显著性变化。
本研究结果表明,20%美藤果油的添加使核桃油的抗氧化活性有显著性增强,可为核桃油的进一步开发利用提供参考依据。

