活化蛋白C通过靶向VLA-3-中性粒细胞亚群来减轻结核杆菌诱导的人气道上皮细胞炎症反应线粒体能量代谢障碍
陈焰 王岗玲 吴海明
1武警福建省总队医院感染科(福州350003);2厦门市儿童医院检验科(福建厦门361000)
小鼠患上内毒素血症和严重的多菌性腹膜炎后,炎症性中性粒细胞中整联蛋白VLA-3(CD49c/CD29)水平上升,而以VLA-3高中性粒细胞亚群为目标进行治疗可提高小鼠的存活率[1-2]。中性粒细胞通过吞噬作用在宿主防御系统中发挥关键作用[3]。感染引起严重炎症反应后,中性粒细胞由于促炎性细胞因子和微生物成分的激活导致凋亡减少、趋化性改变以及内脏器官过度浸润,从而导致附带组织损伤[4]。整联蛋白是异二聚体跨膜蛋白,可介导嗜中性粒细胞和细胞外基质蛋白间的粘附和信号传导,并促进其在血管内和间质的迁移[5]。活化蛋白C是一种维生素K依赖的丝氨酸蛋白酶,有很强的抗凝功能,源自凝血酶介导的循环蛋白C裂解[6]。除了其天然的抗凝功能外,活化蛋白C还有细胞保护和抗炎活性,包括保护内皮屏障、抑制细胞凋亡、减少促炎性介质的分泌和抑制白细胞迁移[7]。本研究使用人支气管上皮BEAS-2B细胞探究活化蛋白C与VLA-3的靶向关系及其对细胞炎症反应的抑制和对线粒体功能保护作用。
1 材料和方法
1.1 细胞培养将人支气管上皮细胞BEAS-2B(Sigma)在补充10%热灭活胎牛血清(FBS)、2 mmol/L L-谷氨酰胺、青霉素(100 U/mL)的Dulbecco改良Eagle培养基(DMEM)中培养,5%CO2和潮湿空气中恒温37 ℃加热。
1.2 BEAS-2B 细胞结核杆菌感染及细胞转染将BEAS-2B细胞以5×104个/cm2的密度接种在培养板上。用50个细菌/细胞的结合杆菌感染培养物。将感染的培养物孵育各种时间,直至72 h。与BCG孵育后,将BAEpC用PBS洗涤3次。通过Lipofectamine 2000试剂将重组慢病毒载体质粒pLP与BEAS-2B细胞共转染,并在37 ℃下孵育48 h。收集细胞培养基的上清液以获得携带活化蛋白C基因或空载体慢病毒溶液的慢病毒。将BEAS-2B细胞(5 ×103)接种到96孔板中并在37 ℃下培养过夜直至细胞融合率为50% ~60%。加入携带活化蛋白C基因的慢病毒pLP[感染复数(MOI)=4]并在37 ℃下孵育24 h。第2天,弃去含有病毒的培养基并用DMEM+10%小牛血清培养基代替,连续培养48 h。
1.3 实验分组BEAS-2B细胞分为3组:BEAS-2B组(正常培养的细胞系作为实验对照),结核杆菌诱导组(将BEAS-2B以5×104细胞/cm2的密度接种在培养板上,用50个细菌/细胞的结合杆菌感染培养物),BEAS-2B转染组(携带活化蛋白C的慢病毒载体与BEAS-2B进行细胞转染,让其超表达)。
1.4 整联蛋白配体结合测定使用纯化的可溶性人α3β1、α5β1和αVβ3进行可溶性整联蛋白结合测定。将1 μg/mL的可溶性整联蛋白与针对β1或β3亚基的单克隆抗体(针对β1整联蛋白的mAb TS2/6和针对β3整联蛋白的mAb D3)加上rhAPC混合在室温下在L15培养基中将1 mmol/L Mn2+在室温下放置1 h,用A/G蛋白沉淀蛋白质复合物,进行SDS-PAGE和大鼠抗人活化蛋白C抗体的蛋白质印迹分析。对于活化蛋白C结合抑制测定,从健康供体中分离中性粒细胞,与0、0.1、1和10 μg活化蛋白C以及针对整联蛋白α3、α5、αv或αM的封闭抗体一起孵育在1 mL L15培养基中于4 ℃放置30 min。洗涤后,将细胞在室温下用3.7%甲醛固定10 min。固定后,将细胞用大鼠抗活化蛋白C一抗和PE标记的山羊抗大鼠二抗在黑暗中于4 ℃染色30 min,洗涤并重悬于磷酸盐缓冲盐水(PBS)用于流式细胞仪分析。样品均在FACS Calliber流式细胞仪上收集,使用Flow Jo软件分析数据。
1.5 逆转录定量聚合酶链反应(RT-qPCR)使用试剂从培养的细胞中提取总RNA。使用反转录合成第一链cDNA。反应在42 ℃下进行60 min,通过加热至70 ℃5 min而终止。使用SYBR® Green PCR Master mix和ABI Prism 7500序列检测系统进行qPCR。PCR热循环条件为:在94 ℃下预变性3 min;进行35个94 ℃持续50 s,37 ℃1 min,72 ℃1.5 min的循环;在72 ℃延伸7 min。使用2-ΔΔCq方法对mRNA水平进行定量,并标准化为对照。RTqPCR用于确定IL-6、IL-8、MCP-1在细胞中的表达。见表1。

表1 RT-PCR 引物序列Tab.1 RT-PCR primer sequences
1.6 线粒体复合物活性检测使用荧光探针JC-1评估线粒体功能,该探针在细胞质中产生绿色荧光,并在呼吸性线粒体中聚集时产生红色/橙色荧光。在培养基中将细胞与2 μg/mL JC-1孵育30 min,用培养基洗涤一次。使用荧光平板读数器进行荧光测量,对J聚集体使用530 nm激发/590 nm发射设置(红色/橙色荧光)和485 nm激发/530-胞质荧光的nm发射设置(绿色)。使用配备了双罗丹明/荧光素滤光片组,×40水浸物镜和数码相机成像系统(诊断仪器)的Zeiss Axiophot 2荧光显微镜进行荧光显微镜检查。
1.7 线粒体膜电位测量在5 μmol/L Pim1抑制剂K00135(22)或DMSO存在下,将融合了血清的枯竭BEAS-2B细胞层与0、10%、15%、20%、30%或40%CSE孵育4 h。将细胞用RPMI 1640洗涤两次,用500 nmol/L TMRE染色,在37 ℃下染色30 min。染色后,将细胞用RPMI 1640洗涤一次,用胰蛋白酶消化,收集在FACS管中。将细胞重悬于300 μL补充钙、镁、葡萄糖和丙酮酸的无色DPBS中测量线粒体膜电位(Ψm)。使用Winlist软件分析数据。
1.8 ELISA 和TUNEL 鉴定细胞凋亡及活力通过细胞死亡ELISA和末端脱氧核苷酸转移酶(TdT)介导的dUTP-生物素缺口末端标记(TUNEL)检测BAEpC凋亡。使用细胞死亡ELISA试剂盒根据制造商的规程检测细胞质组蛋白相关的DNA片段。将细胞(5 × 104)接种在24孔板中,在37 ℃下孵育16 h。将细胞用200 μL裂解缓冲液在25 ℃裂解30 min,将20 μL上清液转移至链霉亲和素包被的多板中;将包含4 μL抗组蛋白-生物素和4 μL抗DNA-POD的80 μL免疫试剂添加到每个孔中,并将板在室温下振摇2 h,以检测细胞裂解物中的单核糖体和寡核糖体。洗涤后,将孔与100 μL的2,2′-叠氮基-二(3-乙基苯并噻唑啉磺酸盐)(ABTS)溶液在室温下孵育20 min。立即在酶标仪中于405 nm(波长540 nm)读取吸光度。用BCG处理后,将BEAS细胞在PBS(pH 7.4)中的1%多聚甲醛中在冰上固定1 h,洗涤,在70%乙醇中于-20 °C储存至少24 h。将样品与含有TdT酶和Br-dUTP的反应缓冲液在37 °C孵育1 h,与FITC标记的抗BrdU在37°C孵育30 min以进行FASCan分析。
1.9 统计学方法本研究采用SPSS 20.0统计软件;计量资料用均数±标准差表示,组间比较用单因素方差分析或者重复测量的方差分析,组间两两比较用LSD-t检验;计数资料用百分率(%)表示,组间比较用χ2分析;P <0.05表示差异有统计学意义。
2 结果
2.1 活化蛋白C 与整联蛋白VLA-3 结合测定VLA-3较VLA-3和αVβ3结合程度升高(P <0.05)。与其他两种整联蛋白相比,VLA-3对活化蛋白C的亲和力更高。见图1、表2。

图1 可溶性VLA-3、VLA-5 和αVβ3与APC 的结合测定Fig.1 Determination of binding of soluble vla-3,VLA-5 and αVβ3 with APC
表2 活化蛋白C 与VLA-3 的亲和度检测Tab.2 Detection of affinity between activated protein C and vla-3 ±s
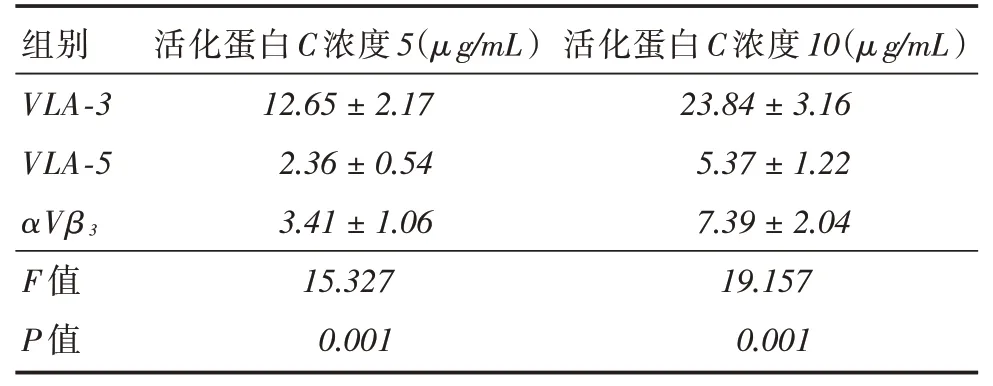
表2 活化蛋白C 与VLA-3 的亲和度检测Tab.2 Detection of affinity between activated protein C and vla-3 ±s
组别VLA-3 VLA-5 αVβ3 F 值P 值活化蛋白C 浓度5(μg/mL)12.65±2.17 2.36±0.54 3.41±1.06 15.327 0.001活化蛋白C 浓度10(μg/mL)23.84±3.16 5.37±1.22 7.39±2.04 19.157 0.001
2.2 活化蛋白C 减轻结合杆菌诱导的细胞炎症反应结核杆菌诱导组较BEAS-2B组IL-6、IL-8、MCP-1mRNA表达升高(P <0.05),BEAS-2B转染组较结核杆菌诱导组IL-6、IL-8、MCP-1mRNA表达降低(P <0.05),APC降低了结核杆菌诱导的细胞炎症反应。见图2、表3。
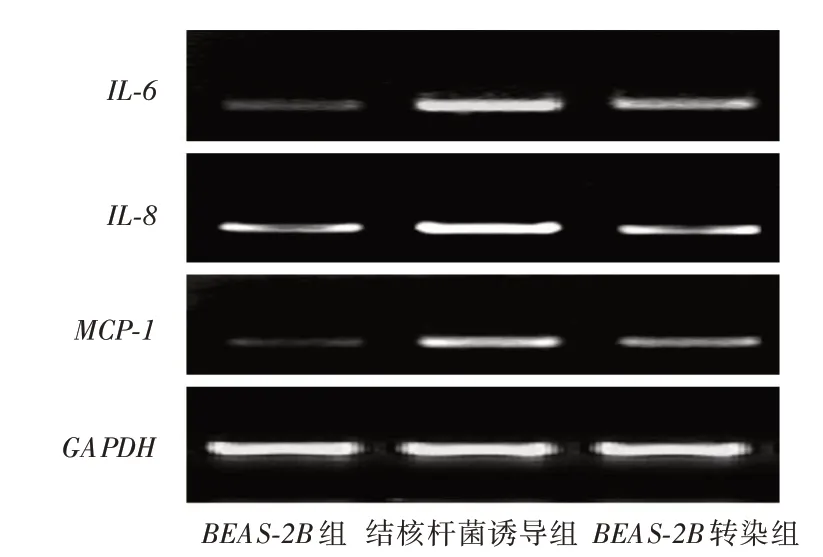
图2 qRT-PCR 检测促炎因子mRNA 表达Fig.2 The expression of proinflammatory factor mRNA was detected by QRT PCR
表3 细胞促炎因子mRNA 表达Tab.3 Expression of proinflammatory factor mRNA ±s

表3 细胞促炎因子mRNA 表达Tab.3 Expression of proinflammatory factor mRNA ±s
组别BEAS-2B 组结核杆菌诱导组BEAS-2B 转染组F 值P 值IL-6 1.15±0.23 2.24±0.36 1.23±0.27 15.652 0.001 IL-8 0.97±0.12 1.88±0.24 1.07±0.15 12.427 0.001 MCP-1 0.75±0.05 2.04±0.38 1.35±0.26 12.524 0.001
2.3 细胞线粒体复合物活性检测BEAS-2B组较结核杆菌诱导组线粒体复合物Ⅰ、线粒体复合物Ⅳ活性升高(P <0.05),结核杆菌诱导组较BEAS-2B转染组线粒体复合物Ⅰ、线粒体复合物Ⅳ活性降低(P <0.05)。见表4。
表4 线粒体复合物活性检测Tab.4 Detection of mitochondrial complex activity ±s

表4 线粒体复合物活性检测Tab.4 Detection of mitochondrial complex activity ±s
组别BEAS-2B 组结核杆菌诱导组BEAS-2B 转染组F 值P 值线粒体复合物Ⅰ(AU/50 μg MITO)15.64±3.24 4.28±1.32 16.57±3.18 20.285 0.001线粒体复合物Ⅳ(AU/10 μg MITO)17.58±2.28 8.61±1.16 14.81±1.50 11.491 0.001
2.4 细胞线粒体膜电位评估BEAS-2B组较结核杆菌诱导组膜电位升高(P <0.05),结核杆菌诱导组较BEAS-2B转染组膜电位降低(P <0.05)。结核杆菌诱导了细胞的线粒体功能受损,活化蛋白C的超表达抑制了线粒体受损情况。见表5。
表5 线粒体复合物活性检测Tab.5 Detection of mitochondrial complex activity±s
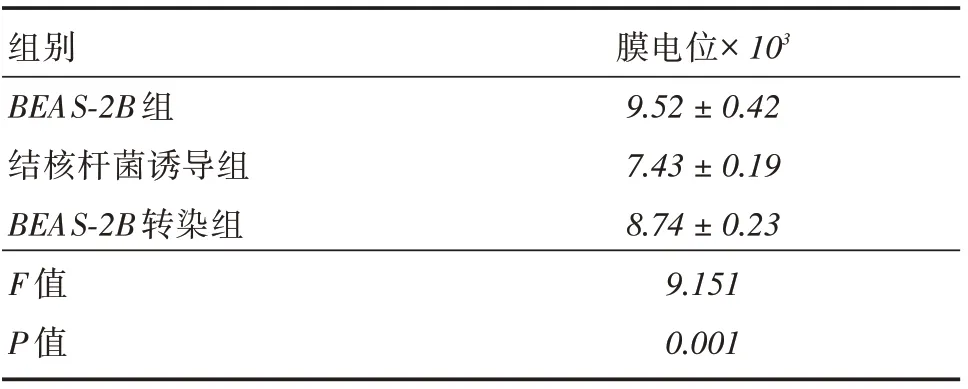
表5 线粒体复合物活性检测Tab.5 Detection of mitochondrial complex activity±s
组别 膜电位×103 BEAS-2B 组9.52±0.42结核杆菌诱导组BEAS-2B 转染组F 值P 值7.43±0.19 8.74±0.23 9.151 0.001
2.5 细胞凋亡率和细胞活力检测BEAS-2B组较结核杆菌诱导组细胞凋亡率降低(P <0.05),结核杆菌诱导组较BEAS-2B转染组细胞凋亡率升高(P <0.05)。BEAS-2B组较结核杆菌诱导组细胞活力升高(P <0.05),结核杆菌诱导组较BEAS-2B转染组细胞细胞活力降低(P <0.05)。TUNEL染色检测各组细胞的凋亡情况,结核杆菌诱导组的阳性率较BEAS-2B组高(P <0.05),BEAS-2B转染组减少了TUNEL染色阳性率(P <0.05)。见图3、表6。
表6 细胞凋亡率、活力情况检测Tab.6 Detection of apoptosis rate and vitality±s

表6 细胞凋亡率、活力情况检测Tab.6 Detection of apoptosis rate and vitality±s
细胞凋亡(%) 细胞活力(%)组别BEAS-2B 组结核杆菌诱导组BEAS-2B 转染组F 值P 值18.34±2.17 46.35±3.36 25.47±6.19 19.158 0.001 71.68±8.14 42.15±2.96 68.35±6.04 25.658 0.001
3 讨论
活化蛋白C活化后有许多不同的生物学活性,包括抗血栓形成作用以及各种抗炎和细胞保护作用,其最终作用是维持脉管系统的完整性[8]。虽然活化蛋白的抗凋亡和内皮屏障功能需要激活内皮蛋白C受体(endothelin C receptor,EPCR)和依赖性蛋白酶激活受体1(dependent protease activated receptor 1,PAR-1),但其抗炎作用是由EPCR-PAR-1依赖性和独立途径,可能涉及细胞粘附受体[9]。EPCR是在内皮细胞上鉴定出的第一个活化蛋白C受体。活化蛋白C的抗凋亡和血管保护作用由EPCR参与和APC-EPCR复合体对G蛋白偶联的PAR-1的次级激活介导[10]。许多表达EPCR的细胞类型包括内皮细胞也表达VLA-3。

图3 细胞TUNEL 染色检测Fig.3 TUNEL staining of cells
本研究发现BEAS-2B组较结核杆菌诱导组细胞凋亡率降低,结核杆菌诱导组较BEAS-2B转染组细胞凋亡率升高。BEAS-2B组较结核杆菌诱导组细胞活力升高,结核杆菌诱导组较BEAS-2B转染组细胞细胞活力降低。凋亡过程非常耗能,并且依赖于ATP来执行凋亡程序。结核杆菌诱导细胞发生炎症反应,并且可阻止ATP的生成,从而通过释放促炎性细胞因子和随后募集嗜中性白细胞来激活先天免疫应答。结核杆菌诱导组较BEAS-2B组IL-6、IL-8、MCP-1mRNA表达升高,BEAS-2B转染组较结核杆菌诱导组IL-6、IL-8、MCP-1mRNA表达降低,APC降低了结核杆菌诱导的细胞炎症反应。同时对相应的细胞线粒体功能和线粒体膜电位进行检测,评估细胞炎症反应对线粒体的损伤程度,检测各组细胞线体线粒体复合物Ⅰ、线粒体复合物Ⅳ活性受损情况发现,BEAS-2B组较结核杆菌诱导组线粒体复合物Ⅰ、线粒体复合物Ⅳ活性升高,结核杆菌诱导组较BEAS-2B转染组线粒体复合物Ⅰ、线粒体复合物Ⅳ活性降低。BEAS-2B组较结核杆菌诱导组膜电位升高,结核杆菌诱导组较BEAS-2B转染组膜电位降低。结核杆菌诱导了细胞的线粒体功能受损,活化蛋白C的超表达抑制了线粒体受损情况。笔者分析发现,嗜中性粒细胞表达活化蛋白C的受体,暴露于人类重组活化蛋白C会抑制嗜中性粒细胞的趋化性[11]。在白细胞整合素中,VLA-3(α3β1;CD49c/CD29)是一种新型的高亲和力细胞,它是严重系统性炎症期间出现的高炎症性嗜中性白细胞亚群的独特细胞表面标记rhAPC的受体[12]。在小鼠内毒素血症严重期间,嗜中性白血球表面上整合素VLA-3(CD49c/CD29)上调。本研究发现,将浓度不同的活化蛋白C与等量的活化的可溶性VLA-3,VLA-5和αVβ3整联蛋白孵育。VLA-3较VLA-3和αVβ3结合程度升高。与其他两种整联蛋白相比,VLA-3对活化蛋白C的亲和力更高。活化蛋白C通过整合素VLA-3(CD49c/CD29)以比其他RGD结合整合素有更高的亲和力。活化蛋白C和整联蛋白间的相互作用抑制促炎细胞因子的产生,暴露于结核杆菌的BEAS-2B或长时间暴露会导致坏死细胞死亡。
综上所述,VLA-3是活化蛋白C的新型细胞受体,活化蛋白C可靶向作用VLA3中性粒细胞亚群降低人高炎症反应,提高线粒体复合物Ⅰ、复合物Ⅳ活性,有效抑制结合杆菌诱导的细胞线粒体膜电位下降。

