一种测定福寿花浸膏中虾青素含量的酶解-正相高效液相色谱法研究
◆作者:陈小兵 林劲冬,2 冼啟志 许雪磊 陶正国
虾青素(3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素)是一种重要的类胡萝卜素,在饲料中有极其重要的作用(翟兴文等,2002)。天然来源的虾青素大多是以脂肪酸酯的形式存在,如福寿花、雨生红球藻、虾壳所含的虾青素基本上是以酯的形式存在,其中又包括虾青素双脂肪酸酯和虾青素单脂肪酸酯。天然虾青素在高效液相色谱测定前需要通过碱皂化或酶水解的方式进行分解,其中皂化法被广泛应用于大多数羟基类胡萝卜素分析,因为它是去除叶绿素和脂质的有效方法,也能够几乎完全地水解样品中的羟基类胡萝卜素酯,从而简化液相色谱图。
然而,对于虾青素而言,其分子中的羰基和羟基处于邻位,在碱性条件下极易被氧化为虾红素和半虾红素(Yuan J P等,1999),并进一步降解。氧化降解反应往往导致虾青素测定结果的较大偏差。降低皂化反应中碱的浓度和温度,有利于减少皂化过程中虾青素的损失(陈兴才,2005)。Yuan J P等(1999)的研究表明,在氮气保护下,0.4mol/L碱溶液在40℃下反应1小时,几乎可以完全皂化,其中约80%的产物为虾青素,10%为金盏花红素,其余产物主要为虾红素和半虾红素。当碱浓度升高到2mol/L,温度升高到60℃,反应1小时之后,产物中虾青素减少至20%以下,主要产物是虾红素和半虾红素。齐安翔等(2005)进行了碱皂化法测定虾青素含量的研究,难以获得理想的测定结果。操作条件苛刻,结果的重复性难以保障。由于碱对虾青素本身存在降解作用,对于同一样品,采用低温皂化法预处理测定虾青素比酶解法测定的含量数据低得多,并且还随着反应时间长短的不同而不同(Lietz G等,1997)。而且低温低碱皂化法耗时冗长,条件苛刻,不是测定天然虾青素的理想方法。
福寿花浸膏中所含的虾青素多以虾青素脂肪酸酯的形式存在,为了应用液相色谱法准确测定其虾青素的含量,需要预先将虾青素酯定量转化为虾青素。由于虾青素在碱皂化过程中容易降解,所以国际上要求严格的天然虾青素测定多采用胆固醇酯酶催化水解预处理结合高效液相色谱进行。这种酶解-液相色谱法应用到雨生红球藻及其提取物中的虾青素含量测定时结果准确可靠,得到广泛的认可。但胆固醇酯酶法检测虾青素的成本高,所以酶解法难以推广应用,至今仍未普及。
由于皂化法难以确保准确性,胆固醇酯酶法又成本过高,所以,探索一种成本低,酶来源稳定,重复性好,测定周期短的新的酶解方法,成为推广高效液相色谱法准确测定天然虾青素酯样品中虾青素含量的关键。本实验拟通过研究比较一种商品化的南极假丝酵母脂肪酶和公认的胆固醇酯酶在同等条件下进行福寿花浸膏虾青素酯的酶解反应,建立一种采用商品化南极假丝酵母脂肪酶进行天然虾青素酯酶解测定的方法。
1 实验部分
1.1 实验材料
福寿花超临界二氧化碳萃取浸膏,由广州立达尔生物科技股份有限公司技术中心提供。反式虾青素、9-顺-虾青素、13-顺-虾青素对照品,购自Sigma-Aldrich,HPLC纯度≥97%。南极假丝酵母脂肪酶,5U/mg,购自Novozymes。胆固醇酯酶(源自荧光假单胞菌),10U/mg,购自Sigma-Aldrich。分析纯试剂:三羟甲基氨基甲烷(TRIS)、丙酮、二氯甲烷、石油醚(60-90℃)、盐酸、无水硫酸钠,购自西陇化工股份有限公司。色谱纯试剂:正己烷、丙酮,购自西陇化工股份有限公司。氮气,购自Air Product公司。蒸馏水,实验室自制。
1.2 主要仪器与设备
高效液相色谱仪岛津LC-20A(配有二极管阵列检测器),恒温震荡培养箱,充氮手套操作箱。
1.3 实验方法
1.3.1 标准溶液的配制
在充氮操作箱内,用电子分析天平精确称量反式虾青素标准品约0.05 g(精确到0.000 1 g)到100 mL棕色容量瓶中,用10 mL二氯甲烷溶解,然后用正己烷/丙酮(86/14,v/v)混合溶剂定容至刻度,得到储备溶液(含有虾青素约0.5 mg/mL)。接着分别使用正己烷/丙酮(86/14,v/v)混合溶剂将储备溶液定量稀释2、4、8、16、32、64倍,所得系列标准溶液供测定绘制标准曲线使用。
1.3.2 色谱条件
流动相由86∶14(v/v)的色谱纯正己烷和丙酮组成。HPLC系统(岛津LC-20A)配有粒度5.0μm硅胶填充色谱柱(4.6×250mm,安捷伦)和内置柱温恒温箱,设定分析时的柱温为35℃,流动相流速为1.5 mL/min,检测波长为470 nm。
1.3.3 标准曲线确定
在所述色谱条件下测定各反式虾青素标准溶液的响应峰面积,以峰面积(X)与标准溶液的浓度(Y)为变量,采用线性回归法拟合标准曲线。
本实验中,9-顺-虾青素和13-顺-虾青素的标准品仅用作色谱图中虾青素各顺反异构体定性使用,反式虾青素、9-顺-虾青素、13-顺-虾青素的浓度与峰面积响应关系按11∶1计算,用反式虾青素、9-顺-虾青素、13-顺-虾青素的总面积计算虾青素的总量。
1.4 南极假丝酵母脂肪酶与胆固醇酯酶对样品的酶解处理
1.4.1 三羟甲基氨基甲烷-盐酸缓冲溶液的配制
精确称取三羟甲基氨基甲烷0.606 g至100 mL容量瓶,用75 mL蒸馏水溶解,再用1 mol/L盐酸调节pH至7.0,然后用水定容至刻度,所得溶液计算浓度为0.05 mol/L。
1.4.2 南极假丝酵母脂肪酶溶液的配制
准确称取90 mg南极假丝酵母脂肪酶(5 U/mg),溶解到45 mL预先配制好的三羟甲基氨基甲烷水溶液中,配制成10 U/mL的酶液备用。
1.4.3 胆固醇酯酶溶液的配制
准确称取45 mg胆固醇酯酶(10 U/mg),溶解到45 mL预先配制好的三羟甲基氨基甲烷水溶液中,配制成10 U/mL的酶液备用。
1.4.4 福寿花浸膏样品的酶解与处理
称取福寿花浸膏约0.05 g(精确至0.000 1 g)至25 mL容量瓶,加丙酮20 mL后在常温下超声辅助提取10 min,冷却后用丙酮定容至刻度,摇匀。准确移取2 mL上述丙酮溶液至10 mL离心管,然后加入3 mL南极假丝酵母脂肪酶溶液(酶解反应液中的脂肪酶浓度为6 U/mL),振摇30 s,得到酶解反应液1#。
以相同的方法配制出另外7份南极假丝酵母脂肪酶的酶解反应样品2#-8#,各振摇30 s后,将8份样品同时放入恒温震荡培养箱,于37℃下震荡反应,并按编号依次在20min、30 min、40 min、50 min、60 min、70 min、80 min、120 min取出,加入1 g无水硫酸钠和3 mL石油醚终止反应,激烈振摇30 s后,避光放置等待处理。
使用1.4.3所配制的胆固醇酯酶的溶液作为催化剂,依照相同的方法,制备8组酶解反应液9#-16#,分 别 酶 解20 min、30 min、40 min、50 min、60 min、70 min、80 min、120 min取出,即刻加入1 g无水硫酸钠和3 mL石油醚终止反应,激烈振摇30 s后,避光放置等待处理。
上述16组分别采用南极假丝酵母脂肪酶和胆固醇酯酶的反应处理液随后放入高速离心机以5000 rpm的转速离心5 min。离心完毕后,各自取上清液过滤膜后置于进样瓶中避光存放,准备进样。
1.5 正相高效液相色谱法测定虾青素含量
高效液相色谱仪在1.5 mL/min的恒定流速下工作。将上述16组进样瓶置于自动进样器中,按1#-16#的顺序分别自动进样20μL,色谱工作站采集各样品470 nm下的DAD数据并积分,以反式虾青素、9-顺-虾青素、13-顺-虾青素的峰面积之和计算各虾青素样品溶液的浓度并依据福寿花浸膏样品的重量及稀释倍数转化为福寿花浸膏样品的虾青素含量。
1.6 计算
样品称重量为m(单位为g),经上述过程制备上机溶液,在液相谱图中积分获得全反式虾青素的面积X1,9-顺-虾青素的面积X2和13-顺-虾青素的面积X3,以三者之和作为虾青素色谱峰的总面积X。首先通过标准曲线计算出上机溶液中虾青素的浓度Y(mg/mL),再通过稀释倍率及单位转换关系计算浸膏样品中的虾青素含量C(%),计算公式为:

1.7 南极假丝酵母脂肪酶酶解后液相色谱测定虾青素的重复性
以60 min酶解时间为时间基准,对采用南极假丝酵母脂肪酶溶液酶解同一个福寿花浸膏样品进而采用正相高效液相色谱测定虾青素含量的结果重复性进行了研究。
称取同一福寿花浸膏样品6份各约0.05 g(精确至0.000 1 g)至独立的6个25 mL容量瓶,编号R1#-R6#。分别加丙酮20 mL后在常温下超声辅助提取10 min,冷却后用丙酮定容至刻度,摇匀。准确移取2 ml R1#-R6#丙酮溶液至6个编号的10 mL离心管,然后各加入3 mL南极假丝酵母脂肪酶溶液(酶解反应液中的脂肪酶浓度为6 U/mL),振摇30 s,得到酶解反应液。将R1#-R6#反应液放入恒温震荡培养箱,于37℃下震荡反应60 min同时取出,立刻分别加入1 g无水硫酸钠和3 mL石油醚终止反应,激烈振摇30 s后,同时放入高速离心机以5000 rpm的转速离心5 min。离心完毕后,各自取上清液过滤膜后置于进样瓶,等待进样样品R1#-R6#,进样分析。高效液相色谱仪在1.5 mL/min的恒定流速下工作。分别自动进样20μL,色谱工作站采集各样品470 nm下的DAD数据并积分,以反式虾青素、9-顺-虾青素、13-顺-虾青素的峰面积之和计算各虾青素样品溶液的浓度并依据福寿花浸膏样品的重量及稀释倍数转化为福寿花浸膏样品的虾青素含量。

表1 同一福寿花浸膏样品在两种相同浓度酶液中的酶解数据*
对上述6组独立测定的样品的虾青素含量的计算值、平均值和平均偏差进行计算,判断该检测方法的重复性。
2 结果与分析
2.1 标准曲线
上述标准溶液在进样后,各反式虾青素标准溶液的浓度数据(mg/mL)和积分面积拟合标准曲线为Y=3.95061×10-8X+1.57276×10-4。相关系数R2为0.998,显示在设定的样品浓度范围内反式虾青素的浓度与峰面积响应值具有良好的线性关系。高效液相色谱的标准曲线如图1所示。

图1 虾青素标准曲线
2.2 酶解完全所需时间分析
在测定天然虾青素酯样品中虾青素含量的高效液相色谱法检测中,虾青素酯的酶解游离转化是关键步骤。只有当虾青素酯能够接近定量地转化为游离虾青素,而游离虾青素又能保持稳定,才有可能准确测定原样品中虾青素的真实含量。虾青素酯的酶解反应过程包括虾青素二脂肪酸酯酶解转化为虾青素单脂肪酸酯和虾青素单脂肪酸酯酶解转化为游离的虾青素。最终,可以通过液相色谱图(如图3-图5)观察到虾青素二脂肪酸酯及虾青素单酯对应的色谱峰全部转化为游离虾青素(主要包括全反式虾青素、9-顺-虾青素和13-顺-虾青素),此时便达到转化反应的最大转化率。以达到最大转化率时游离虾青素(包括全反式虾青素、9-顺-虾青素和13-顺-虾青素)的峰面积可推算原样品中虾青素的总含量。

图2 样品在两种酶中酶解过程的虾青素测定值曲线
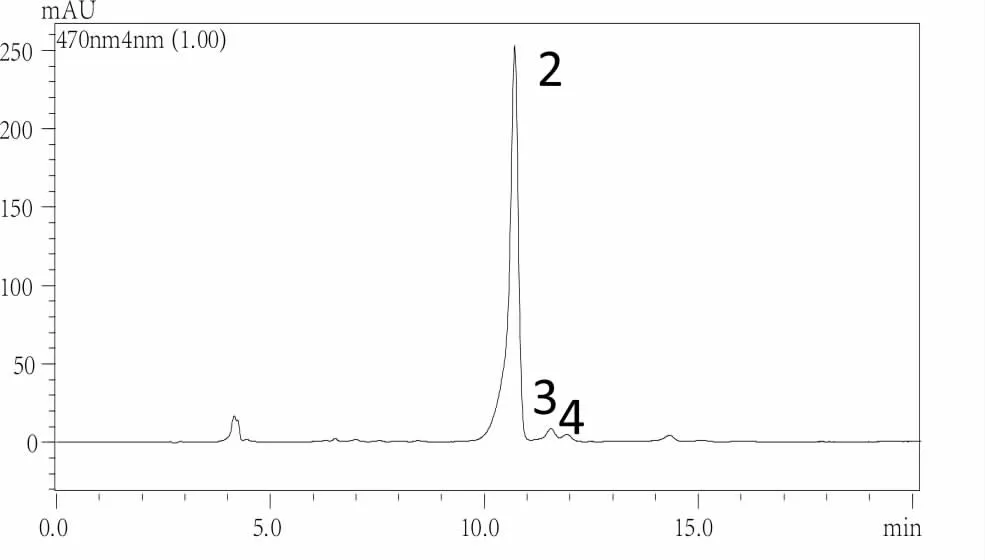
图3 虾青素对照品的高效液相色谱图
在本实验中,南极假丝脂肪酶和胆固醇酯酶都在酶活浓度6 U/mL的条件下对虾青素酯(福寿花浸膏)样品进行酶解处理。
本实验中不同酶解时间的虾青素转化率实验数据表明,南极假丝酵母脂肪酶和胆固醇酯酶都能够很好地将天然虾青素酯酶解为游离态的虾青素,而且完成酶解所需要的时间都不超过60 min。胆固醇酯酶较南极假丝酵母脂肪酶转化速度更快,大约在50 min内即转化完全,南极假丝酵母脂肪酶在60 min转化完全(如图2)。其后,70 min和80 min的酶解保持稳定。为了验证游离虾青素在该体系中的稳定性,我们对两种酶各进行了一次120 min的酶解实验,结果表明,无论是胆固醇酯酶还是南极假丝酵母脂肪酶,都在延长实验中保持了稳定性。证明在酶解完全后,在常温避光的保存条件下,并无明显的逆向反应或导致虾青素降解的因素存在。

图4 福寿花浸膏样品的高效液相色谱图

图5 福寿花浸膏在南极假丝酵母脂肪酶中酶解过程的液相色谱图
2.3 重复性
相同条件下进行的6组独立虾青素含量测定数据记录在表2中,6次平行测定所得样品虾青素含量算术平均值为9.199%,6次测定的相对标准偏差RSD为0.02372%。
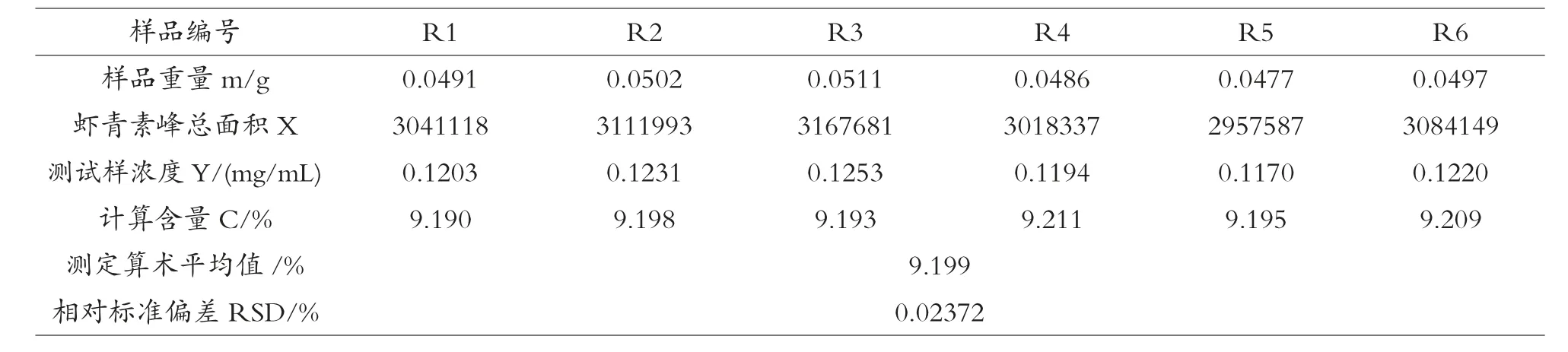
表2 南极假丝酵母脂肪酶酶解-液相色谱法测定福寿花浸膏中虾青素含量的重复性研究(n=6)
由此可见,南极假丝酵母脂肪酶酶解结合高效液相色谱测定的方法在测定虾青素含量在10%左右的福寿花浸膏样品时,具有很高的重复性。
3 讨论
本实验研究结果表明,用商品化的南极假丝酵母脂肪酶可以彻底地进行虾青素酯的酶解,并且酶解不会像强碱皂化法那样导致虾青素的降解。尽管南极假丝酵母脂肪酶的酶解速度较胆固醇酯酶略慢,但仍然可以控制在60 min左右完成酶解,其效率比一般的低温碱皂化方法高得多。而且,待测和已预处理的样品都无需冷藏和充氮处理,仅需正常避光存放即可,大幅度降低了检测的难度。更重要的是,南极假丝酵母脂肪酶酶解-正相色谱法具有优异的重复性,所测数据可信度高。由于南极假丝酵母脂肪酶已经商品化,价格相对胆固醇酯酶低得多,所以,南极假丝酵母脂肪酶酶解-正相高效液相色谱法有望广泛应用到雨生红球藻、虾壳、福寿花等天然虾青素原料和产品的虾青素含量测定领域。
参考文献:(略)

