尿源性干细胞外泌体对移动性牙根吸收修复的影响及其作用机制▲
顾 磊 戴红卫 周雯雯 周建萍
(1 重庆市消防总队医院口腔科,重庆市 401122,电子邮箱:guoaili1982@126.com;重庆医科大学附属口腔医院2 正畸科,3 修复科,重庆市 404100)
2008年美国维克森林大学再生医学研究中心首次从人尿液中分离纯化得到了一种具有无限自我更新能力和体外繁殖能力的细胞,其具备祖细胞特征,故将其命名为“人尿源祖细胞”。后续相关实验证明,该类细胞具有与间充质干细胞类似的多向分化潜能,因此将其更名为“人尿源性干细胞”[1]。众所周知,干细胞具有极强的自我更新和多向分化能力,一直以来在药物筛选和疾病治疗中研究最为广泛,临床上利用自体干细胞移植治疗急性髓细胞白血病、急性淋巴细胞白血病、多发性骨髓瘤、淋巴瘤等疾病,治愈率高,且安全可靠[2]。虽然大部分干细胞来源较为广泛,但对其获取途径要求极高,制备难度较大,而尿源干细胞制备方便,安全可靠,来源广泛且不存在伦理学争议,因此具有极好的临床治疗前景[3]。近年来,随着对尿源干细胞研究的不断深入,发现其在皮肤系统、神经系统、泌尿系统、生殖系统以及运动系统疾病中均具有较好的治疗效果[4]。
正畸力作用于牙齿时,可利用牙周膜进行传递力量,传递至牙槽骨后可导致牙槽骨改建或牙周膜更新,最终造成牙齿移动。牙齿在移动过程中会出现不同程度的牙根吸收,发生率为3%~100%,而牙根吸收长度超过3 mm的发生率可达30%[5-7]。牙根吸收作为正畸治疗的常见并发症之一,其致病原因以及发生机制目前尚未十分清楚。本研究利用大鼠移动性牙根吸收修复模型,探讨尿源性干细胞外泌体对移动性牙根吸收修复的影响及其作用机制。
1 实验动物与方法
1.1 实验动物 10只周龄为10周的健康SD大鼠,均为雄性,体重230~260 g,购自北京维通利华公司(动物合格证号:SCXK20060009)。
1.2 实验方法
1.2.1 实验动物分组:将大鼠饲养于实验动物中心,湿度设置为(55±5)%,温度设置为(25±5)℃,并设置昼夜节律为12 h,标准饮食喂养、自由饮水。适应性喂养1周后,将其按照随机数表法分为对照组和实验组,每组5只大鼠。
1.2.2 建立正畸移动性牙根吸收模型:参考Jäger等[8]的方法建立模型。首先以3 mL/kg的剂量给予大鼠腹腔注射10%水合氯醛进行麻醉。麻醉后将大鼠仰卧固定于鼠板上,采用低速金刚砂车针在上颌第一磨牙的近中牙颈部和中切牙的牙颈部磨出深度为0.2 mm的浅凹。正畸矫治力施加在左上颌,在大鼠上颌左侧第一磨牙与上切牙之间安置直径为8 mm的弹簧,弹簧两端用细结扎丝进行固定,利用测力器施加100 g的矫治力[9],使磨牙向近中方向移动,并对结扎丝末端进行调整,避免牙龈受到不良刺激。在施加矫治力的过程中注意避免损伤周围软组织,手术过程须精细谨慎,并对动物做好适当保暖工作,保持大鼠呼吸道畅通,切忌过量注射麻醉剂,以免造成实验动物死亡。另外,实验人员需每日检查弹簧加力装置,如发现装置脱落或损坏须及时重新安装,以保证矫治力持续作用。连续施加矫治力14 d后,小心拆除弹簧加力装置。
1.2.3 注射尿源干细胞外泌体:以3 mL/kg的剂量给予大鼠腹腔注射浓度为10%的水合氯醛进行麻醉,麻醉后拆除加力装置,将其固定于特制的鼠板上,实验组大鼠于左侧上颌第一磨牙近中根颊侧黏膜转折处,注射200 μL含100 μg(蛋白含量)尿源性干细胞外泌体(由西安齐岳生物公司提供)的磷酸缓冲盐溶液(phosphate buffered saline,PBS),对照组大鼠则在相同位置注射200 μL PBS,两组均每隔3 d注射1次,共注射5次[10]。
1.2.4 Micro-CT活体扫描:参照相关研究[11]改进micro-CT活体扫描方法。于注射尿源干细胞外泌体前及注射5次后分别使用micro-CT活体扫描仪(Latheta公司,型号:LCT200)对大鼠左侧加力牙齿周围牙槽骨和上颌第一、二磨牙进行扫描,扫描参数设置为8 W、114 kVp,厚度设置为10 μm,视角直径设置为38.9 mm,整合时间设置为0.35 s,每只大鼠单次扫描时间为40 min,扫描时注意尽量调整大鼠头部使其腭平面与地面平行。
1.3 观察指标
1.3.1 牙根表面吸收陷窝体积测定:利用Mimics 10.0软件,在micro-CT扫描得到的断层处,采用三维凸包算法计算每只大鼠左侧上颌第一磨牙的近中根分叉处至尖端的表面吸收陷窝体积[12],测量3次取平均值。
1.3.2 骨小梁结构参数测定:根据micro-CT扫描图像,在距离牙根表面200 μm处选取一700 μm×700 μm的区域为感兴趣区域[13-14],利用计算机对感兴趣区域实施三维重建,测定骨小梁相关结构参数,包括骨小梁数目(trabecular number,Tb.N)、骨小梁分离度(trabecular spacing,Tb.Sp)、骨体积/组织体积(bone volume/tissue volume,BV/TV)比值、骨小梁厚度(trabecular thickness,Tb.Th),测量3次取平均值。
1.3.3 蛋白免疫印迹法检测:采用蛋白免疫印迹法检测骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)、骨唾液酸蛋白(bone sialoprotein,BSP)、骨保护素、核因子κB受体活化因子配体(receptor activator of nuclear factor kappaB ligand,RANKL)的表达水平。采用RIPA裂解液(Regal公司,生产批号:SJH0995)提取总蛋白后,采用二喹啉甲酸法测定蛋白浓度后行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;取下凝胶进行转膜,恒流220 mA转膜1 h,分子量40~60 kd恒流280 mA转膜1 h;取下膜后用PBS洗涤4次,5 min/次;将膜置于5%脱脂奶粉封闭液中37℃封闭1 h;用PBS稀释一抗(1 ∶1 000),膜在一抗稀释液中4℃过夜封闭;次日将膜取出后用PBS洗涤4次,5 min/次;用含5%脱脂奶粉的封闭液稀释二抗(1 ∶2 000),膜在二抗中37℃反应1 h;反应完毕后,把膜取出后置于干净的盒子中用PBS洗涤4次,5 min/次;以甘油醛-3-磷酸脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,利用电化学发光法显影,曝光。采用Image J软件检测灰度值,以蛋白的灰度值/GAPDH的灰度值作为所测蛋白质的相对表达量。
1.4 统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用成组t检验,组内注射前后比较采用配对t检验;计数资料以例数或百分比表示,比较采用χ2检验。P<0.05表示差异具体统计学意义。
2 结 果
2.1 两组牙根表面吸收陷窝体积的比较 注射尿源性干细胞外泌体前,两组大鼠的牙根表面吸收陷窝体积比较,差异无统计学意义(P>0.05)。注射尿源性干细胞外泌体后,两组大鼠牙根表面吸收陷窝体积均较注射前减小,且实验组体积低于对照组(均P<0.05)。见表1。
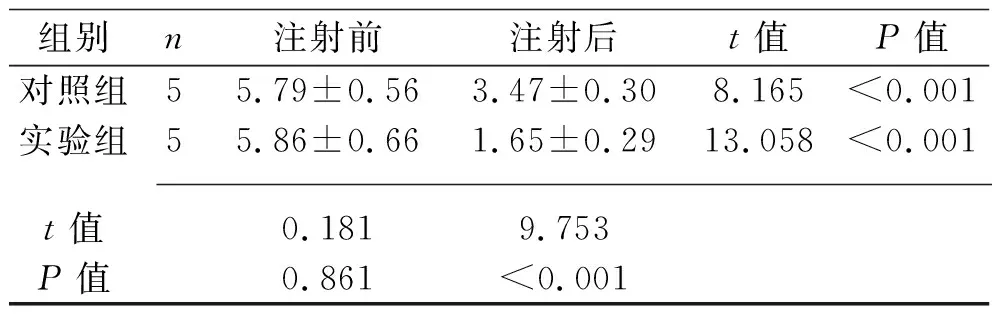
表1 两组牙根表面吸收陷窝体积的比较(x±s,×107 μm3)
2.2 两组骨小梁结构参数的比较 注射尿源性干细胞外泌体前,两组大鼠的Tb.N、Tb.Sp、BV/TV比值、Tb.Th比较,差异无统计学意义(均P>0.05)。注射尿源性干细胞外泌体后,实验组大鼠的BV/TV、Tb.Th高于注射前水平及对照组(均P<0.05)。见表2。
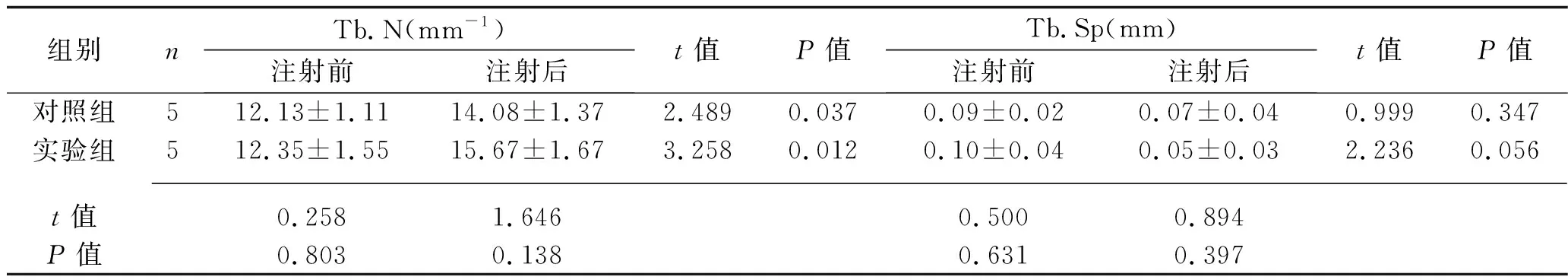
表2 两组骨小梁结构参数的比较(x±s)
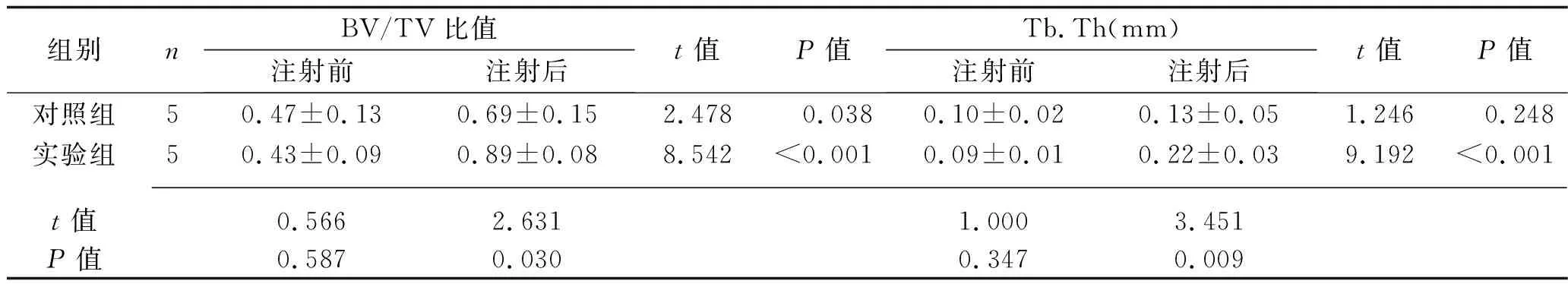
组别nBV/TV比值注射前注射后t值P值Tb.Th(mm)注射前注射后t值P值对照组50.47±0.130.69±0.152.478 0.0380.10±0.020.13±0.051.246 0.248实验组50.43±0.090.89±0.088.542<0.0010.09±0.010.22±0.039.192<0.001 t值0.5662.6311.0003.451P值0.5870.0300.3470.009
2.3 两组BMP-2、BSP、骨保护素、RANKL相对表达水平的比较 实验组的BMP-2、BSP表达水平均高于对照组(均P<0.05),两组的骨保护素、RANKL表达水平差异无统计学意义(均P>0.05)。见表3和图1。
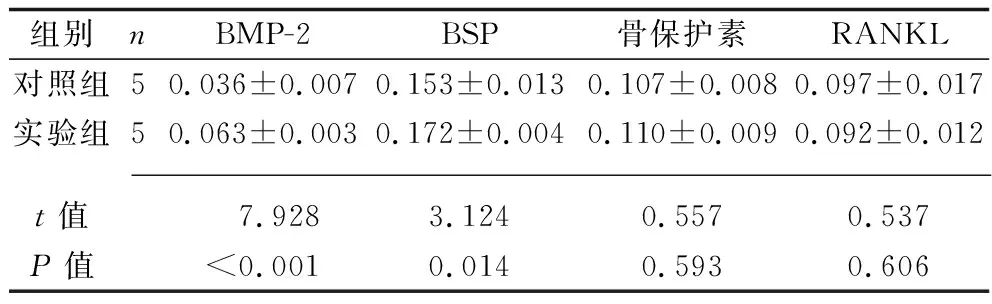
表3 两组BMP-2、BSP、骨保护素、RANKL相对表达水平的比较(x±s)
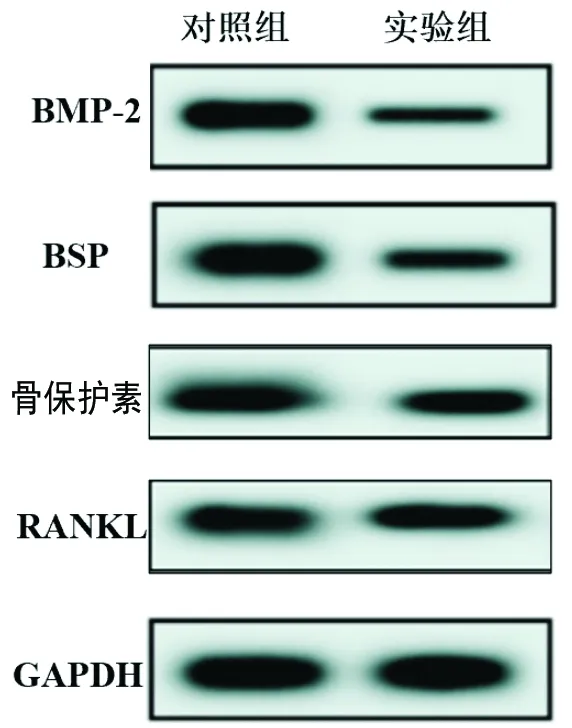
图1 两组BMP-2、BSP、骨保护素、RANKL表达水平
3 讨 论
导致牙根吸收的原因主要分为患者自身因素和治疗相关因素,其中患者自身相关因素主要包括年龄、牙周状态、牙齿形态、牙齿结构等,而治疗相关因素主要包括矫治技术及其过程中矫治力的大小、矫治时间、牙移动方式以及拔牙与否等[15]。牙根吸收作为正畸治疗的主要并发症之一,其主要危害在于降低冠根比而破坏矫治效果,并影响患者口颌功能,造成面目美观感缺陷,因此正畸治疗医师和患者均面临较大的考验[16]。移动性牙根吸收可分为3个等级:表层吸收(牙骨质表面吸收和改建),即吸收仅发生在牙骨质表面,能够快速进行改建和再生;深层吸收(牙本质吸收),即吸收深度已到达牙本质浅层,仅针对吸收陷窝进行牙骨质样物质修复,该修复过程无法使牙根状态恢复正常;根尖吸收,根尖吸收后会引起牙根长度缩短,且无法进行修复[17]。有专家指出牙根吸收可见于大多数正畸患者,并且吸收程度较弱,仅涉及表层吸收,因此可自身完成修复[18]。本研究结果显示,注射尿源性干细胞外泌体后,实验组大鼠牙根表面吸收陷窝体积小于对照组,BV/TV、Tb.Th高于对照组(P<0.05)。说明通过局部注射干细胞可以促进移动性牙根吸收的修复。
BMP-2是BMP家族成员之一,具有极强的骨诱导活性,能够促进牙槽骨细胞增殖再生;BSP是由成骨样细胞分泌的糖蛋白之一,具有促进牙骨质再生的功能;骨保护素和RANKL是破骨细胞调节骨吸收的关键因子,促进破骨细胞凋亡并抑制其分化[19]。BMP-2、BSP的表达上调能够发挥成牙骨质效应,促进牙骨质、牙槽骨增生,与BMP-2在牙根发育过程中发挥的作用类似。BSP作为成骨分化成熟的重要标志物之一,在牙周修复中的新生牙槽骨和牙骨质中均有表达,与BMP的表达水平一致[20]。BMP属于转化生长因子 β超家族的重要成员,具有诱导软骨内成骨、胚胎发育、骨骼生长重建及再生等作用,其中BMP-2是最主要的功能蛋白之一。目前研究表明,BMP-2能够诱导牙囊细胞表达成骨细胞特异性转录因子2、碱性磷酸酶、骨钙素和BSP等相关基因,促进成骨/成牙骨质细胞向分化,从而引起牙槽骨、牙骨质和牙周韧带的再生[21];与其他转化生长因子一样,BMP-2能够诱导 Smad 信号传导通路等激活和核内转录,而这些信号传导完全不同于 Wnt/β-肌动蛋白信号通路,但可能与其协同促进成骨/成牙骨质形成[22]。Zhang等[23]发现,BMP-2 能够通过刺激低密度脂蛋白受体相关蛋白5 的表达来抑制 β-肌动蛋白的磷酸化,促进 β-肌动蛋白在前成骨细胞/成骨细胞中积累,从而促进成骨细胞分化,β-肌动蛋白的缺失导致 BMP-2 介导的成骨效应减弱。本研究结果还显示,实验组的BMP-2、BSP表达水平均高于对照组(P<0.05),两组的骨保护素、RANKL表达水平差异无统计学意义(P>0.05)。提示尿源干细胞外泌体可促进移动性牙根吸收的修复,促进牙骨质再生,并且不会导致破骨细胞过度凋亡,但关于尿源干细胞外泌体可能促进移动性牙根吸收修复的具体机制还需进一步探究。
综上所述,尿源性干细胞外泌体可促进移动性牙根吸收的修复,有效改善牙槽骨密度,并上调磨牙及其周围牙槽骨组织中BMP-2、BSP表达水平上调,从而诱导牙周细胞的增殖分化。

