山苍子油对斜纹夜蛾细胞增殖和凋亡的影响
李湘洲,王力群,黄露,周军,张胜,李文生,3
(1.中南林业科技大学材料科学与工程学院,湖南长沙 410004;2.中南林业科技大学南方林业生态应用技术国家工程实验室,湖南长沙 410004;3.湖南大学化学化工学院,湖南长沙 410082)
山苍子Litsea cubeba(Lour.)Pers.,又名山鸡椒、木姜子、黑木姜子、香叶等,多年生落叶小乔木,樟科木姜子属植物,广泛分布于长江以南的各个省区,是我国南方特有的香料植物资源之一.山苍子油是从山苍子果实的果皮中提取的主要由单萜和倍半萜类化合物组成的精油,其主要成分为柠檬醛,同时还含有柠檬烯、甲基庚烯酮、芳樟醇、α-松油醇、香叶烯、α-蒎烯、β-蒎烯、桧萜和石竹烯等[1-2].研究发现山苍子油具有较好的生物活性,如抑菌活性、抗炎活性、抗癌活性、抗氧化活性等[3-7].Liu 等[8]研究了山苍子油对雌性埃及伊蚊具有良好的驱避活性;Park 和Chen等[9-10]报道了山苍子油对赤拟谷盗、玉米象成虫、谷蠹成虫和长角扁谷盗成虫显示较强的驱避和触杀作用;Vong 等[11]报道了山苍子油对伊蚊和库蚊均具有一定的驱避活性.
山苍子油中主要成分柠檬醛的含量一般达到60%以上[12].柠檬醛[13]是由顺、反两种几何异构体香叶醛(反式)和橙花醛(顺式)以混合的形式存在于自然界中.大量文献研究表明,柠檬醛对昆虫具有趋避活性,如柠檬醛对蚕蛾具有引诱作用,能使埃及伊蚊卵不能正常孵化[14].柠檬醛对玉米象和绿豆象均具有较高的熏死率[15].在空气中,当柠檬醛浓度达到2.2 mg/mL 时,两天内可以使白蚁全部死亡[16].
斜纹夜蛾,Spodopdera litura,东南亚广泛分布的害虫之一,可对大豆、棉花和蔬菜等作物产生极大的危害.目前防治这类虫害的主要手段依然为使用化学药剂,但化学药剂使用过多不仅会对环境造成污染,强化害虫的抗药性,而且还会对农作物品质造成不良影响[17].
与传统化学农药[18-19]相比,植物源农药[20-22]由于有效成分为天然物质,因此具有施用后较易分解、对环境影响小、组分多元化以及不容易使施用害虫产生抗药性、对有益生物(即害虫天敌)相对安全等优势,是新型、高效、无残留、无公害的“绿色农药”.从植物源山苍子中提取得到的活性物质可以对一些害虫进行灭杀.
利用离体昆虫细胞代替活体进行毒力测定是一种直接反映化合物毒性作用的检测方法.本文通过CCK、MTT 法研究山苍子油抑制SL 细胞的活性,利用流式细胞术研究山苍子油对离体SL 细胞凋亡的影响.采用气相色谱-质谱联用(GC-MS)技术对山苍子油的主要化学成分进行分析,同时利用流式细胞术进一步研究了山苍子油中主要成分柠檬醛对SL细胞凋亡的作用.论文力图从细胞水平层面探究山苍子油对离体昆虫细胞的毒杀活性,并初步确定山苍子油毒杀昆虫细胞的主要活性成分,为山苍子油基新型植物源农药的开发与利用提供科学依据.
1 材料及方法
1.1 材料与仪器
供试细胞:斜纹夜蛾细胞,上海哈灵生物科技有限公司提供;并添加昆虫细胞培养基,于28 ℃孵育箱中常规培养.
供试试剂及仪器:山苍子油、柠檬醛,产于湖南省永顺县,其中山苍子油为水蒸气蒸馏法提取,通过减压精馏法精制得到,其柠檬醛含量大于96%;鱼藤酮、胎牛血清、青链霉素、胰酶消化液、CCK 试剂、MTT 试剂、Annexin V-FITC-PI 双染试剂盒,均购自上海生物科技有限公司.
BC-J80S 型CO2细胞培养箱,上海喆图生物有限公司;AE2000 型倒置显微镜,上海光学生物仪器公司;TDL-5 型低速离心机,沧州双营建筑仪器设备有限公司;HBS-1096C 型酶标仪,上海沛欧分析仪器有限公司;流式细胞仪,上海仪检测科技有限公司.
1.2 方法
1.2.1 CCK 法检测山苍子油对SL 细胞存活的影响
取对数生长期生长状态良好的SL 细胞,收集上层培养液,培养瓶用PBS 洗涤1 次,弃去PBS,加入1 mL 胰蛋白酶-EDTA 静置消化1 min,于显微镜下观察消化完全后弃去胰酶,加入含10%的胎牛血清的培养基终止消化,吹打收集细胞.1 200 r/min 离心5 min 后,计数,调节细胞密度为5×104个/mL 分别接种于96 孔每孔100 μL,恒温箱中于28 ℃,过夜.用二甲基亚砜(DMSO)溶解山苍子油,在实验前用培养基稀释至山苍子油浓度分别为0、0.001%、0.005%、0.01%、0.05%、0.1%、0.5%体积比,按各分组加入不同浓度的山苍子油,每孔终体积为150 μL.每24 h后取出1 块96 孔板,每孔中避光加入CCK 溶液15 μL,37 ℃继续孵育4 h,酶联检测仪检测波长为450 nm 处吸光度(OD),记录数据,按式(1)计算细胞存活率.

1.2.2 MTT 检测山苍子油对SL 细胞增殖能力的影响
用胰酶消化收集对数期SL 细胞,调整各组细胞悬液浓度至5×105cell/mL;取1 块96 孔板,每孔加入100 μL 细胞悬液,铺板使待测细胞为2×104cell/孔(边缘孔用无菌PBS 填充以消除边缘效应),每组设置5 个复孔;5% CO2,37 ℃培养箱继续培养过夜后,用DMSO 分别溶解山苍子油和鱼藤酮,实验前用培养基溶液分别将山苍子油浓度稀释至0 %、0.005%、0.01%、0.015%、0.02%、0.025%体积比,鱼藤酮质量浓度稀释至30、60、100 μg/mL,按分组加入所需试剂至每孔终体积为150 μL.每24 h 后取出96孔板检测,移除培养基,每孔加入100 μL 含10%MTT 溶液培养基,继续培养4 h,小心吸去孔内培养液,每孔加入100 μL 的DMSO,使结晶物充分溶解;加DMSO 后10 min 内,用酶标仪检测各孔波长570 nm 的吸光值.
1.2.3 细胞流式法检测山苍子油对SL 细胞凋亡的影响
细胞准备及药物处理,培养SL 细胞至80%~90%满瓶,收集细胞,以5×105个/瓶的细胞密度接种T25 细胞培养瓶,28 ℃恒温培养箱培养过夜,待细胞密度达80%后,换液,加入不同浓度的山苍子油和鱼藤酮,处理48 h.流式检测用PBS 洗涤各组细胞2 次(1 000 r/min,离心5 min)收集细胞;再加入500 μL的Binding Buffer 悬浮细胞.
1.2.4 山苍子油化学成分的分析
山苍子油经水蒸气蒸馏法提取获得,利用气相色谱-质谱联用对山苍子油的主要化学成分进行分析.
GC 条件:Elite-5MS 分析色谱柱(30 m×0.25 mm×0.25 μm);高纯He 为载气;流速1 mL/min;进样口温度260 ℃;进样量0.5 μL;分流比20 ∶1.
MS 条件:EI 离子源;电离电压70 eV;离子源温度250 ℃;传输线温度280 ℃;m/z 扫描范围30~600.山苍子油升温程序:初温80 ℃,保持3 min,5 ℃/min升温,至100 ℃,保持1 min,10 ℃/min 升温速率升至130 ℃,保持3 min,20 ℃/min 升温速率升至230 ℃,保持6 min;溶剂延迟5 min.
1.2.5 细胞流式法检测柠檬醛对SL 细胞凋亡的影响
按1.2.3 中所述方法验证不同浓度的柠檬醛处理SL 细胞对其的凋亡作用.
1.2.6 数据统计与分析
采用SPSS22.0 软件对试验数据进行统计分析,试验数据以均值±标准差表示,采用P 检验进行显著性分析,*P<0.05 表示差异显著,**P<0.01 表示差异极显著.
2 结果与分析
2.1 CCK 法检测山苍子油对SL 细胞存活的影响
CCK 法所用试剂中含有WST-8 [其化学名称为2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5(2,4-二磺酸苯)-2H-四唑单钠盐],它在电子载体1-甲氧基-5-甲基吩嗪硫酸二(1-Merhoxy PMS)的作用下被细胞线粒体中的脱氢酶还原为具有高度水溶性的黄色甲染料(Formazandye).生成的产物的数量与活细胞的数量成正比,因此可利用这一特性直接进行细胞增殖和毒性分析.
按1.2.1 中所述方法以不同浓度的山苍子油(0%、0.001%、0.005%、0.01%、0.05%、0.1%、0.5%)分别处理SL 细胞,得到不同浓度的山苍子油对SL 细胞存活率的影响,结果见图1.

图1 CCK 法检测山苍子油对SL 细胞存活率的影响Fig.1 Effect of SL cell survival rate on LCEO by CCK method
由图1 可知,山苍子油抑制SL 细胞存活与其处理时间和山苍子油的浓度有关.当处理时间为24 h时,随着山苍子油浓度的增大,SL 细胞的存活率明显降低(P<0.05);当山苍子油浓度增大至0.01%时,SL 细胞的存活率下降至40%;继续增大山苍子油的浓度,SL 细胞的存活率略有降低(P>0.05).当山苍子油浓度一定时,延长处理时间,SL 细胞的存活率也呈下降趋势;山苍子油浓度为0.01%时,其处理SL细胞24 h 和48 h 的细胞存活率分别为40%和30%;而处理72 h 后,SL 细胞的存活率仅为0.9%,呈显著降低的趋势(P<0.01).
2.2 MTT 法检测山苍子油抑制SL 细胞增殖能力的影响
MTT 法是利用活细胞代谢产生琥珀脱氢酶将MTT 还原,且形成不溶于水的蓝紫色甲臜(Formazam)结晶,通过颜色反应观察细胞代谢的活化程度,从而直接检测细胞的活性.
按1.2.2 中所述方法以不同浓度(0%、0.005%、0.01%、0.015%、0.02%、0.025%)的山苍子油分别处理SL 细胞24 h、48 h 后,得到不同浓度的山苍子油对SL 细胞存活率的影响见图2,不同浓度(30 μg/mL、60 μg/mL、100 μg/mL)的鱼藤酮对照组处理SL细胞24h、48h 后,SL 细胞存活率的影响见图3.
由图2 可知,利用MTT 法检测山苍子油对SL细胞存活率的影响与CCK 法的结果类似.当作用时间均为24 h 时,随着山苍子油浓度的增大,SL 细胞的存活率呈下降趋势;当山苍子油浓度为0.015%时,SL 细胞的存活率显著降低(P<0.05);继续增大山苍子油浓度,SL 细胞存活率略有降低(P>0.05).当作用时间延长至48 h 时,随着山苍子油浓度的提高,SL 细胞的存活率也呈下降趋势,当山苍子油浓度为0.01%时,SL 细胞的存活率仅为10%;继续增大山苍子油浓度,SL 细胞的存活率略有下降.
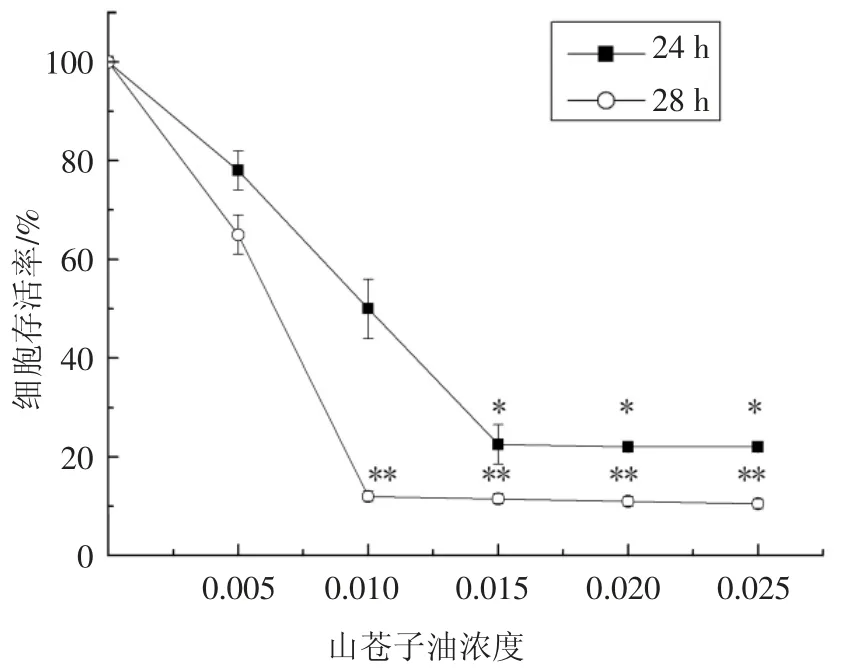
图2 MTT 法检测山苍子油对SL 细胞存活率的影响Fig.2 Effect of SL cell survival rate on LCEO by MTT method

图3 MTT 法检测鱼藤酮对SL 细胞存活率的影响Fig.3 Effect of SL cell survival rate on rotenone by MTT method
鱼藤酮是从豆科植物的根和茎中提取的一种天然毒素,对螨虫、线虫等均具有较好的杀虫活性[23].由图3 可知,鱼藤酮对SL 细胞的增殖也具有抑制作用,抑制效果与其浓度和处理时间有关.对比鱼藤酮和山苍子油抑制SL 细胞的效果可知,0.01%的山苍子油处理SL 细胞后,其抑制SL 细胞的效果优于30 μg/mL 的鱼藤酮,说明山苍子油对SL 细胞的抑制作用较好,研究结果与WEN 等[24]的基本一致.
2.3 流式细胞法检测山苍子油对离体SL 细胞的凋亡作用
在细胞凋亡的早期,细胞膜表面将发生破损,同时细胞内膜的磷脂腺丝氨酸(PS)出现外翻暴露.Annexin V 是相对分子质量为35 000 的Ca2+依赖的磷脂结合蛋白,对PS 具有很高的亲和性,可以与凋亡早期暴露于细胞外的PS 相结合.因此,可以将标记荧光染料的Annexin V 来识别早期的细胞凋亡.通常利用Annexin V-FITC 和碘化丙啶(PI)双染色来区分凋亡和坏死细胞.PI 的膜通透性很差,因而只能标记晚期凋亡和坏死的细胞.在流式细胞仪的结果中可见Annexin V-FITC(+)、PI(-)细胞为凋亡细胞,而Annexin V-FITC(+)、PI(+)为坏死细胞.
按1.2.3 中所述方法以不同浓度的(0、0.005%、0.01%、0.015%、0.02%、0.025%)山苍子油、鱼藤酮(10 μg/mL)处理SL 细胞,得到不同浓度山苍子油、鱼藤酮对SL 细胞的凋亡效果,结果见图4 和图5.
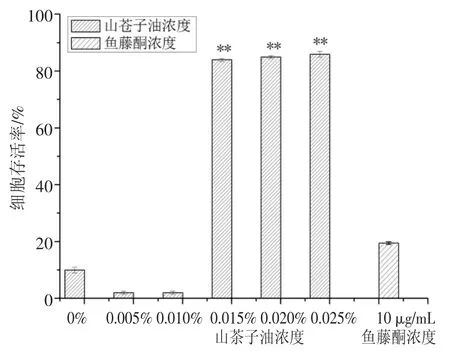
图4 流式细胞法检测山苍子油对SL 细胞凋亡的影响Fig.4 Effect of SL cell apoptosis rate on LCEO by flow cytometry

图5 山苍子油处理SL 细胞的流式细胞凋亡图Fig.5 Apoptosis of SL cells treated with LCEO
由流式细胞检测结果图4 可知,不同浓度的山苍子油(0.005%、0.01%、0.015%、0.02%、0.025%)处理SL 细胞48 h 后,SL 细胞的凋亡率分别为2.36%、2.38%、88.08%、91.50%、93.33%,表明山苍子油具有促进SL 细胞凋亡的作用,且呈剂量正相关,即当山苍子油浓度增大时,SL 细胞的凋亡率亦增大,当山苍子油的浓度从0.01%增大至0.015%时,SL 细胞的凋亡率明显增大(P<0.01).10 μg/mL 的鱼藤酮处理SL 细胞48 h 后,SL 细胞凋亡率仅为18.89%.
2.4 山苍子油的化学成分分析
通过CKK 法、MTT 法和流式细胞法确定了山苍子油对SL 细胞具有促进凋亡的作用,且呈剂量正相关,为确定山苍子油对SL 细胞凋亡的主要活性成分,首先按1.2.4 中所述方法研究了水蒸气蒸馏法提取的山苍子油的化学成分,结果见图6 和表1.

图6 山苍子精油的总离子流图Fig.6 Total ion flow diagram of LCEO

表1 山苍子精油成分分析Tab.1 Composition analysis of LCEO
由检测结果可知,水蒸气蒸馏法提取的山苍子油共分离出43 个组分,经与Nist 标准谱库对照,鉴定出23 个主要的化学成分,占精油中化合物总量的97.98%,其中主要包括单萜、倍半萜及其含氧衍生物,含量较高的组分有香叶醛(35.24%)、橙花醛(33.63%)、柠檬烯(9.05%)、香茅醛(3.14%)、桉树脑(1.84%)、芳樟醇(1.80%)和1-石竹烯(1.64%)等,柠檬醛的含量(香叶醛和橙花醛之和)高达68.87%.
2.5 流式细胞法检测柠檬醛对SL 细胞凋亡的影响
柠檬醛作为山苍子油的主要活性成分,其对昆虫具有趋避活性的研究已有报道[14-16].为验证柠檬醛对SL 细胞的影响,利用1.2.5 中所述的流式细胞法研究了柠檬醛对离体SL 细胞的凋亡作用,结果见图7 和图8.

图7 流式细胞法检测柠檬醛对SL 细胞凋亡的影响Fig.7 Effect of SL cell apoptosis rate on LCEO by flow cytometry

图8 柠檬醛处理SL 细胞的流式细胞凋亡图Fig.8 Flow cytometry of SL cells treated with citral
由图7、8 可知,SL 细胞的凋亡率与柠檬醛浓度呈正相关,不同浓度的柠檬醛(0、0.005%、0.01%、0.015%、0.02%、0.025%)处理SL 细胞48 h 后,SL 细胞的凋亡率分别为2.89%、20.77%、21.89%、24.88%、81.97%、82.63%.当柠檬醛浓度大于0.015%时,SL细胞的凋亡率显著增大(P<0.01),说明柠檬醛作为山苍子油的主要成分,具有促进SL 细胞凋亡的作用,且随柠檬醛浓度的增大,SL 细胞的凋亡率也随之增大.这与Oliveira 等[25]对麦冬草精油及其主成分柠檬醛对草地贪夜蛾的毒理研究结果一致,同时也从细胞水平层面验证了Zhang 等[26]利用柠檬醛熏蒸昆虫的趋避效果.研究初步表明,柠檬醛是山苍子油抑制SL 细胞凋亡的主要活性成分.
3 结论
本文利用CCK、MTT 和流式细胞法分别研究了不同浓度的山苍子油对SL 细胞增殖与凋亡的作用,研究结果表明:不同检测方法得到的结果一致,表明山苍子油具有抑制SL 细胞增殖、诱导细胞凋亡的作用,且呈一定浓度和作用时间的依赖关系.同时进一步采用流式细胞凋亡法检测山苍子油中主要活性成分柠檬醛对SL 细胞增殖与凋亡的作用,初步确定了柠檬醛是山苍子油中诱导SL 细胞凋亡的主要活性成分.
据文献报道鱼藤酮是一种普遍使用的杀虫剂,其分子式为C23H22O6[27].鱼藤酮是一个典型的作用于昆虫的植物源杀虫剂,其进入细胞后会阻断NADH与辅酶Q 之间的电子传导,影响ATP 的生成[28-29].山苍子油对离体细胞的毒杀活性与鱼藤酮的毒杀效果基本一致,但目前关于山苍子油及柠檬醛对离体昆虫细胞毒杀活性的机制尚不明确,有待进一步深入研究.
将诸如山苍子油等传统的林产化工产品应用于害虫防治并开发高效低毒的绿色新农药,为林业资源高效利用和林业产业高质量发展提供了新思路,值得关注并深入研究.

