滚环扩增介导的核酸信号放大策略在生物传感器中的应用研究进展
刘 巨,梁涛波,许恒毅
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
近年来,基于分子生物学的检测技术被广泛应用于生物传感器领域,其中包括PCR(Polymerase chain reaction)技术、滚环扩增(RCA)技术、环介导恒温扩增(LAMP)技术、杂交链式反应(HCR)技术、重组酶聚合酶扩增(RPA)技术和链置换扩增(SDA)技术等。RCA作为一种等温核酸扩增技术,因其具有高效、高保真性、高灵敏度以及能够与各种常见信号输出方法相结合等优点得到了较多关注,并在单核苷酸多态性(SNP)[1]、microRNAs(miRNAs)[2]、酶活性[3]以及病原微生物[4-5]检测等领域有着广泛应用[6]。本文重点阐述了基于RCA结合荧光、比色以及电化学信号输出方式的传感器在生物检测中的应用,综述了RCA技术在生物传感器领域的研究和应用进展,并对其存在的问题和发展前景进行了展望。
1 RCA技术的原理及类型
1.1 RCA技术的原理
自然界中,某些生物(如细菌、噬菌体等)体内会发生环状DNA或RNA分子的滚环复制过程,以此获得相应的DNA或RNA拷贝,RCA就是借鉴这种滚环扩增方式发展的一种体外等温核酸扩增技术[7]。RCA技术始于上世纪90年代中期,已有研究表明,在具有链置换活性的DNA聚合酶作用下,约几十个碱基的单链环状DNA分子可作为DNA合成的模板,产生与环状模板互补的具有重复串联序列的单链DNA分子,产物大小约数百至数万碱基,长度可达数百纳米至微米之间,证实了滚环扩增在体外发生的可行性[8]。RCA反应需要4个组分:①环状DNA模板,称为RCA模板;②与RCA模板部分互补的DNA/RNA引发链;③具有链置换活性的DNA/RNA聚合酶(如Phi29 DNA聚合酶、Bst DNA聚合酶、Ventexo-DNA聚合酶和T7 RNA聚合酶);④脱氧核糖核苷三磷酸(dNTPs)。RCA模板通常是一条15~200个碱基的单链DNA分子,在DNA连接酶(如T4 DNA连接酶或Taq DNA 连接酶)和一条与模板的5’端和3’端部分互补的单链引物的作用下,模板DNA的5’磷酸端(5’-P)与3’羟基端(3’-OH)连接环化,以形成的环状模板用于后续扩增[9]。环状模板的扩增依赖于具有链置换和持续合成活性的DNA聚合酶,以Phi29 DNA聚合酶和Bst DNA聚合酶最为常用。其中,Phi29 DNA聚合酶来源于枯草芽孢杆菌(Bacillussubtilis)噬菌体phi29,其相对分子质量为66 kDa[10]。在其最适温度30 ℃左右,Phi29 DNA聚合酶具有强大的5’-3’聚合活性和3’-5’外切酶活性,在20 min内可产生大于70 kbp的扩增子,其扩增灵敏度可达到单分子拷贝,且由于其具有3’-5’外切酶活性,能够对合成的单链序列进行校对,保真度较高[11]。Bst DNA聚合酶编码基因含有来自嗜热脂肪芽孢杆菌(Bacillusstearothermophilus)DNA聚合酶的基因和外源的麦芽糖结合蛋白(Maltoes-binding protein,MBP)基因,通过体外表达得到具有5’-3’聚合活性,但无3’-5’外切酶活性的Bst DNA聚合酶[12]。相比于Phi29 DNA聚合酶,Bst DNA聚合酶具有更高的热稳定性和更强的持续合成能力同样被广泛应用于LAMP和RCA实验,但因为缺乏3’-5’外切酶活性,其保真度较Phi29 DNA聚合酶略低。
1.2 RCA技术的类型
在进行RCA实验之前,通常需要先获得一条环状的RCA模板。根据RCA模板环化方式的不同,可将其分为锁式DNA(Padlock DNA)环化、哑铃DNA(Dumbbell DNA)环化以及类哑铃DNA(Dumbbell-like DNA)环化3种类型(如图1A)[13-14]。通过在一条DNA链或两条DNA链内形成局部双链的结构,在T4 DNA连接酶或Taq DNA连接酶的作用下催化连接双链DNA中单链切口的5’和3’两末端,或者催化连接两条双链DNA片段的5’和3’两末端,形成环状的DNA分子[15]。在RCA实验中,RCA模板的环化是进行后续RCA的重要步骤,通过预先设计,RCA体系中的环化步骤能够作为识别组件,实现对目标物的特异性识别。
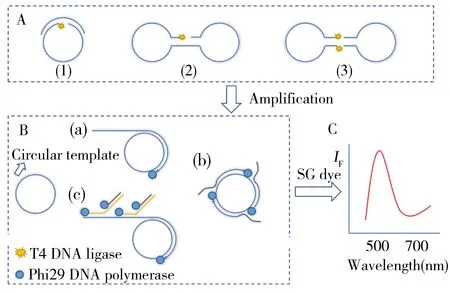
图1 常见RCA模板环化方式及RCA扩增方式Fig.1 Common circularization and amplification methods of RCA A:common circularization methods of RCA,(1) padlock DNA;(2) dumbbell DNA;(3) dumbbell-like DNA.B:common amplification methods of RCA,(a) single-primer RCA;(2) multi-primers RCA;(c) exponential RCA.C:signal output step of RCA,SG dye=SYBR Green dye(A:常见RCA模板环化方式,(1)锁式DNA环化;(2)哑铃DNA环化;(3)类哑铃DNA环化。B:常见RCA扩增方式,(a)单引物RCA;(b)多引物RCA;(c)指数RCA。C:RCA实验的信号输出步骤,SG dye=SYBR Green dye)
RCA技术可大致分为单引物RCA(Single-primer RCA)、多引物RCA(Multi-primers RCA)和指数RCA(Exponential RCA),如图1B。单引物RCA也称线性RCA,是指单一引物作为引发链,在具有链置换活性的DNA聚合酶的作用下,引发链沿环状的RCA模板延伸,上游产物则在延伸过程中被反复置换,以此产生与模板互补的具有串联重复序列的单链DNA分子[6]。这种延伸在dNTPs充足的条件下可以不断进行,产生长度是模板几百或几千倍的单链DNA拷贝[16]。多引物RCA则是在线性RCA原理的基础上,额外加入一条或多条仅与环状模板序列互补配对的短单链引物作为引发链,即在滚环扩增反应中,环状模板可与多对引物结合进行扩增,扩增产物被DNA聚合酶不断置换,产生多条RCA产物,提高了环状模板的利用效率,其扩增效率是线性RCA的数倍[2]。指数RCA,也称超分支RCA(Hyperbranched rolling circle amplification,HRCA),指通过在线性RCA体系中额外加入多对引物,这些引物既能和线性RCA产物进行结合并延伸,延伸得到的DNA链又可与另一条次级引物结合,实现指数扩增,产生大量长短不一的单链及双链产物,扩增效率大大提高,因此被广泛应用于各种对灵敏度要求较高的检测传感器[8,17]。图1C为RCA信号的输出方式示例。
2 基于RCA的生物传感器在生物检测中的应用
RCA技术因其扩增快速、模板序列可设计、扩增子分子量大以及保真度高等优点,被广泛应用于DNA克隆、基因组分析、DNA纳米结构构建以及生物传感器等领域[18]。本文重点介绍基于RCA的生物传感器在生物检测中的应用。RCA作为一种信号扩增技术,可与多种信号输出方式相结合,实现对待检物的荧光、比色或电化学检测。在前期研究中,本实验室探讨并建立了基于RCA的荧光及比色传感器用于检测食源性致病菌[19-20],所研究的传感器利用不对称PCR(Asymmetric PCR)或核酸适配子实现了“菌体-单链DNA”的信号转导,并利用RCA产物形成能够与特异性染料结合的DNA二级结构,所设计的两种传感器具有信噪比高和特异性强等优点,实现了对食源性致病菌的快速灵敏检测。近年文献报道的基于RCA介导的核酸信号放大策略在生物传感器中的应用总结于表1。
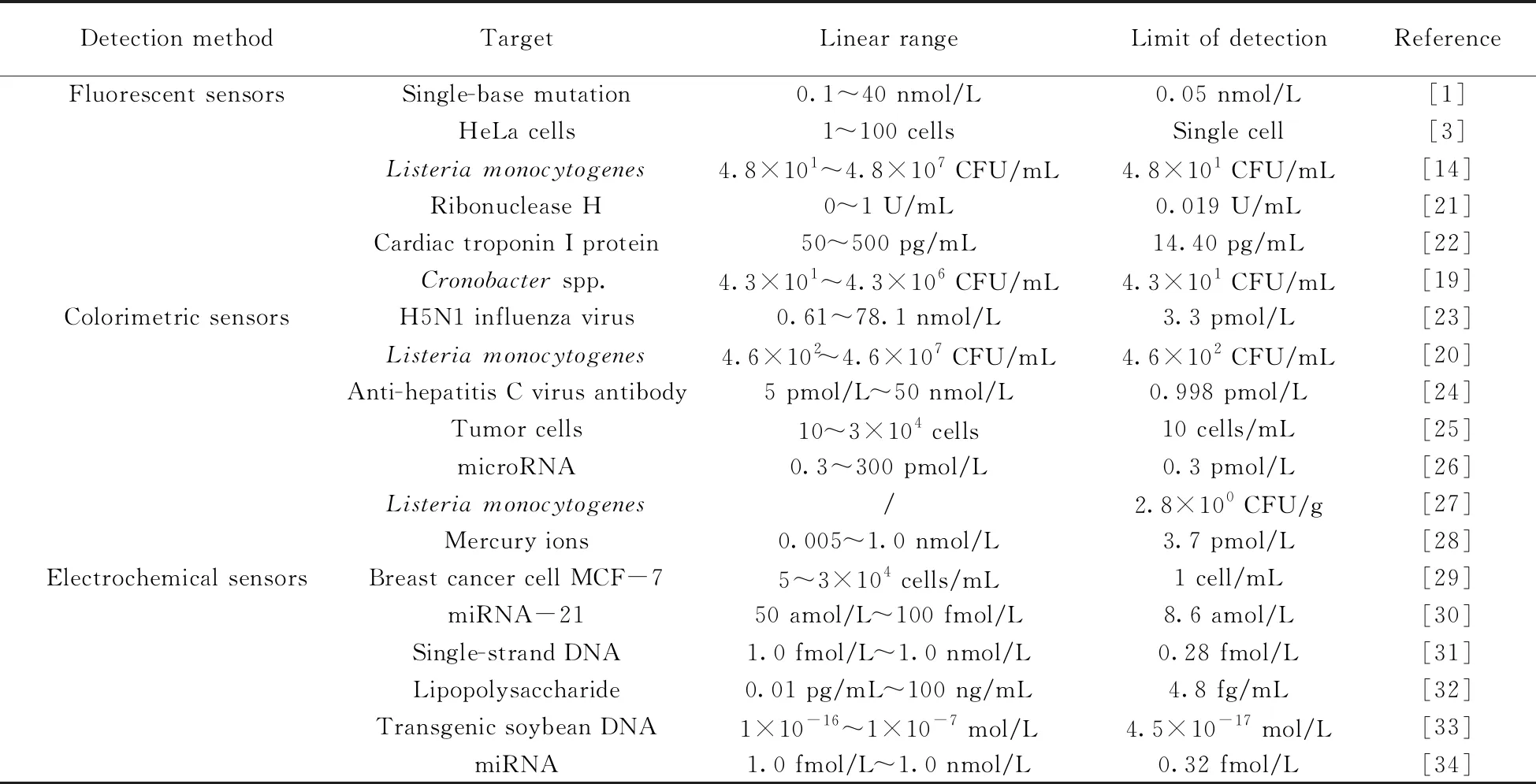
表1 RCA介导的核酸信号放大策略在生物传感器中的应用Table 1 Application of the biosensors based on RCA nucleic acid signal amplification strategy in biological detection
2.1 基于RCA的荧光生物传感器
荧光生物传感器借助于荧光的增强、猝灭或者发射波长的移动实现对荧光物质的检测。RCA产物(单链或双链DNA)可以与各种核酸荧光染料(SYBR Green Ⅰ、SYBR Green Ⅱ等)结合,实现对扩增产物的实时或终点检测。基于RCA的荧光生物传感器具有灵敏度高的特点,但由于荧光易被猝灭的特性以及需要昂贵的检测仪器,该技术并不利于即时检测(Point-of-care testing,POCT)。Li等[1]采用锁式探针对待检DNA单链进行特异性识别,预先设计的锁式探针能与含有突变碱基的DNA单链特异性结合并在连接酶的作用下环化,投入的RCA引物可与得到的环状模板结合,发生RCA。通过投入SYBR Green Ⅰ 对RCA的双链产物进行染色,实现对待检物的荧光检测,其检测限为0.05 nmol/L。该方法利用锁式探针实现目标物的特异性识别,再引入RCA对信号进行放大,只需荧光读数仪既可实现信号的读取。基于G-四链体(G-quadruplexes)结构的RCA实验具有设计简单、信噪比高等优点,被广泛应用于各类RCA实验。Li等[3]建立了一种检测端粒酶的荧光传感器,该传感器利用端粒酶能够延伸特定碱基序列的特性,设计了相应的端粒酶引物和锁式探针。当待检物端粒酶存在时,锁式探针的环化和后续的RCA才能成功进行,在RCA产物上形成大量重复的G-四链体结构,体系内的Thioflavin T能够与G-四链体特异性识别并使得自身荧光大大增强,以此实现对待检物的荧光检测,该方法的检测限达到了单细胞水平。Lee等[21]设计了一种基于环状探针和DNA/RNA复合引物检测核糖核酸酶H(Ribonuclease H)的传感器,核糖核酸酶H能够特异性识别并水解复合引物中氨基修饰的RNA序列,从而暴露出引物3’羟基端,使得引物能够引发滚环扩增,该方法的检测限为0.019 U/mL,线性范围为0~1 U/mL,检测时间<5 min。本实验室设计了一种基于RCA的PCR-RCA荧光传感器用于检测克罗诺杆菌属[19],采用不对称加尾PCR从克罗诺杆菌属基因组DNA中扩增得到带有聚胸腺嘧啶(Poly-T)尾巴的单链DNA,再投入预先成环的哑铃DNA,带尾的单链DNA能够与哑铃DNA结合,引发RCA,在RCA产物上形成大量重复的G-四链体结构,通过投入ThT与G-四链体结合,即可实现对克罗诺杆菌属的荧光检测。该方法在纯培养液中对克罗诺杆菌属的检测限为4.3×101CFU/mL,线性范围为4.3×101~4.3×106CFU/mL,相比于直接采用非特异性的SYBR Green 染料对RCA产物进行染色的方法,该方法的信噪比较高,检测灵敏度得到了提高。
2.2 基于RCA的比色生物传感器
比色生物传感器信号来源于体系颜色的变化,与荧光传感器相比,比色传感器无需或只需较为简便的仪器即可实现信号读取,因此广泛应用于即时或现场检测。但比色生物传感器由于颜色读取易受到基质干扰,其灵敏度相较于荧光生物传感器略低。在前期研究中,本实验室设计了一种基于RCA和适配子的半固相比色传感器[20],该方法采用ELISA与RCA相结合,通过适配子特异性识别并结合待检物单增李斯特菌细胞,暴露出来的单链DNA能够与环状探针特异性结合并发生RCA,得到大量能够与修饰有辣根过氧化物激酶(Horseradish peroxidase,HRP)的DNA探针互补配对的结合位点,HRP催化体系中的TMB(3,3′,5,5′-Tetramethylbenzidine)发生显色反应,通过裸眼或吸光度可测定相应的比色结果。该方法利用了RCA原位生长的特点与ELISA实验结合,具有操作简便、检测时间短等优点,其在纯培养液中的检测限为4.6×102CFU/mL。Hamidi等[23]建立了一种基于RCA的pH响应的比色传感器。由于RCA体系中的dNTP会随扩增不断释放产生大量的副产物H+,通过向体系中加入pH指示剂酚红,可指示其是否发生RCA,实现裸眼检测。利用该方法对流感病毒H5N1进行检测,得到的检测限为3.3 pmol/L,检测时间仅需20 min。该实验操作简便,检测时间短,在现场检测中有较好的应用前景。Gao等[24]通过在丙肝病毒抗体上修饰DNA单链作为引发RCA的引物,得到的RCA产物形成大量G-四链体结构,体系中的Hemin与G-四链体形成具有催化活性的复合物,催化TMB显色,实现比色检测,其裸眼检测限为0.998 pmol/L。该方法利用DNA修饰的抗体,实现了“病毒衣壳-单链DNA”的信号转导,通过单链DNA引发RCA实现信号放大,具有较好的实际应用前景。Hu等[26]利用金纳米粒子聚集变色的原理,设计了一条锁式探针与目标miRNA进行特异性识别并环化,环化的探针随后发生RCA,产生大量长的单链RCA产物,金纳米探针上修饰的DNA链可与RCA产物互补配对,从而拉近探针之间的距离,引起颜色变化。该方法对let-7a的检测限为0.3 pmol/L,检测线性范围为0.3 ~300 pmol/L。RCA扩增产物既可与修饰有互补DNA的金纳米探针结合,促进金纳米粒子的聚集,也可作为单链DNA抑制高浓度盐离子环境下金纳米粒子的聚集。
2.3 基于RCA的电化学生物传感器
电化学生物传感器是一种将生物敏感元件如DNA、蛋白质等与电化学换能器相结合的分析装置,具有操作简单快速、灵敏度高、重现性好的优点。RCA因其原位扩增的特点,相较于其他分子扩增技术更适合应用在基于半固相或固相载体的检测传感器中。Shen等[29]采用适配子结合被抗体捕获的循环肿瘤细胞并引发RCA,形成的大量DNA分子与钼酸盐反应生成氧化钼磷,并产生电化学信号,该方法的检测限达到了单细胞水平,检测线性范围为5 ~3×104cells/mL。Zhang等[30]建立了一种基于RCA介导的纳米钯电化学传感器用于检测miRNA,RCA产生的富G序列单链能够作为模板介导钯纳米粒子的原位合成,从而产生电信号,应用该方法检测miRNA-21的检测限为8.6 amol/L,线性范围为50 amol/L~100 fmol/L。该方法利用RCA原位生长的特点,以RCA产物为模板实现了钯纳米粒子的原位合成,其电信号得到了显著增强。RCA技术具有模板可设计的优点,少量的RCA模板通过扩增可以得到大量具有特定功能的DNA序列,体现了RCA技术的简便性。Wang等[31]利用RCA产生大量具有催化活性的DNA walker酶,通过酶的催化剪切作用释放金电极表面的信号分子,从而实现电化学信号输出,该方法的检测限达0.28 fmol/L,检测线性范围为1.0 fmol/L~1.0 nmol/L。Xie[32]等通过在金电极上修饰适配子实现了对目标物脂多糖的特异性识别,再通过投入负载有适配子和RCA引物的金纳米粒子与识别的脂多糖形成夹心结构,引物与体系中的环状模板结合并引发RCA,得到的聚胸腺嘧啶(Poly-T)RCA产物可以作为模板,实现铜纳米粒子的原位生长,显著增强了输出的电阻抗信号,实现了脂多糖的灵敏检测。该方法的检测限为4.8 fg/mL,线性范围为0.01 pg/mL~100 ng/mL。
3 总结与展望
近年来,等温核酸扩增技术因其等温以及高效的特性,被广泛应用于生物传感器领域,而在多种等温核酸扩增技术中,LAMP技术和RCA技术得到了较多的关注。尽管LAMP技术具有反应快速、灵敏度高等优点,但同样也具有引物设计复杂,对靶序列长度要求较高(<300 bp)以及容易受到污染等缺点。相比于LAMP技术,RCA技术则具有独特的优势,包括探针设计简单,核酸原位生长有利于设计基于半固相的生物检测芯片以及适合高通量检测等,被广泛用于生物传感器的设计和应用。RCA作为一种高效的核酸扩增技术被广为应用的同时,依然存在一些问题有待研究和改进:①在RCA扩增之前,环状模板只能通过锁式探针、哑铃DNA环化以及类哑铃DNA环化的方式获得,锁式探针在环化过程中的特异性依赖于探针与互补链的结合,特异性不高、未成环的探针可能会提高背景信号,对检测灵敏度造成很大影响;哑铃DNA环化以及类哑铃DNA环化方式虽然产生背景信号的可能性较小,但因其环化效率低,在环化过程中需要过量的核酸原料,显著增加了实验成本;②RCA技术虽能在短时间内实现核酸的恒温扩增,但仍需要数小时的反应时间,不利于进一步应用;③RCA实验需要昂贵的修饰探针和相关连接酶及聚合酶,检测成本偏高。因此,RCA技术还需在实验设计、时间成本以及经济成本方面进行改进。在建立基于RCA的检测方法前,应考虑不同的实际检测情况,选择最佳的成环方式;通过研究开发更为高效廉价的RCA聚合酶,进一步缩短RCA反应时间,是未来RCA技术的研究重点之一。此外,利用RCA技术构建DNA纳米结构作为信号载体,如负载有信号探针的DNA纳米花和纳米管等,是RCA技术在生物检测领域发展的新方向,具有较好的应用前景。随着技术的不断发展和创新,RCA作为一种高效的等温核酸扩增技术,必将得到更为广泛的关注和应用。

