基于UPLC-MS/MS的2型糖尿病患者血清胆汁酸代谢产物分析
陈冰婷,伊丽则热·艾拜杜拉,李德龙,马晓丽
(新疆医科大学 药学院,新疆 乌鲁木齐 830011)
目前,2 型糖尿病(Type 2 diabetes mellitus,T2DM)等代谢性疾病正在全世界范围内爆发[1-2]。作为一种慢性疾病,其呈现逐年激增及低龄化发病趋势,严重危害公众健康。糖尿病的具体发病机制尚未完全阐明,除高血糖外,脂质代谢紊乱,炎症、氧化应激等亦是重要因素[3]。所以对其有效防治具有重要意义。
作为流行且复杂的内分泌和代谢性疾病[4-6],T2DM的有效筛查、诊断、预后和干预具有挑战性[7]。胆汁酸(BAs)作为一种内源性信号分子在T2DM环境下发生改变,可影响相关代谢途径,进一步影响糖代谢和胰岛素分泌,可能与T2DM的发生、恢复有关[8-10]。多个研究已证明,在2型糖尿病患者中,BAs的特征表现出显著变化[11-14]。由于BAs具有化学均一性、浓度范围宽和残留高的特性,使得开发一种高准确度和精密度的可靠快速的分析方法具有挑战性[15]。在过去的10年中,使用液相色谱-串联质谱(LC-MS/MS)对BAs进行量化的方法有所增加[16-19]。目前运用超高效液相色谱-串联质谱(UPLC-MS/MS)针对胆汁酸代谢谱进行疾病诊断与治疗属于较为先进的技术手段。本实验所采用的平行反应监测(PRM)技术是一种基于高分辨、高精度质谱的离子监视技术,相比于传统的单/多反应监测(SRM/MRM)技术,PRM技术将采集二级质谱信息所用的四极杆质量分析器替换为更高分辨和质量精度的分析器,实现了从对目标离子检测到全部目标离子碎片检测的转化,具有更高的再现性和定量准确度[20]。
本研究首次从胆汁酸代谢谱分析角度出发,基于UPLC-MS/MS 定量代谢检测平台,建立了血清中41种胆汁酸的定量检测方法。将其应用于糖尿病患者及正常志愿者血清胆汁酸谱的检测,并采用多元统计分析研究糖尿病患者与正常志愿者体内的胆汁酸代谢差异,寻找糖尿病患者和健康对照者的潜在生物标志物,从而为糖尿病发病及机理研究提供新的思路。
1 实验部分
1.1 试剂与仪器
甲醇、乙腈、乙酸(LC-MS级,CNW Technologies);41种胆汁酸标准品(上海甄准生物科技有限公司):脱氢石胆酸(DHLCA)、别石胆酸(alloLCA)、异石胆酸(isoLCA)、石胆酸(LCA)、23-脱甲脱氧胆酸(23norDCA)、7-酮基石胆酸(7-ketoLCA)、12-酮基石胆酸(12-ketoLCA)、原胆酸(apoCA)、熊去氧胆酸(UDCA)、猪脱氧胆酸(HDCA)、鹅脱氧胆酸(CDCA)、脱氧胆酸(DCA)、异脱氧胆酸(isoDCA)、脱氢胆酸(DHCA)、7,12-二酮石胆酸(7,12-diketoLCA)、6,7-二酮石胆酸(6,7-diketoLCA)、7-酮脱氧胆酸(7-DHCA)、12-脱氢胆酸(12-DHCA)、3-脱氢胆酸(3-DHCA)、熊果胆酸(UCA)、α-鼠胆酸(α-MCA)、β-鼠胆酸(β-MCA)、λ-鼠胆酸(λ-MCA)、别胆酸(ACA)、胆酸(CA)、甘氨石胆酸(GLCA)、甘氨熊脱氧胆酸(GUDCA)、甘氨猪脱氧胆酸(GHDCA)、甘氨鹅脱氧胆酸(GCDCA)、甘氨脱氧胆酸(GDCA)、甘氨脱氢胆酸(GDHCA)、甘氨-λ-鼠胆酸(GλMCA)、甘氨胆酸(GCA)、牛磺石胆酸(TLCA)、牛磺熊脱氧胆酸(TUDCA)、牛磺猪脱氧胆酸(THDCA)、牛磺鹅脱氧胆酸(TCDCA)、牛磺脱氧胆酸(TDCA)、牛磺-α-鼠胆酸(T-α-MCA)、牛磺-β-鼠胆酸(T-β-MCA)、牛磺胆酸(TCA);牛磺鹅脱氧胆酸(TCDCA-[D4],内标物)。
超高效液相色谱仪(1290 Infinity series UHPLC System,美国Agilent公司);Q Exactive Focus高分辨质谱、Heraeus Fresco17离心机(美国Thermo Fisher Scientific);BSA124S-CW天平(德国Sartorius公司);JXFSTPRP-24研磨仪(上海净信科技有限公司);纯水仪(明澈 D24 UV,美国Merck Millipore公司);PS-60AL超声仪(深圳市雷德邦电子有限公司)。
1.2 样品采集与预处理
本研究所用80例血清样本来自新疆医科大学药学院药理教研室2007~2010年在和田地区、库车县、塔城地区的流行病学调查。随机抽取30名2型糖尿病志愿者,50名正常志愿者作为对照组,其中糖尿病组30例,年龄(54±5)岁;对照组50例,年龄(49±5)岁。根据2006年WHO公布的糖尿病诊断标准诊断,并注意年龄、性别、种族、并发症、病程的匹配和排除药物的影响。
采集早餐前空腹静脉血并离心(3 000 r/min,10 min),分离血清,保存于-80 ℃冰箱中待测。样本采集经新疆医科大学伦理委员会通过,研究对象均填写知情同意书。
1.3 UPLC-MS/MS测定条件
色谱条件:色谱柱:Waters ACQUITY UPLC BEH C18(150 mm×2.1 mm,1.7 μm,美国Waters公司);柱温:45 ℃,样品盘:4 ℃;流动相:0.05%乙酸水溶液(A)-乙腈(B)。洗脱梯度:0~10 min,75%~71%A;10~26 min,71%~32.5%A;26~26.2 min,32.5%~1%A;26.2~28.4 min,1%~75%A。流速:0.40 mL/min;进样体积:3 μL。
质谱条件:采用电喷雾离子源(ESI),以PRM模式进行质谱分析。离子源参数如下:喷雾电压:-3 100 V,鞘气(氮气)压力:40 V,辅助气体(氮气)压力:15 V,辅助气体(氮气)温度:350 ℃,毛细管加热温度:320 ℃。
1.4 血清中胆汁酸的UPLC-MS/MS分析
采用标准曲线定量时加入内标的方法对整个处理步骤进行校正。
1.4.1 标准溶液的UPLC-MS/MS分析准确称取相应量的胆汁酸标准品于10 mL容量瓶中,加入牛磺鹅脱氧胆酸(内标物) 62.5 nmol/L,分别配制成10 mmol/L的标准品储备液。取相应量的标准品储备液于10 mL容量瓶中,配制成混合标准溶液。依次稀释该混合标准溶液得到一系列校准溶液。
1.4.2 血清样品的UPLC-MS/MS分析吸取100 μL血清样品于EP管中,加入400 μL提取溶剂甲醇-乙腈(体积比1∶1,含1%甲酸和62.5 nmol/L内标物),涡旋混匀30 s,于冰水浴下超声5 min,在20 ℃下静置1 h,4 ℃下12 000 r/min离心15 min,取75 μL上清液至进样小瓶,用于UPLC-MS/MS分析。根据各标准品和内标色谱峰面积的比值,通过标准曲线的线性回归方程计算各胆汁酸的浓度。
1.5 方法学研究
1.5.1 标准曲线对“1.4.1”制备的一系列校准溶液进行UPLC-MS/MS分析。以目标化合物与内标的峰面积比为Y,目标化合物的浓度为C(nmol/L),采用最小二乘法进行回归分析,权重设为1/C时,校准溶液的回收率和相关系数(r2)最好。若某一校准浓度的信噪比(S/N)接近或小于20,或回收率超出80%~120%范围,则将该校准浓度排除。
1.5.2 检出限及定量下限将校准溶液依次稀释2倍后进行UPLC-MS/MS分析,通过信噪比计算方法的检出限和定量下限。方法检出限(LOD)定义为信噪比为3时所对应的化合物浓度,方法定量下限(LOQ)定义为信噪比为10时所对应的化合物浓度。
1.5.3 精密度由41种胆汁酸标准品混合制成质量控制(QC)样品,取QC样品重复进样分析8次,计算目标化合物的相对标准偏差(RSD)。
1.5.4 准确度将QC样品所得峰面积分别代入标准品的标准曲线计算其实际浓度,以QC样品实测浓度与理论加标浓度的比值计算方法回收率。
1.6 血清胆汁酸代谢谱分析与数据处理
取30例糖尿病患者和50例正常人血清样本,应用所建立的方法对样品中41种胆汁酸进行检测,共检出29种胆汁酸。
对原始数据进行处理,保留12个胆汁酸代谢物峰,利用R语言进行多元变量模式识别分析。采用正交偏最小二乘法-判别分析(OPLS-DA)进行统计分析,鉴别引起差异的主要变量,获得糖尿病组与正常人之间血清胆汁酸代谢谱的差异。在验证原模型适合后续分析后对差异代谢物进行识别,并进行受试者工作特征(ROC)分析以寻找潜在的生物标志物。
2 结果与讨论
2.1 血清中胆汁酸的UPLC-MS/MS分析
进行UPLC-MS/MS分析之前,将目标化合物标准溶液引入质谱中。针对每个目标化合物,对其PRM参数进行优化;由于大多数胆汁酸类化合物的子离子谱中未出现强度足够用于定量的子离子,因此选择高分辨条件下的母离子Q1进行定量。41种胆汁酸标准品与内标物的保留时间及质谱条件见表1,在30 min内可完成定量检测。图1为血清样品的提取离子色谱图。
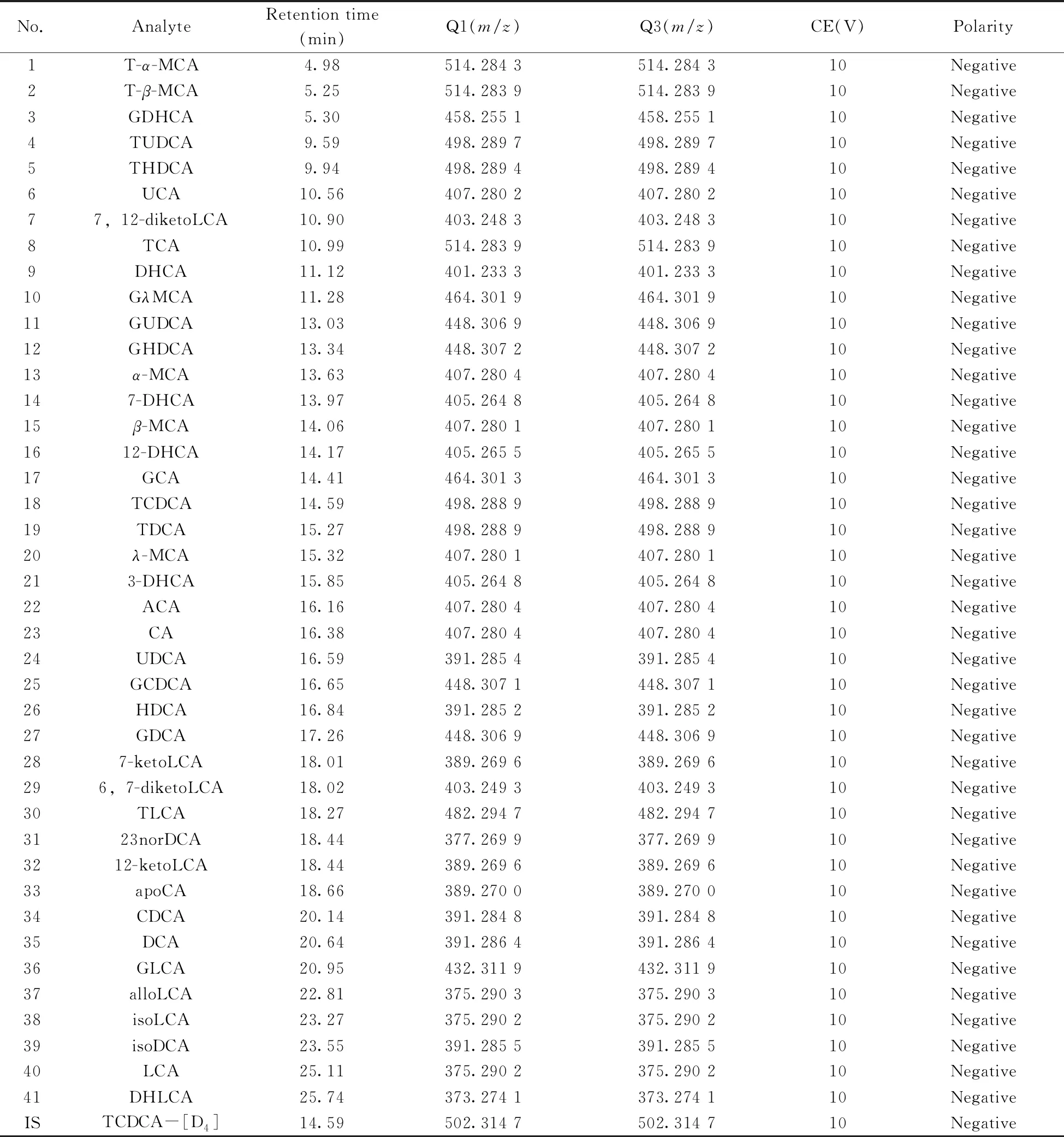
表1 41种胆汁酸标准品的保留时间和质谱条件Table 1 The retention times and mass spectrometric conditions of 41 bile acid standard solutions
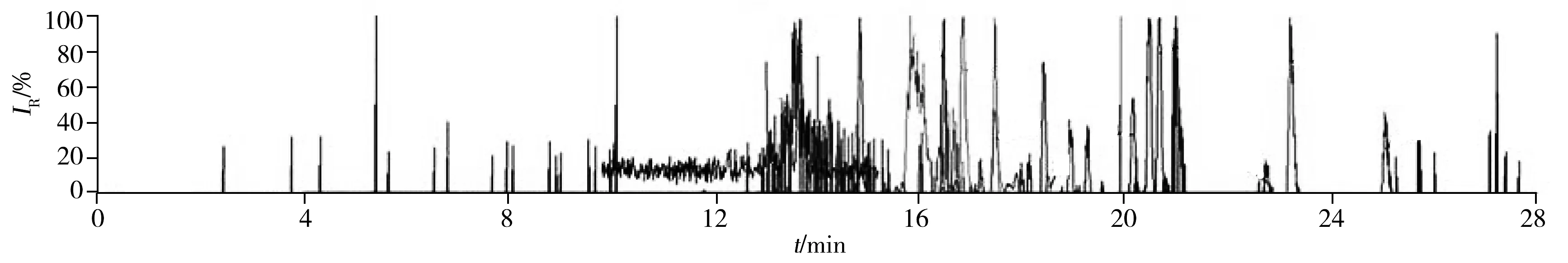
图1 血清样品的提取离子色谱图Fig.1 The extracted ion chromatogram(EIC) of serum samples
2.2 方法学考察
按照“1.5”进行方法学考察,结果见表2。由表2可知,41种胆汁酸在一定浓度范围内呈良好线性关系,检出限(LOD)为0.24~7.81 nmol/L,定量下限(LOQ)为0.49~15.63 nmol/L,相关系数(r2)为 0.986 7~0.999 7。QC样品重复进样8次,所有目标化合物的RSD均不大于14%,平均回收率为87.5%~106%,表明该方法精密度和准确度良好。
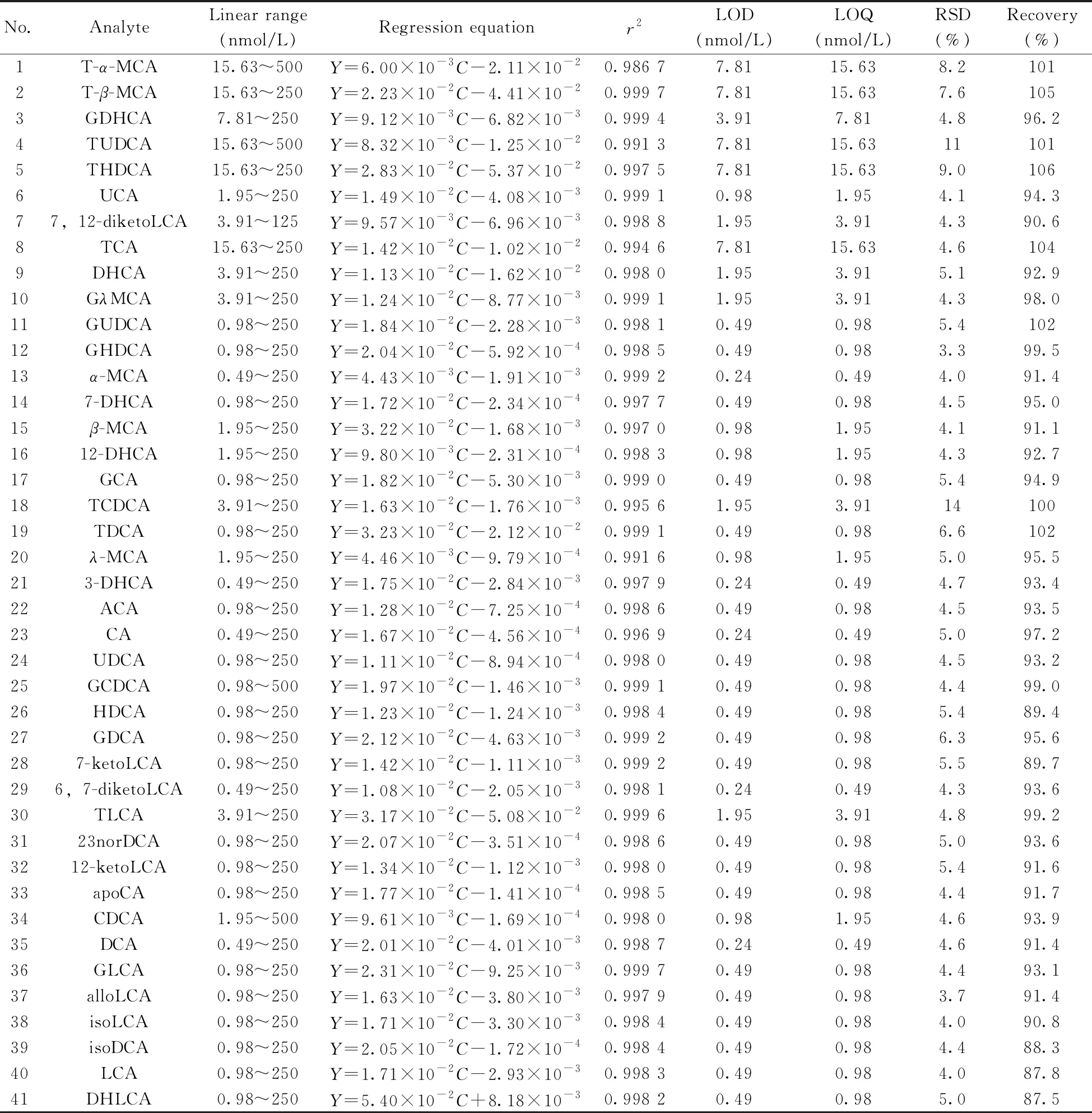
表2 41种胆汁酸的线性范围、回归方程、r2、LOD、LOQ、RSD及回收率Table 2 The linear ranges,regression equations,r2,LOD,LOQ,RSDs and recoveries of 41 bile acids
2.3 代谢物的多元分析
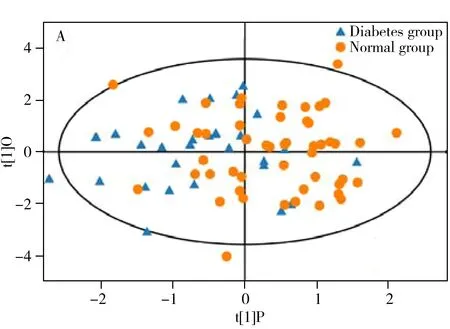
使用SIMCA软件(V15.0.2,Sartorius Stedim Data Analytics AB,Umea,Sweden)对数据进行OPLS-DA统计分析。由OPLS-DA模型的得分图(见图2A)可知,该组样本区分显著,样本基本处于95%置信区间。随后通过置换检验,随机改变分类变量Y的排列顺序,多次(次数n=200)建立对应的OPLS-DA模型以获取随机模型的模型解释率(R2)和模型预测能力(Q2值),糖尿病vs.正常组R2=0.04,Q2=-0.22(见图2B)。Q2的回归线与纵轴的截距小于0,随着置换保留度逐渐降低,置换的Y变量比例增大,随机模型的Q2逐渐下降,说明原模型具有良好的稳健性,不存在过拟合,适合于后续分析的优化。
2.4 差异代谢物识别及生物标志物预测能力评估
本实验使用的卡值标准为t检验的P值(P-value)小于1,同时OPLS-DA模型第一主成分的变量投影重要度(VIP)大于0。差异代谢物筛选的结果见表3,结果表明,糖尿病组(DH)与正常组(NH)间的胆汁酸代谢物有显著差异,12个胆汁酸承载了分组的重要信息。
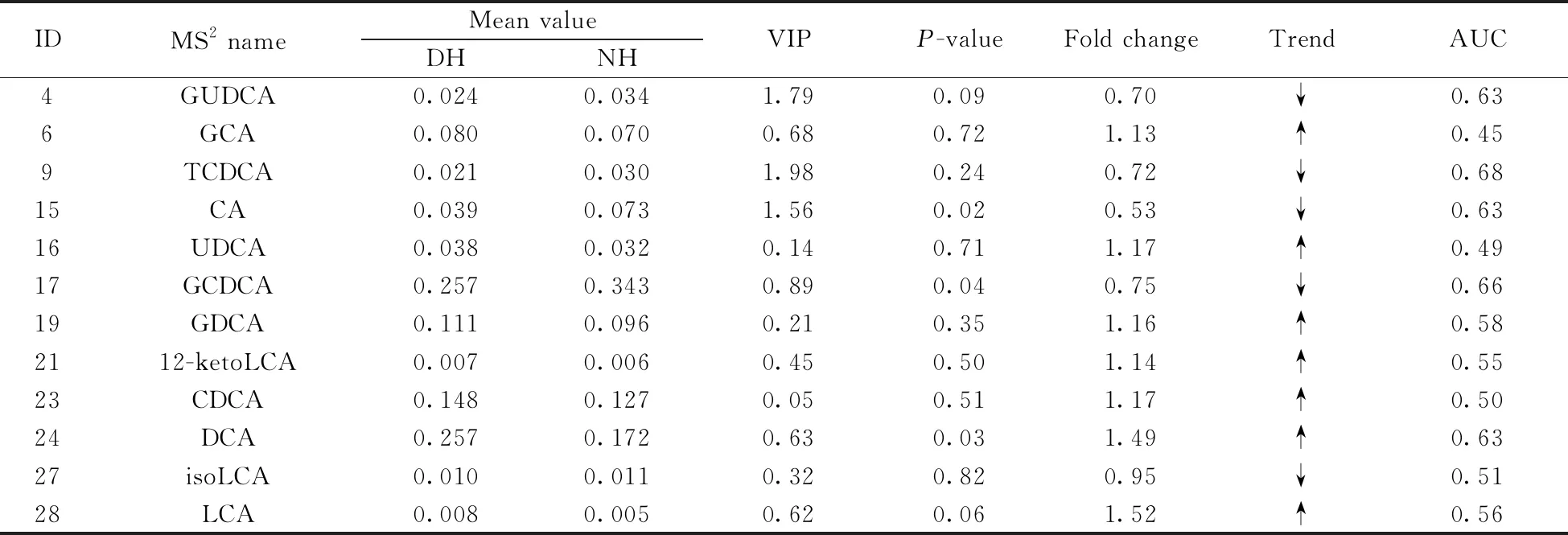
表3 差异代谢物筛选结果及ROC曲线下的面积(AUC)值Table 3 Significantly changed metabolites screening results and AUC values of ROC curve
为确定潜在生物标志物,对12个差异代谢物进行ROC分析,当该差异代谢物或差异代谢物的组合在上述判别中真阳性率足够高,同时假阳性率足够低时,认为该差异代谢物是潜在的生物标志物。ROC曲线下的面积(AUC)值越接近1,其临床诊断效能越大,而当AUC<0.50时,基于该物质的预测为反向预测。结果表明,牛磺鹅脱氧胆酸(AUC=0.68)、甘氨鹅脱氧胆酸(AUC=0.66)、甘氨熊脱氧胆酸(AUC=0.63)、胆酸(AUC=0.63)、脱氧胆酸(AUC=0.63)、甘氨脱氧胆酸(AUC=0.58)的临床诊断效能较大,其中牛磺鹅脱氧胆酸、甘氨鹅脱氧胆酸、甘氨熊脱氧胆酸、胆酸显著下调,脱氧胆酸、甘氨脱氧胆酸显著上调。
Liu等[21]的研究表明CDCA、DCA、LCA在调节BA动态平衡方面起着重要作用。Sonne等[22]发现餐后DCA的非结合形式和甘氨酸结合形式在T2DM患者的血清中有显著差异。Choucair等[15]在血浆样本的BA分析中发现DCA、GDCA在T2DM患者中显著上升,与本研究中DCA、GDCA显著上调的结果一致。有研究[23]认为牛磺酸结合的胆汁酸在T2DM患者中含量较高,然而在本研究中TCDCA表现出下调趋势。此外,本研究还发现甘氨鹅脱氧胆酸、甘氨熊脱氧胆酸、胆酸可作为潜在生物标志物。
结合上述分析,认为胆汁酸代谢谱与糖尿病存在相关性,其中牛磺鹅脱氧胆酸、甘氨鹅脱氧胆酸、甘氨熊脱氧胆酸、胆酸、脱氧胆酸、甘氨脱氧胆酸的临床预测能力更大,阐明这些胆汁酸的代谢异常与血糖间的关系,可为糖尿病的进一步研究提供更多信息。
3 结 论
本文利用UPLC-MS/MS 技术建立了胆汁酸代谢谱的快速分离检测技术,在证实方法可行性后,利用其研究2型糖尿病患者血清的胆汁酸代谢水平。通过多元统计分析阐明胆汁酸的代谢物变化,最终寻找到6种胆汁酸(牛磺鹅脱氧胆酸、甘氨鹅脱氧胆酸、甘氨熊脱氧胆酸、胆酸、脱氧胆酸、甘氨脱氧胆酸)可作为糖尿病的潜在诊断生物标志物,能为糖尿病发病及机理研究提供新的思路。

