血清miR-10a、IL-35水平对脓毒症并发急性肾损伤的诊断效能
刘岩,任思思,马秋晟,徐丽娜
天津市北辰医院,天津300400
脓毒症是感染诱发的全身炎症反应综合征,炎症反应失控可造成多器官功能障碍综合征,影响患者的临床预后。相关研究[1,2]报道显示,全球目前大约有1800万例脓毒症患者,且发病率呈不断上升趋势。脓毒症有较高的发病率和死亡率,是引起急性肾损伤(AKI)的最常见病因。研究[3~5]显示,在脓毒症患者中,AKI的发生率为40%~50%,且脓毒症患者发生AKI后住院死亡率可增加6~8倍,远期慢性肾脏病和心血管死亡风险也相应增加。目前脓毒症并发AKI尚缺乏有效的治疗手段,因此,寻找早期诊断脓毒症并发AKI的血清学指标,有助于临床早期干预并改善预后。目前临床常用于评估脓毒症并发AKI的血清标志物主要包括血清中性粒细胞明胶酶相关脂质运载蛋白、尿肾损伤分子-1和血半胱氨酸蛋白酶抑制蛋白C,但诊断的准确性不高,临床应用价值受限[6]。miRNA能够在转录后水平上对基因的表达进行调控,介导肾脏功能的调节过程。既往研究[7]报道,miR-10a过表达对于脓毒症并发AKI具有肾脏保护作用。研究[8]发现,白细胞介素-35(IL-35)可能参与机体免疫应答反应,可调节炎性反应过程,与脓毒症患者的发生发展有关。本研究观察了血清miR-10a、IL-35水平对脓毒症并发AKI的诊断效能,现将结果报告如下。
1 资料与方法
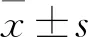
1.1 临床资料 选取2014年1月~2019年1月天津市北辰医院收治的脓毒症患者100例,根据是否并发AKI,分为AKI组和非AKI组。AKI组患者43例,男26例、女17例,年龄(53.72±12.53)岁;非AKI组患者57例,男30例、女27例,年龄(51.86±11.91)岁,两组患者性别、年龄等资料具有可比性。纳入标准:①脓毒症的诊断根据2012年国际严重脓毒症及脓毒性休克诊疗指南[9]标准;②AKI的诊断依据2012年改善全球肾脏病预后组织(KDIGO)临床实践指南[10]标准:与基线血肌酐比较,48 h内血肌酐升高≥26.5 μmol/L或7 d内血肌酐升高≥基线值的1.5倍定义为AKI;③脓毒症并发AKI的诊断标准为同时满足脓毒症和AKI的诊断标准;④患者自愿参与并签署知情同意书。排除标准:①患者入院时已进入慢性肾脏病五期或长期行肾脏替代治疗;②由脓毒症以外其他病因导致的AKI,包括肾小球肾炎、肾血管性疾病、肾小球坏死、泌尿系统梗阻、应用肾毒性药物等;③截肢术后患者;④肾移植术后患者。依据AKI分级标准将AKI组43例脓毒症并发AKI患者分为Ⅰ级组(23例)、Ⅱ级组(14例)、Ⅲ级组(6例)。Ⅰ级:48 h内血肌酐升高≥26.5 μmol/L或7 d内血肌酐升高为基线值的1.5~1.9倍;Ⅱ级:7 d内血肌酐升高为基线值的2.0~2.9倍;Ⅲ级7 d内血肌酐升高≥基线值的3.0倍或血肌酐≥353.6 μmol/L或开始肾脏替代治疗。
1.2 各组患者血清miR-10a检测 采用PT-PCR法。清晨空腹状态时采集患者肘部静脉血5 mL,3 000 r/min离心10 min,将获取的血清保存于-80 ℃冰箱中备用。采用RNA提取纯化试剂盒(购自北京天根生化科技有限公司)提取血清总RNA,反转录为cDNA,以cDNA为模板,以U6为内参进行PCR反应。PCR反应条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s,40个循环。miR-10a上游引物为5′-GGAGGGGTACCA-GAATCCCATTTTGGCCA-3′,下游引物为5′GGAGGAAGCTTGCGGAGTGTTTATGTCAACT-3′;U6上游引物为5′-CTCGCTTCGGCAGCACA-3′,下游引物为5′-AACGCTTCACGAATTTGCGT-3′。以2-ΔΔCt表示血清中miR-10a的相对表达量。
1.3 各组患者血清IL-35检测 采用ELISA法。取离心后的血清,采用ELISA法检测血清IL-35水平,检测流程依据ELISA试剂盒说明书操作。
2 结果
2.1 各组患者血清miR-10a相对表达量、IL-35水平比较 AKI组患者血清miR-10a相对表达量、IL-35水平分别为3.34±0.53、(501.74±36.79)pg/mL,非AKI组患者血清miR-10a相对表达量、IL-35水平分别为1.09±0.32、(269.47±28.79)pg/mL,两组相比,P均<0.001。Ⅰ级组患者血清miR-10a相对表达量、IL-35水平分别为2.98±1.06、(438.84±26.89)pg/mL,Ⅱ级组患者血清miR-10a相对表达量、IL-35水平分别为4.31±1.82、(521.94±32.69)pg/mL,Ⅲ级组患者血清miR-10a相对表达量、IL-35水平分别为5.89±1.98、(598.54±26.79)pg/mL,组间相比,P均<0.001。
2.2 血清miR-10a、IL-35水平对脓毒症并发急性肾损伤的诊断效能 血清miR-10a水平诊断脓毒症并发AKI的曲线下面积为0.765(95%CI为0.698~0.813),取截断值为3.23时,血清miR-10a水平诊断脓毒症并发AKI的敏感度为79.34%、特异度为81.23%;血清IL-35水平诊断脓毒症并发AKI的曲线下面积为0.801(95%CI为0.765~0.892),取截断值为398.74 pg/mL时,血清IL-35水平诊断脓毒症并发AKI的敏感度为78.65%、特异度为82.46%;血清miR-10a联合IL-35水平诊断脓毒症并发AKI的曲线下面积为0.875,取血清miR-10a水平的截断值为3.23、血清IL-35水平的截断值为398.74 pg/mL时,诊断脓毒症并发AKI的敏感度为83.56%、特异度为88.21%。
3 讨论
脓毒症是危重症患者常见的临床综合征,病死率高,临床预后较差。研究[11]显示,脓毒症危重症患者病死率约为45.2%,而脓毒症并发AKI后病死率可增加至74.5%。研究[12]表明,脓毒症并发AKI的患者临床并发症远远多于单纯脓毒症未并发AKI的患者以及非脓毒症AKI患者。脓毒症患者由于炎症诱发细胞缺氧和氧化应激,进一步引起肾脏血流动力学变化,肾脏血流灌注不足,细胞因子和趋化因子介导肾小管细胞损伤和凋亡,最终导致肾脏损伤并诱发AKI的发生[13]。目前脓毒症并发AKI早期诊断困难,寻找早期诊断脓毒症并发AKI的生物标志物显得尤为重要。
miRNA是一类长度约为22个核苷酸的由内源基因编码的非编码单链RNA分子,参与转录后基因表达调控。在肾脏调控和介导损伤的过程中,肾脏可通过调控miRNA的表达,进一步导致调节关键通路的信号蛋白的高表达或低表达,参与细胞的增殖、分化、凋亡等多种生物学过程,介导肾脏损伤[14]。近年来,不少研究[7]证实,miRNA在评估脓毒症并发AKI的临床预后方面具有重要作用。既往研究[15]表明,miR-10a是调控免疫应答水平的关键因子之一,在炎症性肠病、风湿免疫性疾病、肿瘤等领域得到深入广泛的研究,而在脓毒症并发AKI患者中尚未得到深入的认识。炎症是引起脓毒症的病因,而白细胞介素作为趋化因子家族的一种细胞因子,在介导炎症损伤和免疫应答等方面发挥重要的作用。有研究[16]表明,在脓毒症并发AKI的患者中,IL-35通过抑制Teff和Th17等的免疫活性,在免疫调控网络中发挥负向调节作用,抑制相应的免疫应答。此外,L-35还可以通过上调IL-10分泌及调节型T细胞比例,抑制IL-2与IFN-γ生成,抑制过度激活的免疫调节系统[17]。本研究结果显示,血清miR-10a和IL-35在脓毒症并发AKI的患者中表达上升,且AKI分级越高,miR-10a和IL-35的表达水平越高,由此提示,miR-10a和IL-35表达上调可能介导脓毒症患者的肾脏损伤,且miR-10a和IL-35的水平与脓毒症并发AKI的严重程度相关。由于miR-10a和IL-35参与脓毒症患者的炎症反应和免疫应答,而当炎症诱发肾脏损伤时,可通过基因调控以及介导炎症的细胞因子的表达,参与炎症损伤过程,进而导致miR-10a和IL-35的表达升高[18]。IL-35作为一种新发现的、具有强力免疫抑制效应的细胞因子,与多种疾病包括感染性疾病、脓毒症、自身免疫性疾病、炎症及肿瘤等密切相关[8],脓毒症患者由于较强的免疫炎症反应,需要上调IL-35水平以抑制相应的免疫应答。而miR-10a上调能够提高TNF-γ及IL-2等炎症因子的表达,调节免疫应答和介导肾脏损伤。因此,miR-10a和L-35可能可以作为脓毒症并发AKI治疗和干预的新靶点。
此外,本研究通过ROC分析还发现,血清miR-10a联合IL-35水平诊断脓毒症并发AKI的曲线下面积高于miR-10a和IL-35单独诊断脓毒症并发AKI的曲线下面积,特异性高达88.21%,敏感性高达83.56%。由此可见,血清miR-10a和IL-35水平在脓毒症并发AKI的诊断方面具有较高的临床应用价值。由于脓毒症并发AKI本身是炎症介导的肾脏损伤过程,而miR-10a和IL-35参与炎症损伤过程,因此,血清miR-10a联合IL-35对于早期诊断脓毒症并发AKI以及评估疾病的严重程度具有重要的作用。
综上所述,脓毒血症并发AKI患者血清miR-10a相对表达量、IL-35水平升高,与AKI分级有关;检测血清miR-10a、IL-35有助于脓毒症并发AKI的诊断和疾病严重程度的评估。miR-10a和IL-35可以作为脓毒症并发AKI早期诊断和评估严重程度的血清标志物,有可能成为脓毒症并发AKI治疗的新靶点。

