植物富含半胱氨酸类受体激酶家族研究进展
耿艳飞,吕明芳
(1.浙江农林大学 农业与食品科学学院,浙江 杭州 311300; 2.浙江省农业科学院 病毒学与生物技术研究所,浙江 杭州310021)
细胞-细胞和细胞与环境之间的信息交流对于植物生长发育至关重要,外界信息通过系统的级联反应,将胞外信号传导至胞内,细胞迅速做出应答[1-2]。类受体激酶(receptor-like kinase,RLK)是植物生长发育、激素信号传递、生物和非生物胁迫应答中的信号分子。植物中至少有Ser/Thr和His两种不同的类受体激酶,1990年在玉米(Zeamays)里面鉴定到第一个植物类受体激酶[3]。从结构上看,典型的RLK包括信号肽(signal peptide)、保守的胞内激酶结构域(intracellular protein kinase domain)、跨膜结构域(transmembrane domain)和感知信号的胞外结构域(extracellular domain),而RLK高度多样的胞外结构域通常作为RLK亚家族分类的依据。富含半胱氨酸类受体激酶(cysteine-rich receptor-like kinases,CRKs)的胞外结构域包含DUF26,其作为植物类受体激酶的一个大家族,在感知逆境和植物生长发育过程中发挥着重要作用[1,4]。
1 富含半胱氨酸类受体激酶的结构
CRK最早是从维管植物中鉴定发现的,也被称为DUF26 RLKs。典型的CRK由信号肽、DUF26(又称为stress-antifungal domain,在结构域数据库中的编号为PF01657)、跨膜结构域和胞内激酶结构域组成(图1)[1]。不同物种里CRK同源基因很多(表1),CRK可能来源于富含半胱氨酸类受体分泌蛋白和富含亮氨酸重复序列类受体蛋白激酶(LRR-RLKs)的融合,而且主要通过部分重复和串联重复的方式进化[5]。例如,拟南芥14个CRK分布在4号染色体[2],海岛棉(Gossypiumbarbadense)有11个CRK位于A06和D06染色体[6],水稻中有30个CRK位于7号染色体(图2)。这种串联排列方式可能有利于基因重组并加速相关性状的进化,对于遗传多样性和基因功能具有重要意义[5,7-9]。
1.1 胞外结构域
含有DUF26结构域的蛋白可以分为CRRSPs、PDLP、CRK。CRRSPs含有一个信号肽,一个DUF26(sd CRRSPs)或多个DUF26;PDLP含有一个信号肽,两个DUF26,一个跨膜区;除去N-端信号肽,CRK的胞外结构域一般含有一个或两个保守的DUF26基序,保守的基序为C-X8-C-X2-C[1,5]。DUF26起源于分泌蛋白,是陆地植物所特有的。不同物种里的DUF26基序一般相同,比如小麦、二穗短柄草、水稻、玉米、拟南芥中均含有两个DUF26基序,然而小麦和二穗短柄草的第一个基序为C-X9-C-X2-C,水稻、玉米、拟南芥里第一个基序为C-X8-C-X2-C(图3)[10]。结构域中保守的半胱氨酸可能通过二硫键作为巯基氧化还原调控的潜在位点,还可以作为活性氧(reactive oxygen species,ROS)的传感器,在植物防御过程中感知细胞外氧化还原的变化[2,4]。保守的Cys通过二硫键形成锌指结构参与蛋白质之间的互作,维持蛋白质空间结构,C-X2-C可能是过渡金属离子结合位点[11-13]。

图1 CRK结构域Fig.1 Domains of CRK protein
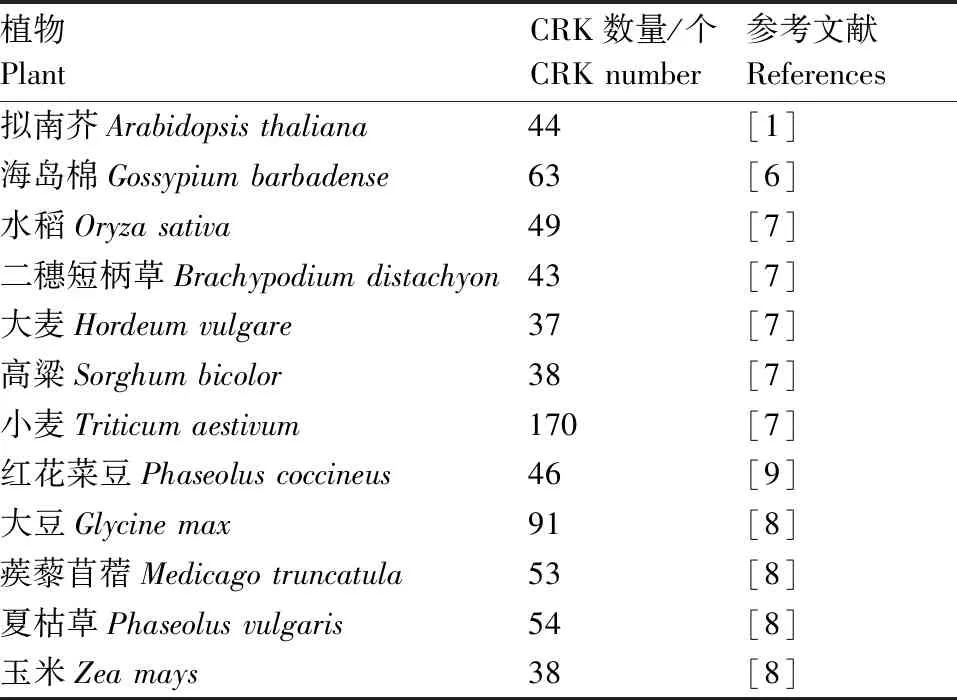
表1 不同植物中CRK的数目
1.2 胞内结构域
激酶结构域通过磷酸化底物传导信号,大多数CRK具有Tyr激酶活性,部分CRK已经被证实在体外具有激酶活性[14-15]。CRK胞内激酶结构域(PF00069)包括ATP结合结构域(ATP binding site)、底物结合位点(substrate binding site)或化学结合位点(chemical binding site)和活化环(activation loop)[2]。活化环对于激酶活性至关重要,环中丝氨酸/苏氨酸残基磷酸化会导致活化环构象发生变化,使得ATP和底物能够进入活性中心[1,16]。拟南芥CRK5激酶催化结构域中Lys-368是和CRKIP互作所必需的[17],CRK6和CRK7激酶活性对金属离子具有不同的偏好性,CRK6磷酸化MBP依赖于Mn2+,而CRK7更倾向于Mg2+[18]。
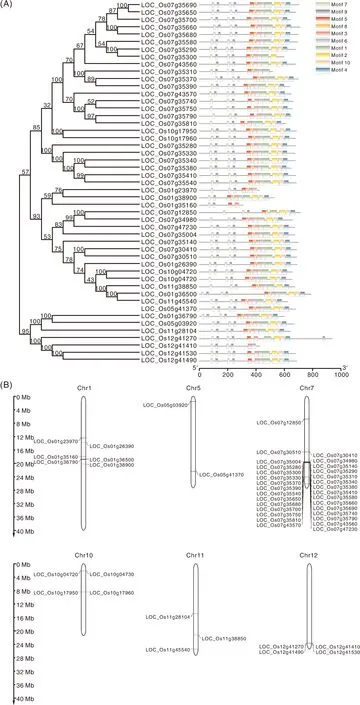
A,OsCRKs基因的系统发生树;B,OsCRKs基因在水稻染色体上的分布。A, The phylogenetic tree of OsCRKs;B, OsCRKs distribution on chromosomes of rice.图2 水稻CRKs基因的系统发生树和在染色体上的分布Fig.2 Phylogenetic tree and distribution on chromosomes of rice CRKs
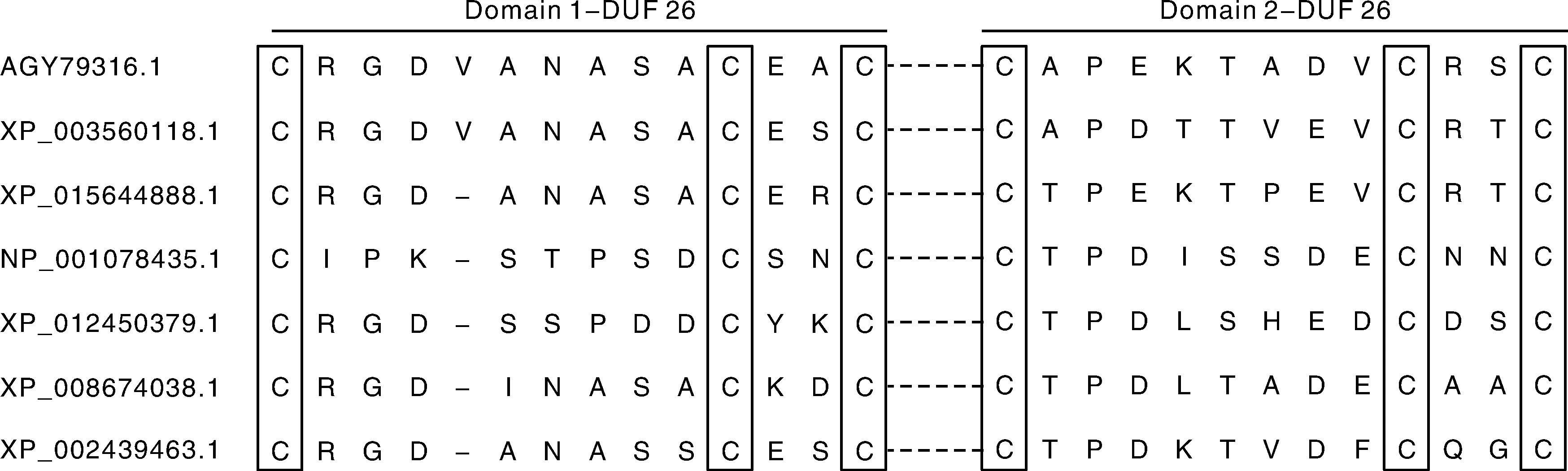
图3 不同物种中DUF26 结构域Fig.3 DUF26 domain in different species
1.3 跨膜结构域
跨膜结构域(transmembrane domain,TM)由22~28个氨基酸构成,连接细胞内外不同的结构域,将胞外信号传导到胞内,同时还起到定位蛋白的作用。大多数CRK蛋白都含有TM,而缺少TM的CRK被称为胞质类受体激酶(RLCKs)。跨膜结构域决定了蛋白的位置,大多数CRK蛋白为膜结合蛋白,预测分析表明,二穗短柄草、大麦、水稻、高粱、小麦等作物中90%以上的CRK蛋白定位在细胞质膜上,少数定位在细胞外或线粒体[8]。目前没有关于CRK定位在叶绿体上的报道,所以还不清楚CRK如何参与叶绿体之间的信息交流,推测它们参与质外体和叶绿体之间的信息交流可能与PAMAP诱导的免疫反应途径相似[18-19]。
2 CRKs在植物生长发育中的作用
CRK在植物生长发育过程中具有重要作用,拟南芥中已经陆续报道了部分CRK的功能,其他植物中关于CRK的功能研究还相对较少。然而,研究发现大多数拟南芥CRK突变体和过表达植株与野生型相比表型没有差异,而CRK家族又十分庞大,推测是CRK功能冗余造成的[17]。目前已经报道的CRK主要参与调控根、叶等营养器官的发育以及植物生长周期。
2.1 CRK参与调控根、叶器官的形成
拟南芥CRK28通过负调控叶片表皮毛,正调控根毛影响植物形态建成。主根的生长依赖于根尖分生组织的细胞分裂,CRK28通过抑制分生组织的分裂影响初生根的形成;与野生型相比,crk28突变体主根增长15%~20%,而过表达CRK28转基因植株主根缩短40%[20]。Bourdais等[11]也发现crk28、crk29、crk42突变体相比于野生型根长有所增加。拟南芥过表达CRK5导致幼苗时期主根变短,但是在成熟期和野生型生长状态一致[21]。CRK功能之间的差异意味着其在调控植物根长方面发挥着重要作用。根毛是由表皮细胞形成的,具有吸收水分和营养物质的功能。CRK28通过抑制侧根原基(LRP)的形成影响侧根发育,与野生型相比,crk28突变体根毛缩短,数量减少,而过表达CRK28植株根毛数量和长度都明显增加;表皮毛是茎和叶片中的表皮细胞分化而成的,可以调节植物蒸腾作用和保护植物免受昆虫和病原菌侵害,CRK28通过负调控叶片表皮细胞的分化,影响叶片表皮毛的形成[20]。
2.2 影响植物发育阶段的转换
拟南芥CRK28、CRK45参与调控植物生长发育。crk28突变体促进拟南芥早期生长发育,但是突变体在成熟期略矮于野生型,花环直径略小;过表达CRK28植株早期生长发育延迟,成熟期和野生型株高一致,花环直径增大[20]。Yadeta等[22]发现,过表达CRK28植株早期生长矮小,花序分枝数增加,果荚变小。二者均发现过表达CRK28导致花序分枝数增加,早期生长发育延迟[20],其研究是一致的。CRK45影响拟南芥抽薹时间,过表达CRK45延迟抽薹,而突变体提前抽薹,随后的生长发育过程中,同时发现过表达CRK45长势优于野生型,株型增大、生长周期延长、延缓衰老[23]。Bourdais等[11]通过研究大量拟南芥CRK突变体库发现,crk2突变体植株矮小,在crk2突变体中过表达CRK2能够恢复其表型。此外,4个crk突变体(crk7、crk16、crk19、crk38)提前开花,34个crk突变体开花后早衰。
拟南芥CRK5通过两种途径影响植株衰老。CRK5通过负调控乙烯信号通路,参与衰老过程。crk5突变体真叶形成不久后,水杨酸和乙烯逐渐积累,子叶细胞出现凋亡,叶片早衰;同时发现CRK5启动子区域含有大量WRKY转录因子结合位点(W-Box),CRK5可能通过WRKY53和WRKY70转录因子调控拟南芥衰老;进一步在crk5突变体过表达CRK5能够恢复到野生型[24]。Chen等[12]发现,在野生型中过表达CRK5(较低水平)促进叶片生长,生物量增加,二者研究是一致的。Bourdais等[11]发现,在crk5突变体中过表达CRK5导致花环略微增大,过量表达CRK5则引起细胞程序性死亡,二者研究中的差异可能与CRK5的表达水平或植株的培养条件有关。
3 CRKs在生物胁迫中的功能
当植物受到病原菌侵染时,外界信号传导到胞内,启动相应的防御反应。病原相关分子模式所触发的免疫反应(PAMP-triggered immunity,PTI)是植物初级免疫反应的第一道防线,通过产生ROS或者胼胝质的积累进行免疫防御;第二道防线是植物次级免疫,在该途径中通过水杨酸(salicylic acid,SA)的积累,引起细胞程序性死亡[25]。CRK作为生物胁迫和非生物胁迫信号途径中一个重要分子,参与调控植物免疫反应。大多数CRK受病原菌诱导表达,例如拟南芥CRK5、CRK13、CRK20参与对病原菌PstDC3000的抗性。大豆中76个CRK启动子区域含有生物胁迫响应元件,意味着CRK在胁迫应答中起着重要作用[8]。
3.1 CRK参与ROS产生和胼胝质沉积
植物受体类激酶和ROS促进了细胞和外界环境的信息交流,质外体ROS在病原体防御应答中起着重要作用,CRK参与ROS的产生[26]。Yeh等[27]发现,在flg22和PstDC3000诱导下,拟南芥过表达CRK4、CRK6、CRK36植株中ROS积累。flg22诱导下,拟南芥11个crk突变体ROS含量显著上调,4个crk突变体中ROS含量下调;crk5和crk28突变体中ROS表达量和野生型基本一致,而突变体对PstDC3000更敏感;与野生型相比,crk23突变体中ROS被显著诱导表达,但是其对PstDC3000的敏感性和野生型一致,表明CRK参与ROS的产生,但是其相关机制还不清楚[11]。水稻类病变突变体lil1中,LOC_Os07g30510编码CRK,当该激酶催化结构域中第429位Val突变为Ile后,该基因表达量上调,ROS异常积累,抗病相关基因上调表达,诱导细胞程序性死亡,增强了对稻瘟病的抗性[28]。CRK对病原菌的严格调控暗示了CRK与氧化还原或ROS相关过程存在联系[26]。
胼胝质沉积是典型的后期PTI应答反应[28]。CRK36正向调节PTI和效应蛋白诱导免疫(ETI)应答,与野生型相比,flg22诱导下,过表达CRK36植株中,ROS产生,胼胝质沉积 ,FLS2是flg22的模式识别受体,通过BiFC发现,CRK4、CRK6、CRK36与模式识别受体FLS2互作形成模式识别受体复合物。过表达CRK4和CRK6并没有影响PTI介导的胼胝质沉积,而CRK36在PTI应答中正调控胼胝质沉积[29]。
3.2 CRK 参与气孔关闭
气孔是调控植物应对干旱胁迫,病原菌感染和其他刺激反应的关键结构。气孔关闭依赖于脱落酸和其他植物激素的信号之间的相互作用,CRK参与气孔免疫应答。研究发现,flg22能诱导拟南芥气孔关闭,在过表达CRK36植株中,PTI应答基因FRK1显著上调,气孔被强烈诱导关闭,而crk36突变体中气孔关闭受阻;BIK1通过磷酸化NADPH氧化酶RbohD调节气孔免疫,PTI应答中CRK36磷酸化BIK1,在bik1和rbohD/F突变体中过表达CRK36发现,气孔免疫受阻,CRK36、BIK1和NADPH氧化酶共同促进ROS的产生,增强气孔免疫反应,诱导PTI应答基因的表达[29]。PstDC3000诱导下,CRK6正向调节气孔的关闭,在PstDC3000诱导下,过表达CRK6诱导气孔关闭。而过表达CRK4或CRK36阻止PstDC3000介导的气孔重新开放存在缺陷[27]。CRK同时也参与ABA诱导的气孔的关闭,与野生型相比,拟南芥crk22、crk24、crk37、crk46突变体增强ABA诱导的气孔关闭,crk突变体中气孔密度减少,孔径增大[11]。因此,CRK在调控气孔免疫应答中发挥着重要作用。
3.3 CRK参与植物次级免疫反应
植物在长期面对生物胁迫过程中还进化出了R基因等,用以监控、识别效应子,引起细胞坏死等过敏反应,以阻止病原菌的入侵。而CRK基因参与该免疫反应过程,比如:拟南芥CRK4、CRK13、CRK20和CRK36被SA和病原菌显著诱导表达。接种PstDC3000后,CRK13快速作出应答,相关PR基因PR1和PR5随后也被诱导表达,异源表达CRK13诱导抗性相关ICS1基因通过参与SA的合成调控SA介导的防御途径,引起细胞程序性死亡;CRK13可能作为PR基因或ICS1信号途径中的上游调控基因发挥作用[30]。拟南芥CRK45受NPR1和WRKY70的调控,CRK45通过诱导PR相关基因和SA的积累防御病原菌[31],在PstDC3000诱导下,过表达CRK36植株中ROS积累量较多,PR基因上调表达;突变体中ROS含量相对较少,PR基因下调表达,与野生型相比,过表达CRK36强烈诱导细胞程序性死亡,而突变体中相对较弱[29]。拟南芥CRK20受PstDC3000诱导表达,crk20突变体中病原体数量减少,但是水杨酸含量和水杨酸相关的防御基因的表达量与野生型相比却没有差异,CRK20启动子可能有利于PstDC3000的生长[32]。海岛棉GbCRK18被黄萎病诱导表达,在大丽轮枝菌(Verticilliumdahliae)侵染下,GbCRK18诱导的沉默植株叶片枯萎,相关真菌生物量增加,PR基因PR3、PR4、PR12显著下调,对病原菌的易感性增加[5]。
CRK13的表达水平对于拟南芥形态发育起着重要作用。组成型CaMV 35 S启动子过表达CRK13植株在生长过程中逐渐死亡,均不能正常生长到成熟期;通过类固醇诱导的Gal4启动子诱导表达CRK13,拟南芥叶片组织塌陷,细胞程序性死亡。CRK13赋予的细胞程序性死亡受SA依赖型和非依赖型调控,在有无SA积累时,过表达CRK13均能够引起细胞程序性死亡[30]。而Yeh等[27]获得了稳定的过表达CRK13(表达量相对较低)植株,可能是CRK13表达水平或者培养条件造成了差异。过表达植株中CRK5的表达方式或表达水平激活不同的防御反应。较低水平组成型表达CRK5通过正向调节生物量的产生,促进叶片生长,增强抗病反应;通过类固醇诱导的Gal4启动子诱导表达CRK5导致超敏反应的发生,叶片细胞死亡[12]。拟南芥中通过类固醇诱导CRK4、CRK19、CRK20均可以诱导细胞死亡,而Yeh等[27]获得的CRK4过表达株系没有出现细胞程序性死亡,可能是CRK4的表达水平造成的差异。
4 CRKs在非生物胁迫中的功能
植物在生长发育过程中除了受到生物胁迫外,还容易受到非生物胁迫的影响。植物通过一定的方式感知外界胁迫,CRKs也参与激素、盐、高温、干旱、氧化还原应激等非生物胁迫应答,研究发现,大多数CRK同时参与生物与非生物逆境胁迫。
4.1 CRK参与激素应答
脱落酸(abscisic acid,ABA)介导植物参与许多非生物胁迫应答,ABA和非生物胁迫作为信号分子诱导或者增强胁迫应答基因的表达,ABA通常抑制根的生长和种子萌发[33-34]。CRK在ABA信号通路中发挥着不同功能。在拟南芥萌发和幼苗生长阶段,CRK28参与种子休眠响应的ABA应答;ABA胁迫处理条件下,与野生型相比,过表达CRK28植株对ABA更敏感,野生型在72 h时发芽率达到100%,而过表达CRK28 发芽率不到20%[20]。Lu等[21]也发现,在ABA处理后,拟南芥过表达CRK5植株对根长的抑制作用比野生型更显著,二者研究是一致的。CRK45是拟南芥幼苗早期ABA抑制发育信号通路的重要调节因子,CRK45通过与CRK36互作响应ABA应答,CRK45过表达植株中ABA应答基因ABI1、ABI2、ABI5、KIN1、MYB2显著上调,导致了CRK45过表达植株对ABA更敏感[23],而敲除突变体crk36对ABA更敏感,进一步研究发现,CRK36通过磷酸化ARCK1调控ABA信号转导途径,并且CRK36对ABA之外的激素无应答[29]。同时在拟南芥中异源表达TaCRK41能够减轻ABA对发芽的抑制效应[35]。GbCRK18可以被茉莉酸(jasmonic acid,JA)诱导表达,但是不受SA和ABA的影响,GbCRK18可能参与JA信号途径的防御反应[6]。
4.2 CRK参与盐胁迫
拟南芥CRK45调节盐胁迫条件下种子的萌发和幼苗发育。100 mmol·L-1NaCl处理条件下过表达CRK45抑制种子萌发,而crk45突变体促进种子萌发[23];Bourdais等[11]发现,在120 mmol·L-1NaCl处理条件下,21个拟南芥crk突变体发芽延迟,表明CRK在盐胁迫条件下发挥着不同作用[33]。小麦102个CRK基因响应盐胁迫应答,大多数CRK基因在盐胁迫处理几个小时后上调表达,而TaCRK82-A和TaCRK61-A下调表达[7]。拟南芥CRK20可以被甘露醇显著诱导表达,然而,在高盐条件下CRK20被抑制表达[32]。拟南芥组成型表达TaCRK41降低了对渗透压的敏感性,在盐胁迫条件下,拟南芥中异源表达TaCRK41可以提高萌发速率[35]。
4.3 CRK参与干旱胁迫
RNA-seq数据分析发现,在干旱和热胁迫条件下,小麦128个TaCRK差异表达,大多数TaCRK基因受干旱胁迫诱导表达,少数基因在高温胁迫条件中下调表达。在干旱和高温胁迫下TaCRK16-A和TaCRK68-A上调表达;异源表达TaCRK68-A可以增强大肠埃希菌和酵母细胞对低温、干旱、盐、高温胁迫的耐受性[7]。CRK45增强拟南芥抗干旱能力,干旱胁迫条件下,过表达CRK45植株存活率更高[23]。CRK4和CRK5通过增加对ABA的敏感性提高植物抗旱能力,CRK5过表达植株中ABA积累,通过抑制气孔开放最大程度地减少叶片水分蒸发,达到抗旱作用[24]。
4.4 CRK参与氧化还原应激反应
一些CRK参与感知或适应ROS或氧化还原平衡的变化,并可能参与信号转导过程。
线粒体和过氧化物酶体是植物细胞内产生ROS的主要细胞器,紫外线或O3胁迫也能够诱导ROS的产生。紫外线诱导拟南芥CRK5的表达,在紫外线胁迫条件下,与野生型相比,crk5 突变体中过氧化氢酶(CAT)、超氧化物歧化酶(SOD)等ROS清除系统激活延迟,细胞内产生严重的氧化损伤[24]。Bourdais等[11]也发现,紫外线胁迫条件下,拟南芥crk2、crk5、crk40和crk42突变体细胞膜损害程度比野生型严重,二者是一致的。拟南芥CRK对O3的反应比较微妙。O3胁迫条件下,大多数拟南芥突变体如crk3、crk31等的细胞膜出现损伤,crk突变体增强O3诱导的细胞死亡[12]。Ederli等[32]发现,O3胁迫条件下,野生型与突变体crk20中CRK4和CRK19均被诱导上调表达,并且其表达量在野生型和突变体中没有差异;crk20和野生型细胞质膜受损情况一致,同时,Idänheimo等[18]也发现,拟南芥突变体crk6和crk7与野生型对O3的敏感性一致,推测是基因功能冗余造成的。
5 结论与展望
富含半胱氨酸类受体激酶是受体类激酶中的大家族,在植物逆境胁迫和生长发育过程中发挥重要作用。如表2所示,我们对目前植物中已经报道的CRK做了系统总结,大多数CRK不仅可以对病原菌flg22和PstDC3000等生物胁迫作出应答,而且能够响应植物激素、盐、高温、干旱等非生物胁迫,仅少量CRK对病原菌或非生物胁迫没有应答。CRK表达量的变化虽然对植株的株型没有明显的影响,但是可以通过调控植株根,叶及发育阶段转化等影响植株的生长发育。
目前CRK蛋白功能的研究主要是在拟南芥中进行的,但是对于其功能的研究仍不够深入,还面临着以下几个问题:(1)CRK作为正调控或负调控因子对细胞-细胞之间或环境信号做出应答,但CRK信号通路中配体却知之甚少。虽然CRK的胞外结构域相同且大多CRK可能具有相似的功能,但我们对 CRK和配体特异性识别的机制并不了解。(2)ROS对于病原菌入侵和其他环境信号的感知,在一定程度上可能与CRK信号密切相关,但CRK作为ROS产生的下游特异信号的机理尚不清楚[26]。另外,CRK与其他受体和RLKs相互作用,以及其参与植物免疫应答中的具体机制还不清楚。因此,研究CRK的功能,揭示植物对逆境胁迫应答机理对于提高农作物抗逆境能力具有重要意义。

