万古霉素持续输注与间歇输注有效性与安全性比较的Meta分析
刘露 吴知桂 范清泽 叶云 罗宏丽
摘 要 目的:比较万古霉素持续输注和间歇输注的有效性和安全性,为临床用药提供循证参考。方法:计算机检索 PubMed、Cochrane图书馆、Embase、万方数据、中国知网、维普网等数据库,收集万古霉素持续输注(试验组)对比间歇输注(对照组)的随机对照研究(RCT)和队列研究,检索时限均为建库起至2020年4月。筛选文献、提取资料后,采用Cochrane 系统评价员手册6.0推荐的偏倚风险评估工具对RCT进行质量评价,采用纽卡斯尔-渥太华量表对队列研究进行质量评价;采用Rev Man 5.3软件进行Meta分析和发表偏倚分析。结果:共纳入20项研究(3项为RCT、17项为队列研究),共计2 380例患者。Meta分析结果显示,试验组患者的目标浓度达标率[RR=1.24,95%CI(1.12,1.38),P<0.000 1]、临床疗效靶值达标率[RR=1.20,95%CI(1.04,1.38),P=0.01]均顯著高于对照组,肾毒性发生率 [RR=0.56,95%CI(0.45,0.70),P<0.000 01]显著低于对照组;两组患者的治疗有效率[RR=1.02,95%CI(0.95,1.10),P=0.53]、用药时间[MD=-0.50,95%CI(-1.40,0.39),P=0.27]、病死率[RR=1.03,95%CI(0.78,1.35),P=0.83]比较,差异均无统计学意义。发表偏倚结果显示,以肾毒性发生率为指标时存在发表偏倚的可能性较大。结论:万古霉素持续输注能提高患者目标浓度达标率和临床疗效靶值达标率,降低肾毒性发生率,但不能提高治疗有效率;由于发表偏倚结果不一致,故上述结论需谨慎解读。
关键词 万古霉素;持续输注;间歇输注;疗效;安全性;Meta分析
中图分类号 R978.1+6 文献标志码 A 文章编号 1001-0408(2020)22-2774-07
DOI 10.6039/j.issn.1001-0408.2020.22.15
ABSTRACT OBJECTIVE: To compare the efficacy and safety of vancomycin given by continuous infusion vs. intermittent infusion, and to provide evidence-based reference for clinical drug use. METHODS: Retrieved from PubMed, the Cochrane Library, Embase, Wanfang database, CNKI and VIP databases, ranomized controlled trials (RCT) and cohort studies about vancomycin given by continuous infusion (trial group) vs. intermittent infusion (control group) were collected during the inception to Apr. 2020. After literature screening and data extraction, the qualities of RCTs were evaluated by using bias risk evaluation tool recommended by Cochrane system evaluator manual 6.0. The qualities of cohort studies were evaluated by NOS; Rev Man 5.3 software was used to perform Meta-analysis and publication bias analysis. RESULTS: A total of 20 studies were included (3 RCTs and 17 cohort studies), involving 2 380 patients in total. Results of Meta-analysis showed that, target concentration attainment rate [RR=1.24, 95%CI (1.12,1.38), P<0.000 1] and attainment rate of target clinical efficacy [RR=1.20, 95%CI (1.04,1.38), P=0.01] of trial group was significantly higher than those of control group. The incidence of nephrotoxicity [RR=0.56, 95%CI(0.45,0.70), P<0.000 01] was significantly lower than control group. There was no statistical significance in the therapeutic efficiency [RR=1.02, 95%CI (0.95,1.10), P=0.53], drug treatment duration [MD=-0.50, 95%CI(-1.40,0.39), P=0.27] or mortality [RR=1.03, 95%CI (0.78,1.35), P=0.83] between 2 groups. The results of publication bias showed that the probability of publication bias was high when the incidence of nephrotoxicity was used as the index. CONCLUSIONS: Vancomycin continuous infusion can improve the attainment rate of target concentration and target clinical efficacy, reduce the incidence of nephrotoxicity, but can not improve the treatment efficiency. Due to the inconsistent results of publication bias analysis, the above conclusion needs to be interpreted carefully.
KEYWORDS Vancomycin; Continuous infusion; Intermittent infusion; Efficacy; Safety; Meta-analysis
万古霉素属于糖肽类抗菌药物,临床应用已超过半个世纪,对多种革兰氏阳性菌均有杀灭活性,目前仍为治疗耐甲氧西林金黄色葡萄球菌(MRSA)感染和耐甲氧西林表皮葡萄球菌(MRSE)感染的首选药物,主要用于血流感染、感染性心内膜炎、骨髓炎、肺炎、脑膜炎等重症感染的治疗[1-2]。随着万古霉素的广泛应用,其最低抑菌浓度(MIC)发生了漂移,且出现耐药菌株,给临床治疗带来了极大挑战[3]。因此,抑制耐药菌株的产生、提高临床疗效、合理使用万古霉素显得尤为重要。由于万古霉素是时间依赖性抗菌药物,且其后效应较强,故有关该药是持续输注(CIV)还是间歇输注(IIV),目前学界尚未达成共识[4-5]。美国感染性疾病学会《成人和儿童MRSA感染治疗的临床实践指南》[6]和我国《万古霉素临床应用中国专家共识》[1]均推荐IIV;但一些欧洲国家则推荐采用CIV[7]。虽然,已有研究对两种输注方式进行了评价,但仅以安全性作为指标,较为单一且未得到一致结论[8-10]。为此,本研究采用Meta分析的方法对两种输注方式的有效性及安全性进行了比较,旨在为临床合理用药提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的随机对照研究(RCT)、队列研究。语种限定为中文和英文。
1.1.2 研究对象 使用万古霉素治疗且治疗时间大于48 h的患者;患者性别、年龄不限。
1.1.3 干预措施 对照组患者采用IIV给药;试验组患者采用CIV给药;两组患者给药剂量、疗程不限。
1.1.4 结局指标 ①目标浓度达标率:对照组以稳态谷浓度为目标浓度,达标时限为整个治疗周期内;试验组以稳态坪浓度为目标浓度,达标时限同对照组。②临床疗效靶值(AUC/MIC≥400)达标率,式中AUC为24 h药-时曲线下面积。③治疗有效率:根据《抗菌药物临床试验技术指导原则》[11]分为治愈,即症状、体征、实验室检查及病原学检查均恢复正常;好转,即症状、体征、实验室检查及病原学检查均有所好转;无效,即临床症状未缓解或加重,各项检查结果未改善,病原菌未转阴。总有效率=(治愈例数+好转例数)/总例数×100%。④用药时间。⑤肾毒性发生率:肾毒性判断标准为治疗期间血清肌酐绝对值连续两次较用药前基线水平增加44.2 μmol/L或增长率≥50%,或在没有其他合理解释的情况下连续2 d内生肌酐清除率较其基线值降低50%[12]。⑥病死率。
1.1.5 排除标准 ①无相关结局指标或者数据缺失的研究;②使用万古霉素治疗时间小于48 h的研究;③原始研究中结局指标数据的表达形式与“1.1.4”项下不一致的文献;④患者为妊娠期或哺乳期妇女的文献;⑤重复发表的文献;⑥非中英文文献;⑦个案、会议论文、综述及动物实验。
1.2 文献检索策略
计算机检索 PubMed、Cochrane图书馆、Embase、中国知网、万方数据、维普网等数据库。中文检索词为“万古霉素”“盐酸万古霉素”“硫酸万古霉素”“持续输注”“间歇输注”;英文检索词为“Vancomycin”“Vancomycin Hydrochloride”“Vancomycin Sulfate”“Vancocin”“Conti- nuous infusion”“Intermittent infusion”“Discontinuous infusion”。采用主题词与检索词相结合的方式进行检索并对纳入研究的参考文献进行手工筛查。检索时限为各数据库建库起至2020年4月。
1.3 文献筛选与资料提取
由两名研究者根据纳入与排除标准独立进行文献筛选及资料提取,并交叉核对结果;如遇分歧,则通过两名研究者讨论或由第3名研究者协助裁决。数据提取包括第一作者及发表年份、研究类型、患者年龄、例数、干预措施及结局指标。
1.4 文献质量评价
采用 Cochrane 系统评价员手册6.0推荐的偏倚风险评估工具对纳入的RCT进行质量评价,具体包括:随机方法,分配隐藏,对研究者和实施者施盲,结果数据的完整性(如失访情况等),选择性报告研究结果,其他偏倚来源;每項均分为“低偏倚风险”“高偏倚风险”和“不清楚”[13]。采用纽卡斯尔-渥太华量表(NOS)对纳入的队列研究进行质量评价,具体包括:研究对象选择(暴露队列的代表性、非暴露队列的选择、暴露的确定、研究开始前没有研究对象发生结局事件,共4分)、组间可比性(队列间可比性、混杂因素,共2分)、结果测量(结局评价的充分性、随访时间是否充分、随访的完整性,共3分),评分范围为0~9分,其中≥8分为高质量、6~7分为中等质量、≤5分为低质量[14]。
1.5 统计学方法
采用Rev Man 5.3软件进行Meta分析。连续型变量采用均数差(MD)及其95%置信区间(CI)表示;二分类变量采用风险比(RR)及其95%CI表示。研究间异质性采用I 2检验。若各研究间无统计学异质性(P>0.10,I 2≤50%),采用固定效应模型进行 Meta分析;反之,则采用随机效应模型进行 Meta 分析。采用倒漏斗图评价发表偏倚。P<0.05为差异有统计学意义。
2 结果
2.1 文献筛选结果与纳入研究的基本信息
初检共获得相关文献552篇,经阅读标题、摘要及全文后,最终纳入文献20项[15-34],其中3篇[20,28,33]为RCT,17篇[15-19,21-27,29-32,34]为队列研究;共计2 380例患者,其中对照组1 019例、试验组1 361例。文献筛选结果见图1,纳入研究的基本信息见表1。
2.2 纳入研究质量评价结果
3项RCT[20,28,33]均提及随机分组,其中2项研究[20,33]采用随机数字表法,1项研究[28]采用计算机随机方法;2项研究[20,33]使用了分配隐藏方法;3项研究[20,28,33]结局数据均完整;均未选择性报告研究结果,均不清楚是否存在其他偏倚来源,详见图2、图3。
17项队列研究[15-19,21-27,29-32,34]中,12项[15,17-19,21-23,26,29-30,32,34]为高质量研究,5项[16,24-25,27,31] 为中等质量研究,详见表2。
2.3 Meta分析结果
2.3.1 目标浓度达标率 9项研究[15-16,18-20,22,32-34] 报道了目标浓度达标率,各研究间无统计学异质性(P=0.16,I 2=32%),采用固定效应模型进行Meta分析,详见图4。Meta分析结果显示,试验组患者的目标浓度达标率显著高于对照组[RR=1.24,95%CI(1.12,1.38),P<0.000 1](因文献[15]对所有纳入的患者再次通过倾向评分匹配的方法进行了一一匹配,故两组患者例数与表1不同)。
2.3.2 AUC/MIC≥400 4项研究[17,19,22,26]报道了AUC/MIC≥400,各研究间无统计学异质性(P=0.16,I 2=41%),采用固定效应模型进行Meta分析,详见图5。Meta分析结果显示,试验组患者的AUC/MIC≥400显著高于对照组[RR=1.20,95%CI(1.04,1.38),P=0.01]。
2.3.3 治疗有效率 7项研究[18-19,25,31-34] 报道了治疗有效率,各研究间无统计学异质性(P=0.46,I 2=0),采用固定效应模型进行Meta分析,详见图6。Meta分析结果显示,两组患者的治疗有效率比较,差异无统计学意义[RR=1.02,95%CI(0.95,1.10),P=0.53](因文献[25]仅对治疗后进行随访的革兰氏阳性菌感染患者进行了疗效判断;文献[32]中两组均有患者在治疗结束前死亡或出现药物不良反应而终止治疗,故两者的患者例数与表1不同)。
2.3.4 用药时间 10项研究[15,20-22,24-25,31-34]报道了用藥时间,各研究间无统计学异质性(P=0.07,I 2=44%),采用固定效应模型进行Meta分析,详见图7。Meta分析结果显示,两组患者的用药时间比较,差异无统计学意义[MD=-0.50,95%CI(-1.40,0.39),P=0.27][因文献[15]为根据万古霉素给药的临床适应证(革兰氏阳性菌菌血症、未确诊革兰氏阳性菌菌血症的脓毒症或肺炎)对患者进行亚组分析,此处两组例数为各亚组患者例数之和,故两组患者例数与表1不同]。
2.3.5 肾毒性发生率 14项研究[15-16,19-23,27-30,32-34]报道了肾毒性发生率,各研究间无统计学异质性(P=0.78,I 2=0),采用固定效应模型进行Meta分析,详见图8。Meta分析结果显示,试验组患者的肾毒性发生率显著低于对照组[RR=0.56,95%CI(0.45,0.70),P<0.000 01](因文献[20]中试验组有51例、对照组有48例分别于治疗前后测定了血清肌酐水平;文献[27]中排除了在使用万古霉素前已经开始肾替代治疗的患者,故两者的患者例数与表1不同)。
2.3.6 病死率 7项研究[15-16,22,24-25,30,33]报道了病死率,各研究间无统计学异质性(P=0.38,I 2=6%),采用固定效应模型进行Meta分析,详见图9。Meta分析结果显示,两组患者的病死率比较,差异无统计学意义[RR=1.03,95%CI(0.78,1.35),P=0.83](因文献[25]中有患者转院治疗,未能进行随访,故两组患者例数与表1不同)。
2.4 发表偏倚分析
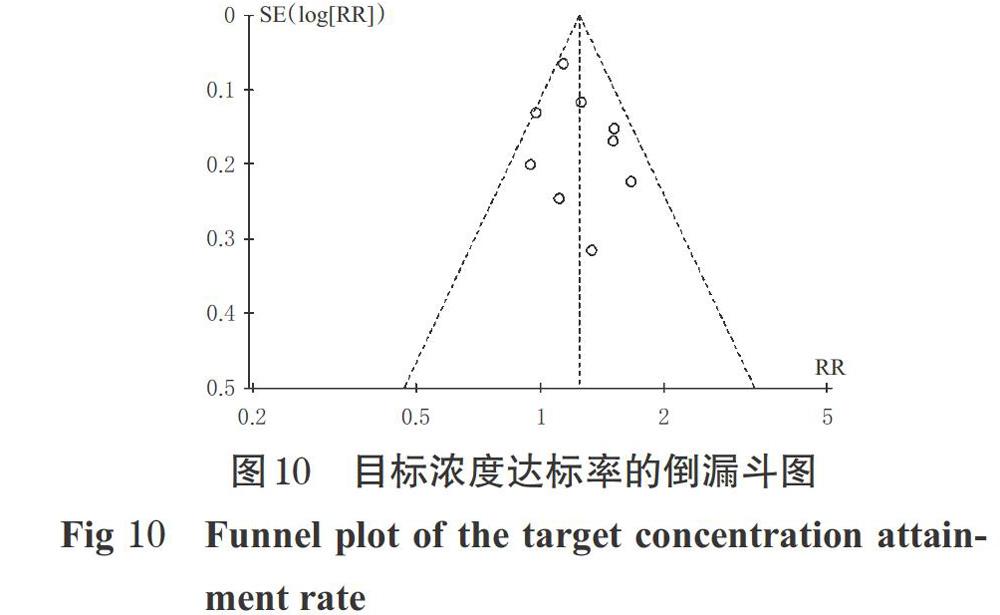
以研究较多的主要疗效指标目标浓度达标率为对象绘制倒漏斗图,结果见图10。由图10可见,除有两个研究散点在倒漏斗线上外,其余各研究散点均在倒漏斗图范围内,左右两边基本对称,提示本研究存在发表偏倚的可能性较小。
3 讨论
万古霉素在临床应用广泛,对革兰氏阳性菌有强大的杀灭作用,尤其对MRSA、MRSE、肠球菌等所致的严重感染的治疗效果较好[2]。该药主要通过抑制细菌细胞壁的合成、损伤细菌细胞膜,抑制细菌 RNA 合成而发挥抗菌作用[1]。万古霉素常见的给药方式包括IIV和CIV,且输注速度不宜过快,输注速度过快是发生红人综合征的主要原因,临床使用时建议每克万古霉素至少需加入溶剂200 mL ,滴注时间不少于1 h,或最大滴速不高于 10 mg/L[35]。万古霉素治疗窗窄,血药浓度过低无法达到治疗效果且易导致耐药,血药浓度过高则易引起耳肾毒性[36]。因此,临床应用时需注意控制输注速度,加强血药浓度监测,以保障安全合理用药。
AUC/MIC≥400是预测万古霉素临床疗效的最佳指标,但因其实际操作复杂,故临床将谷浓度作为AUC/MIC≥400的替代指标[5-6]。但有研究认为,谷浓度与AUC的相关性不高,15~20 mg/L的谷浓度不能作为AUC/MIC≥400的替代指标[37]。因此,通过监测AUC来调整万古霉素的给药方案更为可靠。本研究结果显示,试验组患者目标浓度达标率和AUC/MIC≥400达标率均显著高于对照组。这提示,万古霉素CIV更易达到疗效靶值。但由于两组患者的目标浓度达标指标不统一(对照组为稳态谷浓度,试验组为稳态坪浓度),使得结果有一定的偏倚,而AUC/MIC≥400达标率更能准确反映两种输注方式的差别。本研究中,两组患者的治疗有效率比较,差异无统计学意义。其原因可能与抗感染治疗效果除与抗菌药物的使用情况(给药途径、用量、频次、用药时机等)有关外,还有可能会受到患者机体状况、疾病严重程度、蛋白支持情况、水电解质酸碱平衡的维持和其他对症治疗等因素的影响[38]。
有研究表明,万古霉素的肾毒性与AUC或谷浓度有关[39-40]。由于万古霉素个体差异较大,因此使用时需调整剂量,CIV能准确快速地调节万古霉素的AUC或浓度至目标范围,降低肾毒性的发生风险[3]。可见,对于肾功能不全、老年人、新生儿等患者,在使用万古霉素治疗时,可采用CIV,同时监测其血药浓度、肾功能,以减少肾毒性的发生。本研究结果显示,试验组患者肾毒性发生率显著低于对照组。这提示,万古霉素CIV时所致肾毒性的发生率较低。
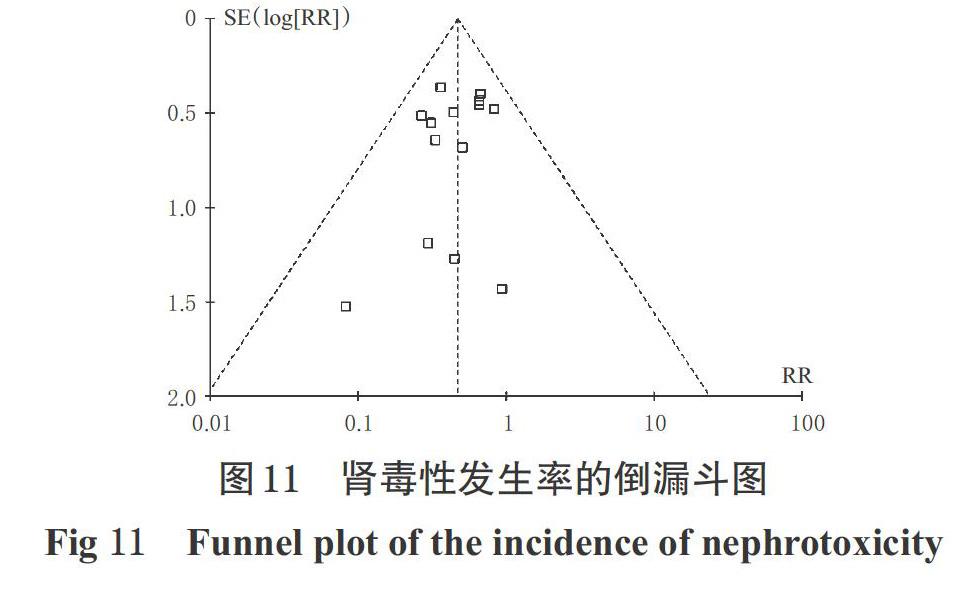
本研究中,两组患者的用药时间和病死率比较,差异均无统计学意义。患者用药时间长短和死亡的影响因素复杂,与其生理状况、疾病严重程度、感染及部位等有关[38,41]。由于本研究中仅有一项研究明确患者为感染导致的死亡[33],其余研究均未详细说明死亡原因,因此万古霉素输注方式与用药时间和病死率的相关性尚需设计更为严谨的高质量研究进一步验证。发表偏倚结果显示,以目标浓度达标率为指标时,本研究存在发表偏倚的可能性较小,但因纳入研究有限,该结论还需更多研究进一步验证;以肾毒性发生率为指标时,本研究存在发表偏倚的可能性较大,虽然本研究严格按检索策略收集文献,但仍可能有少量已发表的文献、灰色文献等缺失,而导致偏倚的产生。
综上所述,万古霉素CIV能提高目标浓度达标率和AUC/MIC≥400达标率,降低患者肾毒性发生率,但不能提高治疗有效率。由于发表偏倚分析结果不一致,故上述结论需谨慎解读。本研究的局限性为:(1)万古霉素谷浓度的采集应在第5剂给药前30 min,而本文纳入的研究均未详细描述或采样时间不准确,可能存在测量偏倚;(2)本研究对两种输注方式无法实施盲法,可能导致实施偏倚;(3)本文未限制纳入的研究人群及用药方案,可能导致结果偏倚;(4)纳入研究多为队列研究,仅少数为RCT,研究质量不高;(5)少数研究间可比性不佳,存在混杂因素干扰(如年龄、体质量等),可能导致研究结果间出现异质性。故此结论仍有待更多大样本、多中心、高质量的RCT进一步证实。
参考文献
[ 1 ] 周良辅,翁心华,黄仲义,等.万古霉素临床应用中国专家共识[J].中国新药与临床杂志,2011,30(8):561-573.
[ 2 ] 刘永芳.万古霉素的临床应用及耐药现状[J].华西医学,2005,20(1):199-200.
[ 3 ] 范亚新,张菁.万古霉素药动学/药效学及个体化给药[J].中国感染与化疗杂志,2019,19(3):323-330.
[ 4 ] 中国医药教育协会感染疾病专业委员会.抗菌药物药代动力学/药效学理论临床应用专家共识[J].中华结核和呼吸杂志,2018,41(6):409-445.
[ 5 ] 翟所迪,贺蓓,王睿,等.《中国万古霉素治疗药物监测指南》解读[J].中国临床药理学杂志,2016,32(17):1633- 1636.
[ 6 ] LIU C,BAYER A,COSGROVE SE,et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant staphylococcus aureus infections in adults and children[J]. Clin Infect Dis,2011,52(3):285-292.
[ 7 ] SAUGEL B,GRAMM C,WAGNER JY,et al. Evaluation of a dosing regimen for continuous vancomycin infusion in critically ill patients:an observational study in intensive care unit patients[J]. J Crit Care,2014. DOI:10.1016/j.jcrc.2013.12.007.
[ 8 ] DONG H,ZHONG Y. Response to:‘continuous versus intermittent infusion of vancomycin in adult patients:a systematic review and meta-analysis[J]. Int J Antimicrob Agents,2016,48(1):114-115.
[ 9 ] 薛敬一,徐晓涵,陈恳,等.万古霉素持续输注与间断输注的系统评价与Meta 分析[J].中国临床药理学杂志,2015,31(13):1348-1352.
[10] 郑丽丽,轩辕欢,姜倩,等.比较万古霉素持续输注与间断输注引起肾毒性的荟萃分析[J].药学实践杂志,2018,36(2):136-139.
[11] 《抗菌药物临床试验技术指导原则》写作组.抗菌药物临床试验技术指导原则[J].中国临床药理学杂志,2014,30(9):844-856.
[12] 王秋雁,何瑾,王晶晶,等.万古霉素不同给药方式所致肾毒性[J].中国医院藥学杂志,2017,37(11):1108-1111.
[13] HIGGINS JPT,THOMAS J,CHANDLER J,et al. Cochrane handbook for systematic reviews of interventions version 6.0[EB/OL].[2020-03-29]. http://www.training.cochrane.org/handbook.
[14] WELLS GA,SHEA B,OCONNELL D,et al. The Newcastle-Ottawa Scale(NOS)for assessing the quality of nonrandomised studies in meta-analyses[EB/OL].[2020- 03-29]. http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp.
[15] AKERS KS,COTA JM,CHUNG KK,et al. Serum vancomycin levels resulting from continuous or intermittent infusion in critically ill burn patients with or without continuous renal replacement therapy[J]. J Burn Care Res,2012,33(6):e254-e262.
[16] BISSELL BD,RIGGI G,MORRISON C. Evaluation of continuous infusion vancomycin administration in a critically ill trauma population[EB/OL].(2018-04-11)[2020-01-20]. https://pubmed.ncbi.nlm.nih.gov/29642744/.
[17] BLOT S,KOULENTI D,AKOVA M,et al. Does contemporary vancomycin dosing achieve therapeutic targets in a heterogeneous clinical cohort of critically ill patients:data from the multinational dali study[J]. Crit Care,2014. DOI:10.1186/cc13874.
[18] DEMIREL B,IMAMOGLU E,GURSOY T,et al. Comparison of intermittent versus continuous vancomycin infusion for the treatment of late-onset sepsis in preterm infants[J]. J Neonatal Perinatal Med,2015,8(2):149-155.
[19] DUSZYNSKA W,TACCONE FS,HURKACZ M,et al.Continuous vs. intermittent vancomycin therapy for Gram- positive infections not caused by methicillin-resistant Staphylococcus aureus[J]. Minerva Anestesiol,2016,82(3):284-293.
[20] GWEE A,CRANSWICK N,MCMULLAN B,et al. Continuous versus intermittent vancomycin infusions in infants:a randomized controlled trial[J]. Pediatrics,2019. DOI:10.1542/peds.2018-2179.
[21] HONG LT,GOOLSBY TA,SHERMAN DS,et al. Continuous infusion vs intermittent vancomycin in neurosurgical intensive care unit patients[J]. J Crit Care,2015. DOI:10.1016/j.jcrc.2015.06.012.
[22] HUTSCHALA D,KINSTNER C,SKHIRDLADZE K,et al. Influence of vancomycin on renal function in critically ill patients after cardiac surgery:continuous versus intermittent infusion[J]. Anesthesiology,2009,111(2):356- 365.
[23] INGRAM PR,LYE DC,FISHER DA,et al. Nephrotoxicity of continuous versus intermittent infusion of vancomycin in outpatient parenteral antimicrobial therapy[J]. Int J Antimicrob Agents,2009,34(6):570-574.
[24] LIN H,BUKOVSKAYA Y,DE MOYA M,et al. Vancomycin continuous infusion versus intermittent infusion during continuous venovenous hemofiltration:slow and steady may win the race[J]. Ann Intensive Care,2015. DOI:10.1186/s13613-015-0048-x.
[25] MA NH,WALKER SAN,ELLIGSEN M,et al. Retrospective multicentre matched cohort study comparing safety and efficacy outcomes of intermittent-infusion versus continuous-infusion vancomycin[J]. J Antimicrob Chemother,2020,75(4):1038-1046.
[26] VAN MAARSEVEEN EM,GIPMANS S,VASBINDER E,et al. Switching from intermittent to continuous infusion of vancomycin in critically ill patients:toward a more robust exposure[J]. Ther Drug Monit,2016,38(3):398- 401.
[27] SAUGEL B,NOWACK MC,HAPFELMEIER A,et al.Continuous intravenous administration of vancomycin in medical intensive care unit patients[J]. J Crit Care,2013. DOI:10.1016/j.jcrc.2012,02.003.
[28] SCHMELZER TM,CHRISTMAS AB,NORTON HJ,et al. Vancomycin intermittent dosing versus continuous infusion for treatment of ventilatorassociated pneumonia in trauma patients[J]. Am Surg,2013,79(11):1185-1190.
[29] SHAKERANEH P,FAZILI T,WANG D,et al. Nephrotoxicity risk and clinical effectiveness of continuous versus intermittent infusion vancomycin among patients in an outpatient parenteral antimicrobial therapy program[J].Pharmacotherapy,2020,40(4):357-362.
[30] TAFELSKI S,NACHTIGALL I,TROEGER U,et al. Observational clinical study on the effects of different dosing regimens on vancomycin target levels in critically ill patients:continuous versus intermittent application[J]. J Infect Public Health,2015,8(4):355-363.
[31] VERRALL AJ,LLORIN R,TAM VH,et al. Efficacy of continuous infusion of vancomycin for the outpatient treatment of methicillin-resistant staphylococcus aureus infections[J]. J Antimicrob Chemother,2012,67(12):2970- 2973.
[32] VUAGNAT A,STERN R,LOTTHE A,et al. High dose vancomycin for osteomyelitis:continuous vs. intermittent infusion[J]. J Clin Pharm Ther,2004,29(4):351-357.
[33] WYSOCKI M,DELATOUR F,FAURISSON F,et al. Continuous versus intermittent infusion of vancomycin in severe staphylococcal infections:prospective multicenter randomized study[J]. Antimicrob Agents Chemother,2001.DOI:10.1128/aac.45.9.
[34] 杜聰梅.万古霉素持续滴注对血浆药物浓度的影响及临床研究[D].苏州:苏州大学,2017.
[35] 郑小娟,程燕燕,吴梅花,等.万古霉素致红人综合征的文献分析[J].临床合理用药杂志,2019,12(3A):130-131.
[36] 张弨,单爱莲.基于治疗药物监测制定万古霉素给药方案路径研究[J].中国临床药理学杂志,2017,33(23):2484- 2488.
[37] DRENNAN PG,BEGG EJ,GARDINER SJ,et al. The dosing and monitoring of vancomycin:what is the best way forward? [J]. Int J Antimicrob Agents,2019,53(4):401-407.
[38] 汪复,张婴元.实用抗感染治疗学[M]. 2版.北京:人民卫生出版社,2015:130-131.
[39] NEELY MN,KATO L,YOUN G,et al. Prospective trial on the use of trough concentration versus area under the curve to determine therapeutic vancomycin dosing[J]. Antimicrob Agents Chemother,2018. DOI:10.1128/aac. 02042-17.
[40] VAN HAL SJ,PATERSON DL,LODISE TP,et al. Systematic review and meta-analysis of vancomycin-induced nephrotoxicity associated with dosing schedules that maintain troughs between 15 and 20 milligrams per liter[J]. Antimicrob Agents Chemother,2013. DOI:10.1128/aac. 01568-12.
[41] 刘玉美.抗生素治疗感染性疾病失败的常见原因分析[J].山东医药,2007,47(25):104.
(收稿日期:2020-05-26 修回日期:2020-09-19)
(编辑:陈 宏)

