酶解鹿茸多肽促进人成骨细胞增殖分化的活性研究
刘颖男,吴晓冬,徐嘉鸿,张玉成*,王 华
(1.吉林大学中日联谊医院 a.科学研究中心;b.药剂科,吉林 长春130033;2.长春市人民医院 神经内科)
鹿茸系鹿科动物梅花鹿或马鹿尚未骨化的幼角,含有蛋白质、氨基酸、糖类、无机元素、生物胺、核苷及多种无机物质[1]。其中蛋白质含量丰富,是鹿茸的主要功能成分之一[2],我国对鹿茸的研究主要集中在对其粗提物,如乙醇萃取物[3]等的功能性评价。然而,研究表明鹿茸中蛋白质经酶解可产生生物活性肽,具有抗氧化[4]、抗骨质疏松[5,6]、促进细胞增殖[7]等多种生物活性。体外实验中,通常采用骨肉瘤来源的成骨样细胞作为药物促进成骨细胞形成功能的实验模型[8],本研究采用人成骨肉瘤细胞的OS-732成骨样细胞作为细胞模型,乙醇萃取梅花鹿茸有效成分后的残渣为原料,通过酶解鹿茸残渣分离纯化出分子量为500-700Da的活性鹿茸多肽(VAP-Ⅱ-A、VAP-Ⅱ-B)混合组分[9],研究其对人成骨肉瘤细胞(OS-732)增殖活力、细胞周期、相关mRNA含量的影响,旨在揭示鹿茸多肽促进成骨细胞的增殖能力,并为探讨其作用机理和开发治疗骨质疏松症的鹿茸寡肽药物提供依据。
1 材料与方法
1.1 试验材料人成骨肉瘤细胞OS-732选购自北京积水潭医院;胎牛血清、 胰蛋白酶、 IMDM、 MTT均购自Sigma公司; 细胞周期检测试剂盒、 SB203580(p38 MAPK)均购自碧云天生物技术研究所; Real Time PCR试剂盒购自宝生物工程(大连)有限公司; BMP、CyclinD-1购自华大中天生物;总RNA提取试剂盒购自生工生物(上海)有限公司。
1.2 引物合成合成BMP-2、cyclin D1扩增引物, 进行 SYBR Green I 的嵌合荧光法Real Time PCR反应。 BMP 2引物: 5′-CGTGCTTCTTAGACGGACTG, 3′-TGACCTGAGTGCCTGCGATA;Cyclin D-1引物:5′-ACGAAGGTCTGCGCGTGTT,3′CCGCTGGCCATGAACTACCT; 内参GAPDH: 5′TGCACCACCAACTGCTTAGC, 3′-GGCATGGACTGTGGTCATGAG。 通过和内参GAPDH比较, 确定样品中目的基因的mRNA水平。
1.3 鹿茸多肽对人成骨肉瘤细胞(OS-732)的增殖作用MTT检验以6×103/孔细胞接种于96孔板,37 ℃、5%CO2培养24 h。加入含鹿茸多肽提取物培养基(0、 100、 200 μg/mL)继续培养1-7天, 提前4 h加入MTT溶液20 μl, 加入100 μl DMSO, 振荡使结晶物充分溶解。 490 nm条件下, 利用酶联免疫检测仪测定各孔光吸收值, 记录结果。 SPSS统计法分析出最佳鹿茸多肽浓度。
1.4 细胞周期检测应用细胞周期检测试剂盒进行细胞增殖试验。空白对照组和加入鹿茸多肽(0、 100、 200 μg/mL)人成骨肉瘤细胞(OS-732)组分别加入约1 ml预冷的PBS溶液重悬细胞, 70%预冷乙醇, 混匀后4℃ 固定12-24 h。每管细胞样品中加入0.5 ml碘化丙啶染色液, 37℃避光温浴30 min。 流式细胞仪检测红色荧光, 激发波长488 nm。
1.5 碱性磷酸酶(ALP)活性的检测成骨细胞中分泌ALP水平与成骨细胞的活性有较好的相关性,可以作为骨形成的有效指标[10]。 以人成骨肉瘤细胞(OS-732)4×104/孔于6孔板中,加入含鹿茸多肽(最佳作用浓度)培养液于37 ℃, 5% CO2继续培养24 h。固定后 37 ℃、 5% CO2继续孵育4 h。2%硝酸钴浸泡5 min, 1% 硫化铵浸泡2 min。 蒸馏水冲洗, 晾干。 在显微镜下观察细胞制片的染色情况。
1.6 p38 MAPK对OS-732细胞的影响依照MTT法和流式细胞术检测法检测抑制剂对人成骨肉瘤细胞(OS-732)增殖的影响。 加入含有鹿茸多肽(最佳作用浓度)培养液培养细胞; 加入抑制剂组细胞提前20 min加入抑制剂后再加入含鹿茸多肽培养基。 设置不加入抑制剂与鹿茸多肽的对照组。
1.7 Real Time PCR检测OS-732细胞中BMPmRNA的相对含量加入含鹿茸多肽(最佳作用浓度)完全培养基培养细胞, 设置对照组。 UNIQ-10柱式Trizol总RNA的提取, 采用Quant cDNA第一链合成试剂盒完成逆转录。 通过与内参GAPDH比较, 确定样品中目的基因的mRNA水平。 Stage 1: 预变性95 ℃, 30 s; Stage 2: PCR反应 95 ℃, 3 s,60 ℃,30 s循环40次; Melt Stage:95 ℃,15 s,60 ℃,1 min,95 ℃,15 s。
2 结果
2.1 细胞的生理活性将胎牛血清加入到IMDM培养基中培养人成骨肉瘤细胞(OS-732)作为对照, 贴壁生长后的细胞形态如图 1A 所示。加入酶解鹿茸多肽(VAP-Ⅱ-A)组分培养的细胞(图 1B)形态无明显变化, 2天后细胞呈指数增长,细胞体积增大,胞浆丰富,3-4天后细胞融合。
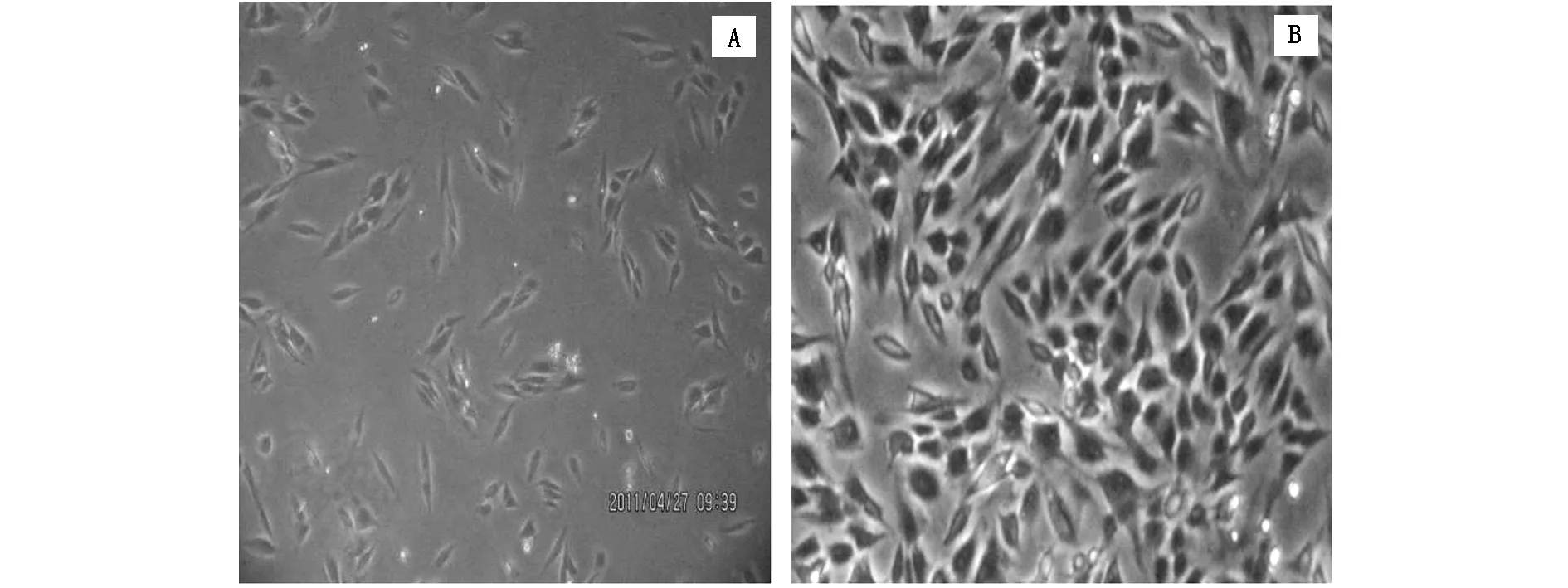
图1 人成骨肉瘤细胞OS-732形态(200×)对照组 (A);鹿茸多肽VAP-Ⅱ-A(200 mg/L) (B)
2.2 鹿茸多肽对成骨肉瘤细胞增殖能力的影响VAP-Ⅱ-A(200 μg∕mL)与对照组相比增殖作用更明显(P<0.01),具有统计学意义, 如表1所示。
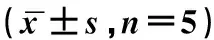
表1 鹿茸多肽(VAP-Ⅱ-B)对人成骨肉瘤细胞增殖的影响
2.3 鹿茸多肽对细胞周期的影响流式细胞术方法分析结果如图2所示,与对照组细胞(图2A)比较, 加入鹿茸多肽(VAP-Ⅱ-A)(图2B)能够明显的促进人成骨肉瘤细胞(OS-732)的周期转化, 细胞周期S+G2期细胞指数明显提高, 表现为S期的DNA含量明显上升, 说明鹿茸多肽对细胞有明显的增殖作用。
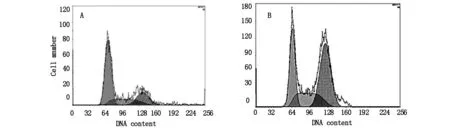
图2 鹿茸多肽(VAP-Ⅱ-A)对细胞周期的影响对照组 (A);鹿茸多肽(VAP-Ⅱ-A,200 mg/L) (B)
2.4 细胞的碱性磷酸酶(ALP)活性检测采用改良钙-钴法检测细胞的ALP活性, 显微镜下40×结果如图3。 与空白对照组灰色相比, 加入鹿茸多肽(VAP-Ⅱ-A)组人成骨肉瘤细胞(OS-732,200 μg/mL)呈黑灰色, 分布密集, 活性明显高于空白对照组, 这表明鹿茸多肽(VAP-Ⅱ-A)能够促进人成骨肉瘤细胞(OS-732)合成ALP,促进其向成骨特征方向分化。

图3 鹿茸多肽(VAP-Ⅱ-A)对成骨肉瘤细胞ALP活性的影响Control group (40×) (A);VAP-Ⅱ-A:200 μg/mL( 40×) (B)
2.5 p38 MAPK对细胞增殖的影响鹿茸多肽(VAP-Ⅱ-A)能够明显促进人成骨肉瘤细胞(OS-732)的增殖。 提前加入阻断剂p38 MAPK 阻断信号转导通路后, 再加入鹿茸多肽(VAP-Ⅱ-A)组与对照组比较仍然能够明显提高S+G2期在细胞周期中所占比例,促进细胞增殖(P<0.01)。 而加入抑制剂组与加入鹿茸多肽(VAP-Ⅱ-A)组比较, 细胞增殖活力(如表2,P<0.01)及周期转化无明显差异(如图4)。 即阻断剂p38 MAPK对人成骨肉瘤细胞(OS-732)增殖无影响。
图4 细胞抑制剂对OS-732细胞的影响对照组 (A);加入鹿茸多肽(VAP-Ⅱ-A ,200 μg/mL) (B);加入 p38 MAPK(C)
表2 鹿茸多肽(VAP-Ⅱ-A)对人成骨肉瘤细胞的增殖作用
2.6 人成骨肉瘤细胞(OS-732)中BMP、CyclinD-1基因的mRNA相对含量差异应用Real-Time PCR
方法检测得到融解曲线及扩增曲线。 与空白对照组比较, 加入鹿茸多肽(VAP-Ⅱ-A)组的人成骨肉瘤细胞(OS-732)中BMP、(Cyclin)D1和内参(GAPDH)均有mRNA相对含量的差异, 其中BMPmRNA相对含量提高7倍(表3,P<0.01), 这与鹿茸多肽(VAP-Ⅱ-A)能够促进人成骨肉瘤细胞(OS-732)的分化与增殖紧密相关。
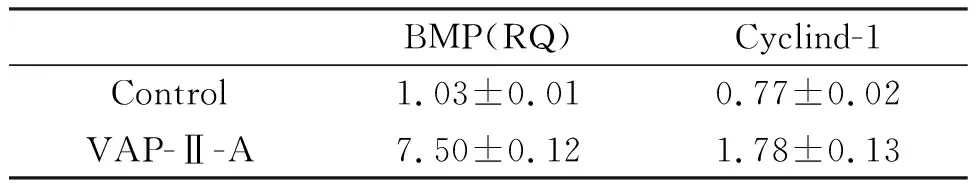
表3 Real-Time PCR 检测OS-732细胞BMPmRNA表达
3 讨论
本研究首先采集乙醇萃取新鲜梅花鹿鹿茸的活性成分后的残渣,通过酶解法得到活性鹿茸多肽(VAP-Ⅱ-A), 分子量为500-700Da。 研究表明酶解鹿茸残渣中的蛋白质含量为乙醇萃取物的5倍。 另外, 酶解鹿茸多肽混合物成分中的多种氨基酸组分中甘氨酸(Gly)和谷氨酸(Glu)含量较高。 酶解法得到的鹿茸多肽(VAP-Ⅱ-A)能够使OS-732细胞碱性磷酸酶表达增加。 同时, 细胞生长周期表现为G2+S期所占比例明显较G1期所占比例提高。 本文通过加入细胞通路抑制剂(P38 MAPK)作为对照, 证实了细胞通路抑制剂对鹿茸多肽促进人成骨肉瘤细胞(OS-732)的增殖作用没有明显影响。 鹿茸多肽(VAP-Ⅱ-A)作用后细胞中的BMP及Cyclind-1mRNA相对含量比对照组显著提高, 进一步证实了鹿茸多肽促进人成骨肉瘤细胞(OS-732)增殖作用的可能机理。 本研究对鹿茸在临床上促进骨质生长、 治疗骨质疏松等作用的深入研究以及筛选具有防治骨质疏松的活性鹿茸因子等方面提供了实验依据。

