5hmc在非霍奇金淋巴瘤中免疫表型特征探讨
王学菊,王雪梅,杨绍娟,王丽萍
(吉林大学中日联谊医院 病理科,吉林 长春130033)
DNA启动子或编码区CpG岛甲基化可通过转录抑制途径参与恶性肿瘤的发生和化疗药的耐药[1]。胞嘧啶5’位点甲基化(5-methylcytosine,5mc)是恶性肿瘤中常见的DNA甲基化位点[2]。5mc的形成是一个可逆的过程,研究显示TERT家族蛋白可将5mc进一步氧化为5-羟甲基胞嘧啶(5-hydroxymethylcytosine,5hmc),从而进入胸腺DNA合成途径[3]。恶性肿瘤,包括淋巴瘤中5hmC表达缺失预后差[4-6],提示监测5hmc表达水平有助于判断预后和疗效评估。非霍奇金淋巴瘤是最为常见的淋巴瘤类型,尚未有详细研究探明其甲基化状态[7]。本研究选取非霍奇金淋巴瘤代表性病例通过观察5hmc表达情况探讨其氧化途径是否存在抑制现象。
1 材料与方法
1.1 研究资料
实验中共收集了33例回顾性淋巴瘤病例,高侵袭性B细胞淋巴瘤16例,其中弥漫大B细胞淋巴瘤13例,FL III级1例,富于T和组织细胞的大B细胞淋巴瘤1例,Burkitt淋巴瘤1例,发病年龄23岁-81岁,男性7例、女性9例;T细胞淋巴瘤17例,其中非特殊型周围T细胞淋巴瘤11例,单形性亲上皮型T细胞淋巴瘤 3例,间变大细胞淋巴瘤、T细胞白血病和NK/T细胞淋巴瘤各1例,发病年龄26-71岁,男性11例、女性6例。
1.2 免疫组化及结果判读
实验病例石蜡包埋标本用于免疫组化的切片厚度为3 μm。5hmc抗体(兔源性多抗,购自Active motif公司) 1∶1500稀释。免疫组化流程参照试剂盒说明书。5hmc为细胞核着色,所有染色切片经两名病理科医生判定,评分标准如下:阴性(无着色),1-50%细胞阳性,>50%细胞阳性[8]。
1.3 统计分析
采用Graphpad Prism 8.3.0对B细胞淋巴瘤和T细胞淋巴瘤表达率进行卡方检验,P值小于0.05认为具有统计学差异。
2 结果
在所有检测病例中残存正常淋巴细胞5hmc在细胞核强阳性表达,为实验提供内对照。结果如表1、图1所示。和正常淋巴细胞相比,16例高侵袭性B细胞淋巴瘤7例无着色(7/16,43.7%),8例肿瘤细胞阳性率低于50%(8/16,50%),1例阳性细胞数大于50%(1/16,6.3%)。17例T细胞淋巴瘤病例中15例无着色(15/17,88.2%),1例阳性细胞数低于50%(1/17,5.9%),1例阳性细胞数大于50%(1/17,5.9%)。
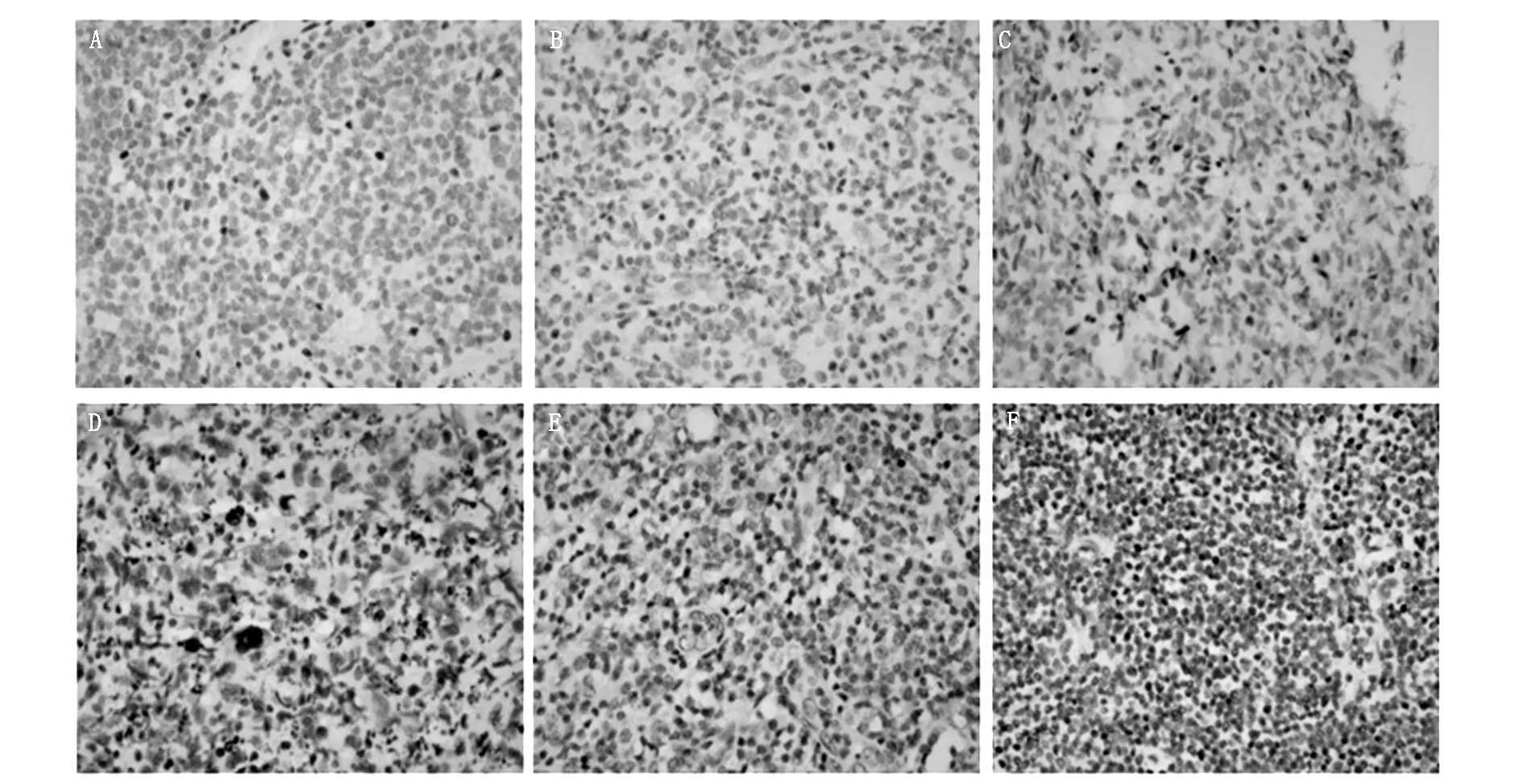
图1 非霍奇金淋巴瘤5hmc免疫表型特征代表性病例(×100)。A-C为高侵袭性B细胞淋巴瘤代表性病例表达情况。A为阴性表达,B为散在弱阳性表达,C为弥漫中等或强阳性表达。D-F为T细胞淋巴瘤代表性病例表达情况。D为阴性表达,E为散在弱阳性表达,F为弥漫强阳性表达
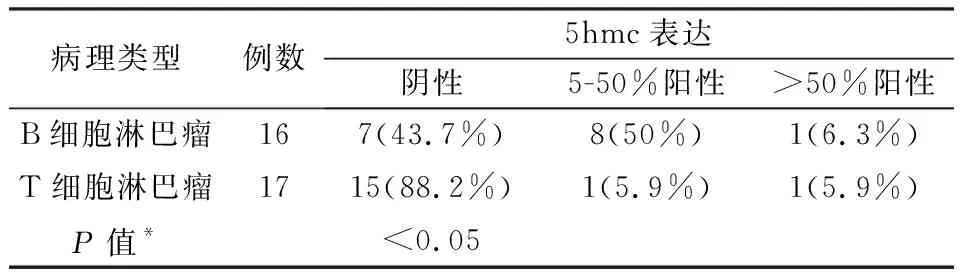
表1 5hmc在非霍奇金淋巴瘤中的表达情况
对B细胞淋巴瘤和T细胞淋巴瘤病例进行5hmc表达率的比较,结果显示T细胞淋巴瘤中5hmc阴性率高于其在B细胞淋巴瘤中的阴性率(P<0.05),提示5hmc在T细胞淋巴瘤比在B细胞淋巴瘤中缺失更为普遍。
3 讨论
本研究检测了5hmc蛋白在常见的非霍奇金淋巴瘤(高侵袭性大B细胞淋巴瘤和T细胞淋巴瘤)的表达情况,发现和实体瘤类似,非霍奇金淋巴瘤5hmc缺失率高,淋巴瘤中CpG岛甲基化现象普遍,而且T细胞淋巴瘤比B细胞淋巴瘤的5hmc缺失率更高。TERT基因家族蛋白与5hmc关系最为密切,髓系白血病和T细胞白血病出现TERT家族基因突变可导致5mc无法被氧化成为5hmc[9],也有研究显示T细胞淋巴瘤中5hmC缺失与上述突变基因之间并无对应关系[10]。
5hmc免疫表达情况或可成为检测淋巴瘤DNA甲基化状态的评估指标之一。 5mc氧化过程可分为主动氧化和被动氧化,主动氧化途径经TET基因家族蛋白催化生成5hmc[3],因此通过检测5hmc可以提示DNA去甲基化的状态。5hmc蛋白定位于细胞核,免疫组化简便易行而且判读方便,因此可将免疫组化方法作为5hmc相关表观遗传学研究的初步筛选途径。
本研究不足之处在于所选择淋巴瘤亚型以及病例数有限,在未来的研究中需要增加病例数量,并且观察5hmc对预后和化疗效果的影响,以提高结论的准确性。

