免疫营养改善肿瘤患者预后
王 欣 张俊璇 高 健 石汉平,*
(1.首都医科大学附属北京世纪坛医院胃肠外科二病区,北京 100038;2.承德医学院第二临床学院消化内科,河北承德 067000;3.首都医科大学附属北京世纪坛医院临床营养科,北京 100038)
营养支持作为常规围手术期的辅助治疗手段之一往往能改善患者预后,延长患者寿命,目前已将营养治疗推荐为一线治疗方式。营养物质不仅为患者提供必要的能量基础,有些营养制剂更是可以抑制肿瘤细胞,预防癌症。本综述将紧扣“肿瘤免疫”的主题,构建营养、免疫和癌症三者之间的密切联系。讨论一些营养物质通过调节机体免疫系统,影响免疫细胞功能,进而改善癌症患者预后,甚至延长患者生命。
1 肿瘤免疫概述
肿瘤和免疫系统之间的关系分为三个阶段,首先是免疫效应细胞消除恶性转化细胞;紧接着,恶性细胞与肿瘤病灶内的免疫反应达到平衡;最后,癌细胞最终逃脱免疫控制,出现增生进展和转移[1]。有效的癌症化学药物治疗(以下简称化疗)或放射治疗(以下简称放疗)通过重新激活免疫监测,增加癌细胞的免疫原性,释放危险相关模式分子(danger-associated molecular patterns,DAMP)[2],消耗免疫抑制白细胞。免疫抑制白细胞包括骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)如树突状细胞(dendritic cells,DCs)、巨噬细胞和(或)粒细胞的前体,还有调节性T细胞(regulatory T cells,Treg),它们具有显著抑制免疫细胞应答的能力[3]。同样,免疫检查点阻滞剂的免疫治疗可以重新激活由耗尽T细胞介导的抗癌反应,重新建立免疫平衡状态[4]。
2 各营养及补充剂与肿瘤免疫
2.1 饮食模式[5]
吃得过多和西式饮食不仅可以导致代谢综合征和肥胖,还有利于亚临床炎性反应状态的产生,从而导致循环促炎细胞因子的增加,如白细胞介素-1β(interleukin-1β,IL-1β)、IL-6,肿瘤坏死因子(tumor necrosis factor,TNF)、分泌型焦磷酸蛋白1(secreted phosphoprotein 1,SPP1)、壳多糖酶3样蛋白1 (chitinase 3-like 1,CHI3L1)、丝氨酸蛋白酶抑制蛋白E1 (serpin family E member 1,SERPINE1);血糖和血脂的升高促进了营养相关激素的分泌,如瘦素、胰岛素及胰岛素样生长因子(insulin-like growth factor,IGF),它们可以抑制自噬[6],并满足癌细胞的代谢需要。肥胖患者肿瘤微环境中的基质肿瘤相关脂肪细胞(stromal cancer-associated adipocytes,CAAs)可以影响肿瘤细胞的行为,导致癌症进展。另外,营养过剩可以通过改变肠道微生物群的组成和代谢,直接或间接地破坏免疫功能。这些异常使机体产生免疫抑制,促进肿瘤发生发展,降低抗癌药物的治疗效果,并加速衰老。吃得过多对健康不利,那么少吃一点呢,见图1,禁食模拟饮食(fasting-mimicking diet,FMD)[7]又叫仿斋戒节食方案,是一种周期性采取模拟禁食效应的新型节食方案,即在第一天喂予正常标准饮食能量的50%,在2~4 d喂予正常标准饮食能量的10%,在随后的5~10 d恢复正常能量饮食。当然也有其他的周期方案。禁食或禁食模拟饮食抑制了由血红素加氧酶-1 (haem oxygenase-1,HMOX-1)介导的骨髓中淋巴细胞前体的增加,进而促进肿瘤免疫。生酮饮食和低碳饮食是摄入足够的蛋白质、高脂肪、低碳水化合物的饮食模式,会降低循环葡萄糖的浓度,增加游离脂肪酸和酮体,如乙酰乙酸盐和β-羟基丁酸,这些变化也发生在禁食或运动之后[8]。酮体β-羟基丁酸高效抑制NOD样受体家族3(nucleotide binding oligomerization domain-like receptors,NLRP3)炎性小体进而促进肿瘤免疫。值得注意的是,禁食所产生的酮体可缓解细菌感染和脂多糖介导的脓毒性休克[9],所以在炎症感染的时候往往食欲不振,这可能是某种机体进化上的防御机制。禁食或禁食模拟饮食,低热量饮食还可导致IGF1循环浓度的降低和自噬的激活,肿瘤细胞三磷酸腺苷(adenosine triphosphate,ATP)释放增加和腺苷下降。当与细胞毒性化疗药物联合使用时,可协同增加CD8+T淋巴细胞和抗原递呈髓细胞的浸润,以及减少免疫抑制相关的叉头状转录因子P3(forkhead box P3,Foxp3)阳性调节性T细胞。此外,激活自噬也参与NLRP3炎性小体的降解,这些策略共同限制炎症反应,增强对肿瘤细胞的适应性免疫反应。虽然热量限制对寿命和健康的有益影响已得到明确的证明,但在生活中很难实行这种限制。为了克服这些困难,老年医学学科研究者和生物学家正试图开发一种药物来模拟热量限制的有益效果,而不需要限制饮食。这些药物被称为热量限制类似物(caloric-restriction mimetics,CRM)[10]。其中包括白藜芦醇(一种从红葡萄皮中分离得到的多酚化合物)、雷帕霉素、二甲双胍等等。
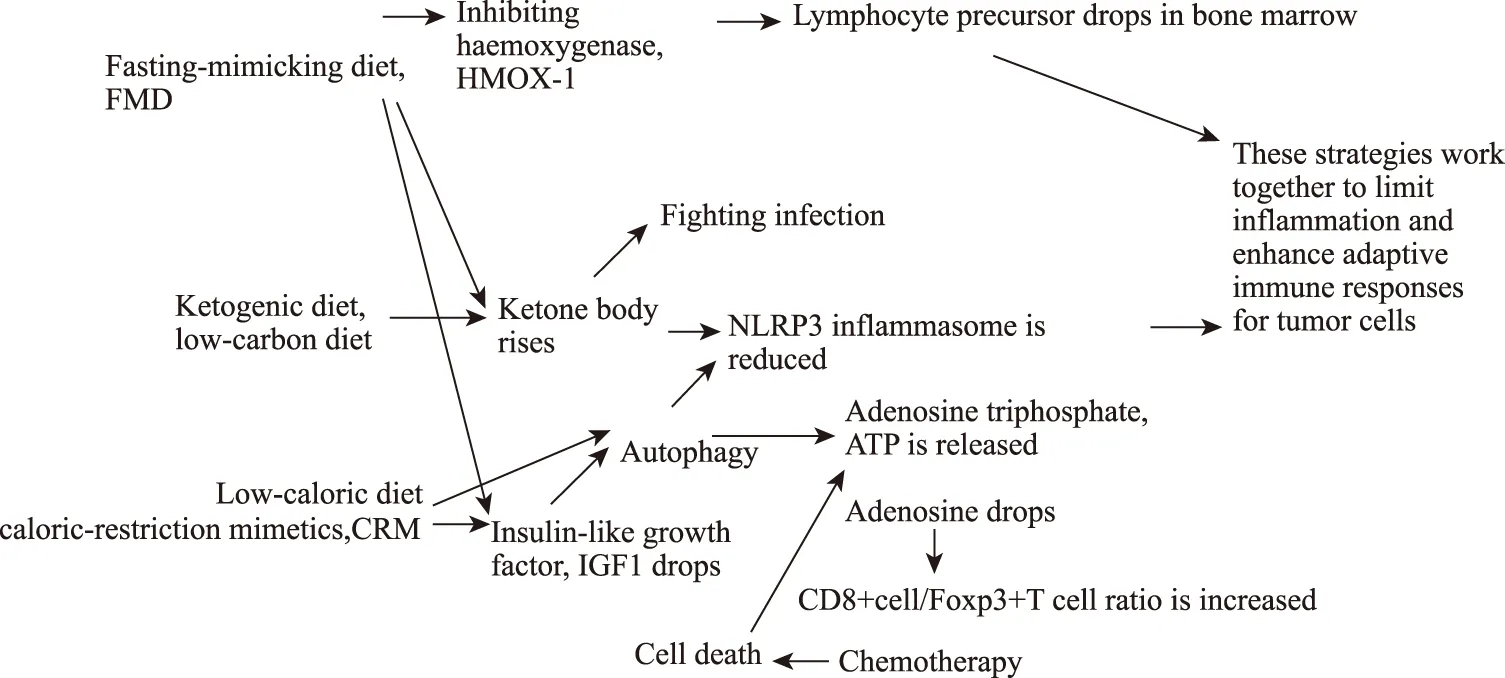
图1 常见饮食模式对肿瘤免疫的有益影响[5]Fig.1 Beneficial effects of some common dietary patterns on tumor immunityFMD:fasting-mimicking diet;HMOX-1:haem oxygenase-1;NLRP3:nucleotide binding oligomerization domain-like receptors;ATP:adenosine triphosphate;CRM:caloric-restriction mimetics;IGF:insulin-like growth factor.
2.2 氨基酸[11]
关于氨基酸,体外实验和动物实验[12-13]表明,低浓度和高浓度的精氨酸对肿瘤免疫都有负面影响。低浓度的精氨酸将导致肿瘤微环境中淋巴细胞的浸润减少。然而,增加的精氨酸浓度最终将导致持续产生的一氧化氮和高浓度的多胺,这有助于肿瘤细胞的增生和发育[14]。因此,平衡浓度的精氨酸才能更好地发挥肿瘤抑制作用[15-16]。谷氨酰胺也非常类似,较低的谷氨酰胺导致自然杀伤细胞(natural killer cell,NK)的细胞毒性功能降低,引发肿瘤细胞的免疫逃逸。但患者的谷氨酰胺浓度增加可激活树突细胞上的谷氨酸受体4进而影响Th17细胞应答[17-18],也导致肿瘤细胞增生和肿瘤生长,此外肿瘤部位的高浓度谷氨酰胺会导致负氮平衡,引发恶病质[19]。所以,抑制肿瘤也要平衡谷氨酰胺的浓度。
2.3 ω-3多不饱和脂肪酸
结肠经常暴露在来自食物、肠道菌群和病原体的各种抗原环境中,肠道免疫系统在维持免疫和恶性转化微妙平衡方面具有重要的地位[20]。肠道Treg细胞抑制了效应T细胞(effect T cell,Teff)的免疫反应,把控并调节肠道免疫反应的强度,维持肠道稳态。虽然Foxp3+ Treg细胞可以抑制肠道微生物群或无害的饮食抗原所引发的异常免疫反应,但它们也会抑制抗肿瘤的免疫监测进而促进肿瘤逃避[21]。队列研究结合动物实验[22]表明,深海鱼油ω-3多不饱和脂肪酸,即二十碳五烯酸、二十二碳五烯酸、二十二碳六烯酸,可以发挥免疫调节T细胞增生和凋亡的作用。深海鱼油ω-3通过降低结肠Treg细胞对Teff细胞的抑制作用进而抗结直肠癌,因此建议深海鱼油ω-3用于结直肠癌的预防和治疗。
2.4 维生素
膳食来源的维生素B6和维生素D3在自然形态中是不活跃的。但进入人体后这些分子在细胞内转化为代谢产物,引发随之而来的生物效应。在肿瘤细胞中,吡哆醇激酶(pyridoxine kinase,PDXK)介导的维生素B6磷酸化,导致其代谢物吡哆醛(pyridoxal,PLP)的产生。通过增加内质网应激引起肿瘤细胞免疫原性死亡,从而增强顺铂(cisplatin,CCDP)的抗肿瘤活性,改善胃肠道肿瘤和非小细胞肺癌患者的预后。维生素D3由细胞色素p450酶CYP27A1和CYP27B1介导,发生羟基化反应,生成具有生物活性的1,25-二羟基维生素D3,存在于肝、肾和免疫细胞中。通过与核维生素D受体(vitamin D receptor,VDR)结合,1,25二羟基维生素D3能够促进抗炎和产生肿瘤免疫方面的基因表达[5],从而改善乳腺癌、前列腺癌和结肠直肠癌患者的预后。动物实验[23]表明,维生素C能够影响免疫细胞的成熟和分化,7.5 g至50 g的大剂量维生素C能够降低促炎细胞因子,但在癌症中,维生素C如何通过调节免疫发挥抗肿瘤作用还尚未确定[11]。有关维生素E在癌症中的作用尚存在争议,但肯定的是维生素E具有一定的免疫保护作用[24]。详见图2。
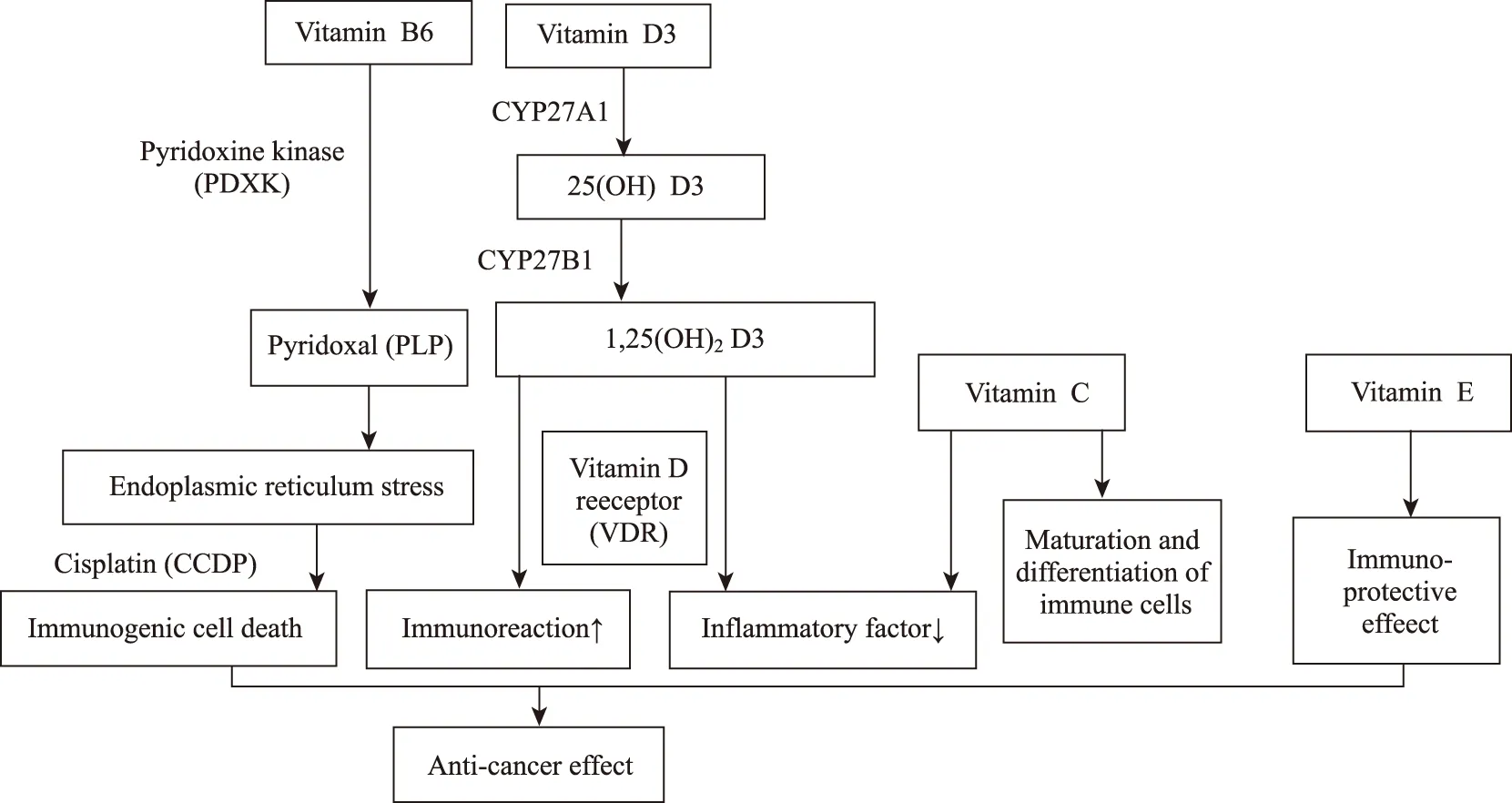
图2 维生素类营养物质对肿瘤免疫的有益影响[5]Fig.2 Beneficial effects of vitamin on tumor immunity
2.5 膳食纤维
膳食纤维增加了结肠固有层和外周血中CD8+ T细胞的比例,提高了NK细胞的活性。可溶性纤维可以被肠道细菌发酵成短链脂肪酸(short-chain fatty acid,SCFAs),参与肠道免疫反应的调节和对结直肠癌的预防[25]。另外短链脂肪酸还可以降低循环炎性反应细胞因子,其中丁酸盐作为正常结肠细胞的主要能量来源,是一种组蛋白去乙酰化酶抑制剂,组蛋白去乙酰化酶抑制剂能有选择性地恢复癌症抑制因子和其他抗癌基因的表达,间接地抑制血管生成因子的表达,帮助阻断对肿瘤的血液供应。另外丁酸盐与程序性死亡受体-配体1肿瘤免疫治疗具有协同作用,可以促进T细胞浸润,增强肿瘤相关T细胞功能,丁酸盐还能与G蛋白偶联受体作用促进结肠巨噬细胞和树突状细胞的抗炎特性,从而诱导Tregs分化[26]。总之膳食纤维可以改善结直肠癌患者的生存率,并降低结直肠癌和胰腺癌的患病风险[27]。
2.6 微量元素[11]
缺锌会影响免疫细胞的发育[28]及其功能。锌摄入量与胃癌、食管癌和结直肠癌风险呈负相关[29]。然而,较高浓度的锌(血清浓度大于30 μm)反过来会抑制免疫细胞功能。锌在免疫调节中的作用知之甚少。文献[11]显示锌可能通过改变膜结构和受体表达来影响免疫细胞和肿瘤细胞之间的信号传导。硒也是人类必不可少的一种微量元素,硒会影响先天性和适应性免疫系统。硒缺乏导致胸腺和淋巴组织中淋巴细胞数量减少。补充硒可增强NK细胞的细胞毒性,激活IL-6和干扰素-γ(interferon-γ,IFN-γ)途径[30],增加T细胞和CD4+T细胞数量[31]。硒的抗肿瘤效果已基本确定,但还需明确适用剂量。
2.7 益生菌
科学家在杰克逊实验室和泰康利农场的C57小鼠身上接种了相同的黑色素瘤细胞,在这两种具有不同肠道共生微生物群的小鼠中,观察到其抗黑色素瘤免疫力的差异,杰克逊实验室的C57小鼠抗黑色素瘤的能力较强,泰康利农场的小鼠肿瘤增长速度较快,这些差异在共同饲养或粪菌移植后被消除[32]。杰克逊实验室小鼠的粪菌能够抑制肿瘤生长,并增加PD-L1特异性抗体治疗肿瘤的效果。对16 S核糖体RNA的测序鉴定出257种差异肠道细菌,其中双歧杆菌与抗肿瘤作用密切相关。综上所述,共生双歧杆菌能够在稳定状态下调节DCs的激活[33],进而改善肿瘤特异性CD8+T细胞效应功能,并辅助增加免疫药物PD-1的疗效,改善多种肿瘤患者的预后。
3 膳食炎症指数
目前,人们意识到营养会影响炎性反应和免疫反应,因此南卡癌症防控项目通过设定膳食炎症指数(dietary inflammatory index,DII)来判断一种饮食是不是可以“抗感染”,并可以成功预测这种饮食对炎症标志物的影响,比如高敏C反应蛋白(high sensitivity C reactive protein,hsCRP)和IL-6[34]。因此,日常饮食中的各类食物可按照一定的标准分为抗炎性反应食物如蒜、膳食纤维、类胡萝卜素、茶、ω-3多不饱和脂肪酸、姜黄、黄酮类和豆类,促炎性反应食物如以红肉为代表的饱和脂肪和反式脂肪,通过促进或抑制体内的炎性反应微环境影响某些疾病,包括癌症的发生和发展。
4 结语与展望
“免疫营养”术语的提出,为新型膳食成分和饮食产生的免疫调节机制的探索提供了新的方向。许多饮食相关因素已被发现具有降低癌症风险和改善肿瘤患者预后的功能。它们的抗肿瘤特性部分是通过免疫调节产生的。那么将考虑构思膳食免疫指数这一概念,用来更好地设计和优化膳食免疫调节剂的组合和效能,进而实现癌症的预防和治疗,改善肿瘤患者的预后,还营养治疗为一线治疗方式。

