根治性胰十二指肠切除术后肠内营养的时机探讨
储霞飞 黄 强 袁 丽 谢 放 胡传来
胰十二指肠切除术(Pancreatoduodenectomy,PD)是目前临床上治疗壶腹周围癌的标准手术方式,由于手术切除范围广、过程复杂、创伤大,导致PD术后常发生较多的并发症和较高的病死率[1-2]。研究[3]发现,PD术后约有50%~60%的患者存在严重营养不良,术后给予合理的营养支持对于减少并发症,改善患者预后具有重要意义[4-5]。较多研究[6-8]已证实相较于全胃肠外营养,PD术后给予肠内营养具有良好效果,但是肠内营养给予的最佳时机尚无定论。本文通过比较患者术后不同时间开始肠内营养的营养指标、术后康复情况及并发症发生情况,拟探讨PD患者肠内营养的最佳时机,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2019年5月至2020年4月在中国科学技术大学附属第一医院(安徽省立医院)行PD的86例患者临床资料。按照PD术后开始肠内营养的时间,分为<24 h组(术后24 h内给予肠内营养)、24 h~组(术后24~48 h内给予肠内营养)及48 h~组(术后48 h后开始肠内营养)3组。纳入标准:年龄≥18岁;行PD且术前未接受放化疗等治疗方式。排除标准:行腹腔镜下PD;患有其他严重躯体疾病者。3组基线资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
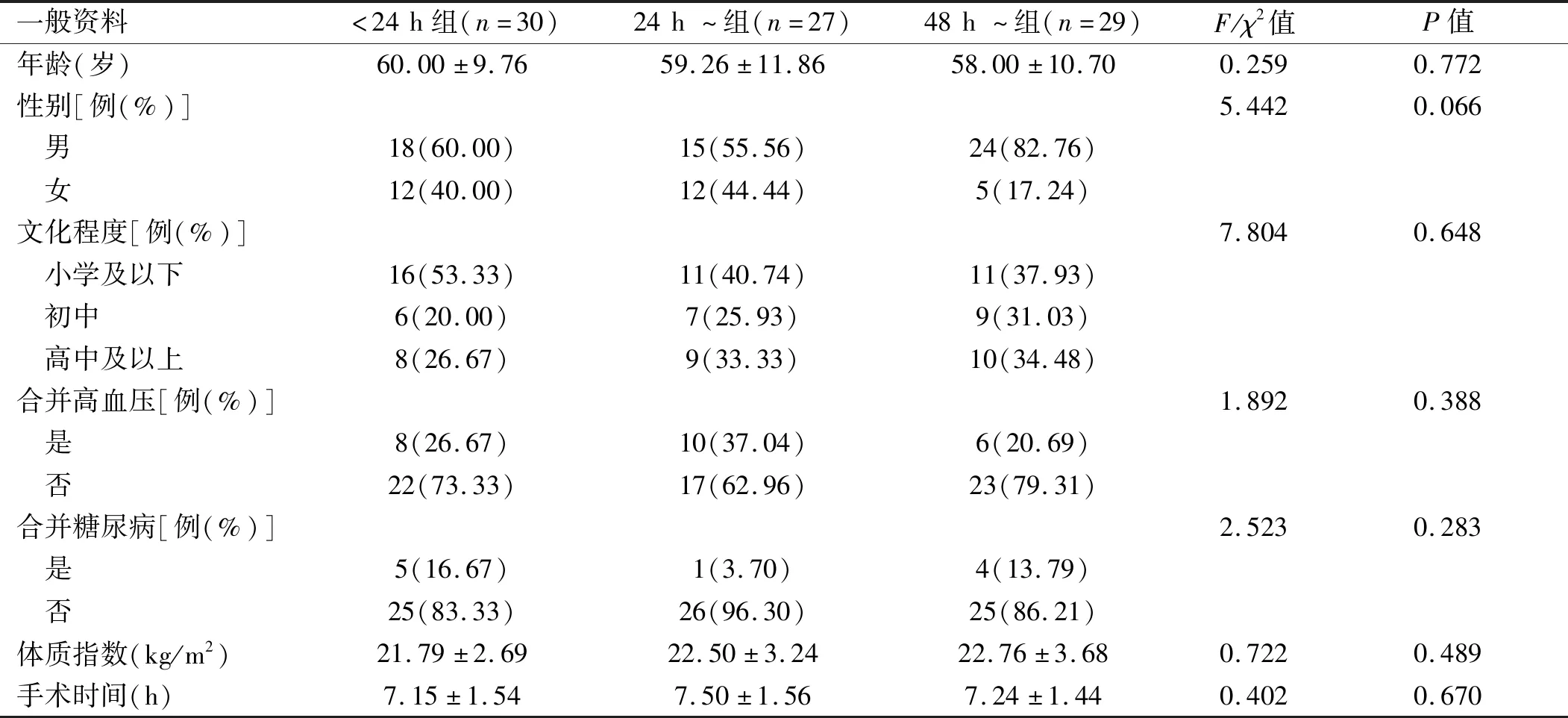
表1 3组一般资料比较
1.2 方法
1.2.1 肠内营养具体方法 3组分别于术后24 h内、24~48 h内、48 h后开始肠内营养,开始肠内营养第一日用肠内营养泵经鼻胃肠管缓慢滴入葡萄糖氯化钠注射液250 mL和氯化钾 20 mL,无不适主诉后次日泵入短肽型肠内营养制剂400 mL(能量373 kcal,脂肪6 g,蛋白质14 g,碳水化合物65 g),后续根据患者耐受情况逐步增加。速率开始设定为20~25 mL/h,滴注过程中密切关注患者胃肠道反应,根据患者反应调整输注速率。除上述营养支持治疗外,各组患者均经静脉滴注抗生素及保肝、护胃、抑酶类等药物和白蛋白、血制品等,用于治疗及维持机体液体量平衡。
1.2.2 观察指标 通过查询医院病历系统获得各组术前、术后第3天及第7天血红蛋白、白蛋白、前蛋白的水平并比较;比较各组术后胃肠道恢复时间(肛门排气时间、经口饮水时间、首次下床时间)、并发症(胰瘘、胆瘘、胃排空延迟、腹腔出血)及肠内营养不耐受发生率,肠内营养不耐受发生率=肠内营养不耐受(发生腹胀、腹泻、恶心、呕吐等)例数/总例数×100%。
2 结果
2.1 3组营养指标比较 3组患者不同时间点白蛋白、前白蛋白水平比较,差异有统计学意义(P<0.05);术前3组患者营养指标比较,差异无统计学意义(P>0.05);术后第3天、第7天患者白蛋白、前白蛋白水平先下降后上升,且<24 h组患者术后第3天和第7天白蛋白、前白蛋白水平均高于其他组(P<0.05),24 h~组和48 h~组不同时间点白蛋白、前白蛋白比较,差异无统计学意义(P>0.05)。见表2。
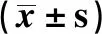
表2 3组营养指标比较
2.2 3组术后恢复情况比较 <24 h组患者首次肛门排气时间、首次下床时间短于24 h~组、48 h~组,差异均有统计学意义(P<0.05),24 h~组、48 h~组恢复情况组间比较,差异无统计学意义(P>0.05)。见表3。

表3 3组术后恢复情况比较
2.3 3组术后并发症发生率比较 3组胰瘘、胆漏、胃排空延迟、腹腔出血发生率比较,差异均无统计学意义(P>0.05)。

表4 3组术后并发症发生率比较[例(%)]
2.4 3组肠内营养不耐受情况比较 <24 h组、24 h~组及48 h~组肠内营养不耐受发生率分别为33.33%、33.33%、44.83%,差异均无统计学意义(χ2=1.087,P=0.581)。
3 讨论
早期肠内营养作为快速康复外科的重要组成部分,其在消化道手术中已得到广泛应用[9-10]。但由于PD手术涉及消化道重建的范围更大且围手术期并发症较多,故胰腺外科医生对PD术后患者的营养策略选择仍然非常谨慎,导致肠内营养在接受PD治疗的患者中开始较晚,且对肠内营养的时间特别是早期肠内营养未形成一个规范化的标准。Correia等[11]通过多中心研究进行荟萃分析发现,PD术后行肠内营养并未增加相关术后并发症的发生,且实施肠内营养的患者住院时间明显短于肠外营养患者。但与之相反的Schnelldorfer等[12]研究发现,由于肠内营养对胰腺外分泌功能的刺激,肠内营养增加了患者术后胰瘘的发生率,同时并未使患者的术后恢复时间缩短。Das等[13]研究发现早期肠内营养相较于肠外营养增加了患者术后胃瘫以及肺部感染等并发症的发生率。本研究通过比较术后不同时间点接受肠内营养患者的预后情况,探讨术后肠内营养给予的最佳时机,以期为临床肠内营养的实施与选择提供参考。
术后白蛋白、前白蛋白水平等实验室指标可作为患者手术预后重要的营养状况独立预测因子。本研究结果显示,术后第3天、第7天患者白蛋白、前白蛋白水平先下降后上升,且<24 h组患者术后第3天和第7天白蛋白、前白蛋白水平均高于其他组(P<0.05),24 h~组和48 h~组不同时间点白蛋白、前白蛋白比较,差异无统计学意义(P>0.05),与相关研究[13]一致。分析原因可能是术后24 h内行肠内营养可帮助患者在术后早期即达到目标营养总量[14]。同时相关研究[15-16]发现,肠道蠕动功能在小肠手术后数小时内即可恢复正常,术后早期给予肠内营养完全能够被小肠吸收。
肠道排气在消化道手术中被认为是反映消化道功能恢复的重要体征。本研究结果显示,<24 h组术后肛门排气时间、首次下床活动时间明显低于其他两组,说明术后24 h内给予肠内营养可以促进患者胃肠道蠕动功能,缩短肛门通气时间。这与任明[17]的研究结果一致。分析原因可能是术后24 h内给予肠内营养在改善患者营养状况的同时,可刺激胃肠道黏膜吸收营养物质,从而较快的恢复蠕动,促进患者术后排气[18]。
本研究中,<24 h肠内营养支持组患者术后并发症及肠内营养不耐受的发生率与其它两组相比未见明显统计学差异(P>0.05)。笔者认为可能与肠内营养液的个体化配制与输注有密切关系,本研究中患者实施的肠内营养均是根据患者的耐受情况进行调整并选择合适的输注浓度与速度,但由于本次研究样本量过小,对于肠内营养输注个体化方案标准的制定则有待于大样本的数据支撑。本研究与Perinel等[20]发现早期肠内营养增加了患者术后胰瘘的发生率不一致,可能与其营养供给方式过于单一以及营养供给不足有关。
综上所述,在患者行PD术后24 h内即给予肠内营养有助于改善患者术后营养状况、促进患者术后胃肠道功能恢复、缩短平均住院时间、降低围术期并发症发生率、提高患者术后生活质量。但由于本研究为单中心、回顾性研究,对于某些数据的测量与收集可能存在一定的偏倚,下一步笔者计划开展多中心、大样本的前瞻性随机对照试验,以期进一步验证研究结果,同时为临床提供参考。

