ATRA 对糖尿病肾病大鼠模型TGF-β1 基因甲基化水平的影响
薛秉玮, 林梅芳, 林丹华, 徐海山
( 莆田学院附属医院 肾内科, 福建 莆田 351100 )
0 引言
糖尿病肾病( diabetic nephropathy,DN) 是糖尿病引起的肾脏微血管并发症, 机体以慢性高血糖伴蛋白尿、 肾功能逐渐下降、 肾小球及肾间质纤维 化 为 主 要 表 现。 转 化 生 长 因 子-β1(transforming growth factor-β1,TGF-β1) 属于多功能细胞因子超家族, 在调节细胞生长、 发育和免疫应答中具有关键作用[1]。 高血糖能够刺激机体的氧化应激并诱导TGF-β1 的表达[2]。 而对于DN, TGF-β1 能够促进肾小球系膜细胞的肥大和细胞外基质的累积, 从而降低肾小球滤过率, 导致慢性肾功能衰竭。 随着TGF-β1 表达增加, 肾小球硬化和蛋白尿的严重程度也会增加[3]。 肾纤维化是DN 的主要病理特征, 而TGF-β1 信号通路的激活会导致进行性肾纤维化[4]。
全反式维甲酸(all-trans retinoic acid,ATRA)属于类维生素A 家族, 是维生素A 的活性代谢产物, 它能延缓肾脏疾病发生发展[5], 减少蛋白尿的产生, 缓解肾小球和肾小管的病变[6]。有研究表明, ATRA 能够抑制DN 大鼠肾间质纤维化及肾小球炎症, 预防肾脏损害[7]。
DNA 甲基化是目前广为人知且特征丰富的表观遗传学方式, 它通常发生在CpG 二核苷酸的5'-胞嘧啶上, 并被特定的DNA 甲基转移酶催化。 若DNA 甲基化存在于基因的启动子区域,它将导致基因阻抑。 DNA 甲基化在DN 中的作用已引起学者们更多的关注。 DNA 甲基化谱显示,差异的甲基化基因与DN 的肾纤维化形成有关[8]。 有研究表明, TGF-β1 的异常DNA 甲基化在DN 进程中起了关键的作用[9]。 那么, 本文拟探讨在DN 大鼠中, ATRA 是否会对TGF-β1 基因的甲基化水平产生影响。
1 材料和方法
1.1 材料
1.1.1 实验动物
雄性SD 大鼠30 只, 体质量180 ~200 g, 由江苏集萃药康生物科技有限公司提供, 生产许可证号SCXK (苏) 2018-0008。
1.1.2 主要试剂和仪器
链脲佐菌素(Sigma 公司), 血糖仪(德国拜耳公司), 考马斯亮蓝蛋白检测试剂盒(北京索莱宝科技有限公司), 生化分析仪(日本奥林巴斯AU400), 苏木精伊红( HE) 染色试剂盒、Masson 三色染色试剂盒(北京索莱宝科技有限公司), 基因甲基化特异性PCR 扩增( MSP) 试剂盒、 DNA 重亚硫酸盐处理试剂盒、 焦磷酸测序试剂盒(天根生化科技有限公司), PCR 引物(上海生工生物工程有限公司), 总RNA 提取试剂盒( 北京索莱宝科技有限公司), SYBR Green PCR 试剂盒( 宝日医生物技术( 北京) 有 限公司), 兔抗大鼠TGF-β1 抗体和β-actin 抗体(CST公司)。
1.2 建立DN 大鼠模型
随机选取20 只SD 大鼠给予高糖高脂饮食喂养4 周后单次腹腔内注射链脲佐菌素(STZ)50 mg / kg, 剩余10 只作为对照组大鼠给予正常饮食4 周后单次腹腔内注射等量枸橼酸缓冲液。 72 h 后测定大鼠空腹血糖, 血糖值高于16.7 mmol/L 则提示DN 大鼠模型制备完成。
1.3 鼠的分组及处理
DN 大鼠模型制备完成后, 将DN 大鼠随机分为DN 组和DN+ATRA 组, 每组10 只, 未进行造模的10 只大鼠作为对照组。 STZ 注射72 h后给予DN+ATRA 组大鼠ATRA 1 mg /(kg⋅d-1)灌胃处理, 对照组和DN 组大鼠给予等量生理盐水灌胃, 连续灌胃21 d。 各组随机选取5 只大鼠的一侧肾脏组织进行石蜡包埋, 另一侧肾脏组织进行大鼠mRNA 和蛋白表达水平的检测。 各组剩余5 只大鼠一侧肾脏组织用于甲基化特异性PCR 检测(以下简称MSP 法), 另一侧肾脏组织用于焦磷酸测序。
1.4 大鼠生化指标的测定
待DN 大鼠造模完成后(STZ 注射72 h 后),大鼠禁食禁水8 h, 剪尾, 取大鼠尾静脉第2 滴血, 利用血糖仪测定大鼠空腹血糖值(FBG)。 待大鼠给药完成后, 将大鼠置于代谢笼中, 留取24 h 尿, 2 000 r/ min 离心15 min, 取上清, 考马斯亮蓝法测定大鼠24 h 尿蛋白定量。 腹主动脉取血, 生化分析仪测定大鼠血肌酐(Scr) 和尿素氮(BUN)水平。
1.5 HE 和PAS 染色观察大鼠的肾脏结构变化
待大鼠给药完成后, 乙醚麻醉大鼠、 经腹主动脉取血致大量失血处死大鼠, 迅速取出肾脏组织并去除包膜, 在4℃生理盐水中冲洗并用多聚甲醛固定组织块, 石蜡包埋, 切片。
HE 染色: 60℃、 1 h 烤片, 二甲苯脱蜡, 乙醇梯度复水, 苏木精染色6 min, 自来水冲洗。盐酸乙醇分化30 s, 自来水浸泡10 min, 伊红染色2 min, 自来水冲洗。 乙醇梯度脱水, 二甲苯透明, 中性树胶封片, 光学显微镜观察。
PAS 染色: 石蜡切片脱蜡至水, 蒸馏水洗后分别用过碘酸酒清夜、 自来水冲洗, Schiff 氏液处理10 min, 流水冲洗后苏木精染核3 min, 自来水冲洗后封片观察。
1.6 Masson 染色观察各组大鼠肾脏的纤维化程度
将大鼠肾脏组织石蜡切片置于60℃烘箱中烤片1 h, 脱蜡至水。 苏木精染液和三氯化铁水溶液混合染色5 min, 盐酸乙醇分化, 氨水返蓝,三蒸水洗1 min。 丽春红染色5 min, 乙酸水溶液洗1 min, 磷钼酸水溶液洗2 min, 再用乙酸水溶液洗1 min, 之后苯胺蓝染色2 min, 继续用乙酸水溶液洗1 min。 乙醇梯度脱水, 二甲苯透明,中性树胶封片, 光学显微镜观察。
1.7 MSP 法检测大鼠肾脏中TGF-β1 基因的DNA 甲基化水平
在加州大学圣克鲁斯(UCSC) 基因组学研究所基因组浏览器( https:∥genome.ucsc.edu /) 上搜索找寻TGF-β1 基因在5’ -非翻译区附近的CPG 岛, 测定此特定区域的TGF-β1 基因的甲基化水平。 提取肾脏组织的DNA, 采用超微量分光光度计测定提取DNA 的纯度, 进行DNA 亚硫酸氢钠修饰处理, 进行PCR 扩增。 扩增的甲基化TGF-β1引物序列为上游5’ -TCGCGGAGTAGTTAGATAGC-3’、 下 游 5 ’ -ACTACTGCTCGACGACTCC-3 ’,非 甲 基 化 TGF-β1 引 物 序 列 为 上 游 5 ’ -TTTTTGTCAGTAGTTAGATAGT-3 ’、 下 游 5 ’ -AACT -ACTGTCAACAACTCCTT-3’。 取PCR 产物上样, 进行琼脂糖凝胶电泳, 进行EB 染色,运用凝胶成像系统进行成像。
1.8 Real-time PCR 检测大鼠肾脏组织中TGFβ1 的mRNA 水平
将大鼠肾脏组织研磨, 用RNA 提取试剂盒提取组织的RNA, 之后反转录进行cDNA 的合成, PCR 扩增检测TGF-β1 的mRNA 表达。 TGF-β1上游引物5’ -GGCACCATCCATGACA -TGAACCG-3’, 下游引物5’ -GCCGTACACAGCACTTCTTCTCTG-3’; GAPDH 上 游 引 物 5 ’ -GGTTGTCTCCT GCGACTTCA-3’, 下 游 引 物 5 ’ -TGGTCCAG GGTTTCTTACTCC-3’。 PCR 扩增采用25 μL 反应体系, 95℃预变性30 s, 95℃变性200 s, 60℃退火20 s。 根据所得Ct 值, 按照2-ΔΔCt 计算TGFβ1 基因表达值。
1.9 Western blot 检测大鼠肾脏组织中TGF-β1的蛋白表达
取0.05 g 大鼠肾脏组织, 加入裂解液和蛋白酶抑制剂, 充分研磨, 超声破碎仪破碎。 12 000 r/ min 离心15 min, 取上清, 测蛋白浓度。 配置分离胶和浓缩胶, 上样, 120 V 电泳2 h。 使用转模仪将蛋白转移到PVDF 膜上, 脱脂牛奶封闭。孵一抗、 二抗, 使用发光液在曝光机上曝光。 用Image J 分析各个条带吸光度值, 以β-actin 为内参。
1.1 0 免疫组织化学检测大鼠肾脏组织中TGF-β1蛋白表达水平
取新鲜大鼠肾脏组织进行包埋。 二甲苯脱蜡, 乙醇梯度脱水。 用80%甲醇浸泡10 min, 枸橼酸缓冲液95℃煮20 min 进行抗原修复, 5%BSA 血清封闭, 4℃孵一抗过夜。 滴加辣根过氧化物酶标记的二抗, 滴加SP, DAB 显色, 苏木精染核, 脱水并透明, 中性树胶封片。
1.1 1 统计学分析
使用SPSS 24.0 软件进行统计分析, 用“均数±标准差” (x±s)表示, 组间差异使用单因素方差分析, 两组间比较使用t 检验。 以P<0.05为差异有统计学意义。
2 结果
2.1 ATRA 对DN 大鼠生化指标的影响
DN+ATRA 组大鼠给予ATRA 干预完成后,测定各组大鼠24 h 尿蛋白定量, 发现DN 组明显高于对照组( P<0.01), DN+ATRA 组明显低于DN 组(P<0.01), 见图1(a); 测定大鼠Scr 水平, 发现DN 组明显高于对照组(P<0.01), DN+ATRA 组明显低于DN 组( P <0.01), 见图1(b); 测定大鼠BUN 水平, 发现DN 组明显高于对照组(P<0.01), DN+ATRA 组明显低于DN 组(P<0.01), 见图1(c)。 以上结果提示ATRA 对DN 大鼠的肾功能有明显的保护作用。
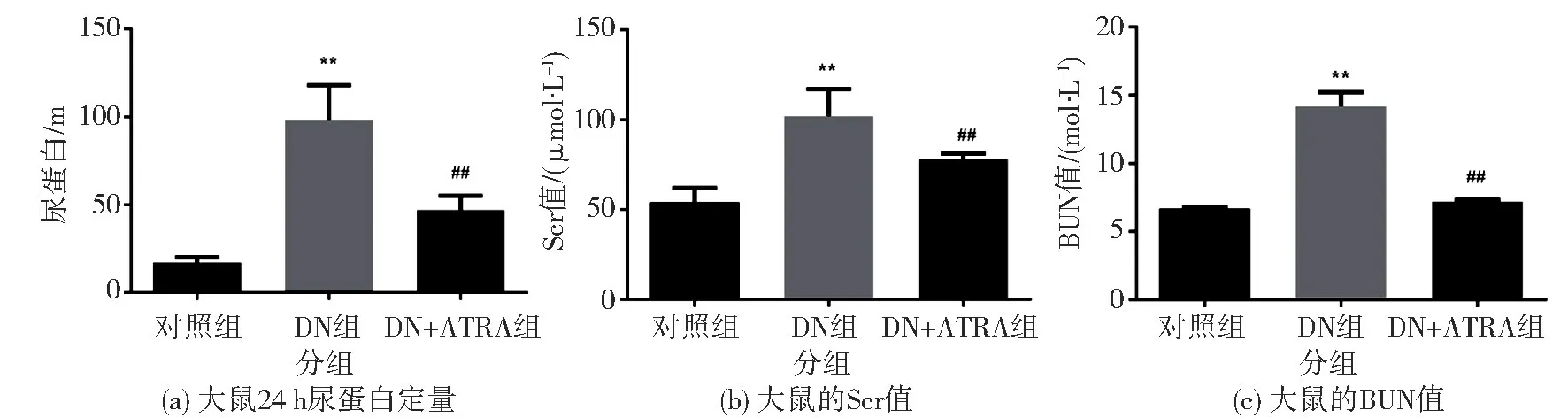
图1 ATRA 对DN 大鼠生化指标的影响
2.2 ATRA 对DN 大鼠肾脏结构和肾脏纤维化的影响
肾脏组织HE 和PAS 染色发现, 与对照组相比, DN 组大鼠肾小球形状不规则, 系膜基质增多,基底膜增厚且有部分肾小球硬化; DN+ATRA 组大鼠肾小球形状较规则, 系膜基质增多和基底膜增厚情况较DN 组轻, 肾小球硬化也较少见, 见图2。Masson 染色结果显示, 对照组肾脏组织呈红染的规则正常图像; DN 组肾脏组织呈大片蓝染的胶原纤维沉积区, 有大量胶原纤维沉积于肾小球毛细血管管腔和肾间质中, 正常的红染区较少; DN+ATRA组与DN 组相比, 肾脏组织中蓝染区较少, 胶原纤维沉积减轻, 红染区较多, 见图2。 以上结果提示,ATRA 能减轻DN 大鼠肾脏的纤维化程度。
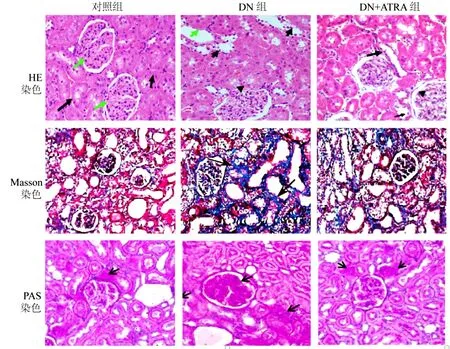
图2 ATRA 对DN 大鼠肾脏结构和肾脏纤维化的影响(×200 倍,n = 5)
2.3 ATRA 对DN 大鼠肾脏中TGF-β1 基因的甲基化水平的影响
MSP 法检测大鼠肾脏组织中TGF-β1 基因的甲基化水平发现, DN 组明显低于对照组( P <0.01), DN+ATRA 组明显高于DN 组(P<0.01),见图3。 这提示ATRA 能够提高DN 大鼠TGF-β1基因的DNA 甲基化水平。
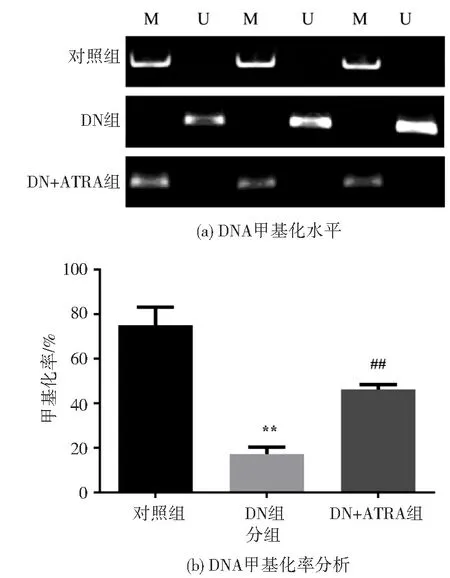
图3 ATRA 对DN 大鼠肾脏中TGF-β1基因的DNA 甲基化水平的影响
2.4 ATRA 对DN 大鼠肾脏组织中TGF-β1 的mRNA 水平的影响
Real-time PCR 分析大鼠肾脏组织中TGF-β1的mRNA 水平显示, DN 组明显高于对照组(P<0.01), DN+ATRA 组明显低于DN 组(P<0.01),见图4。 这提示ATRA 能降低DN 大鼠肾脏组织中TGF-β1 的mRNA 水平。
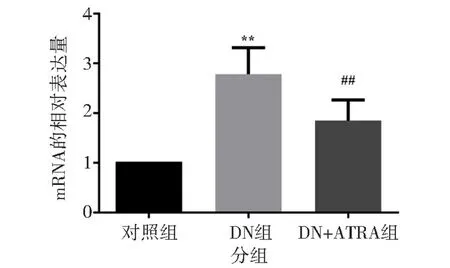
图4 ATRA 对DN 大鼠肾脏组织中TGF-β1 的mRNA 水平的影响
2.5 ATRA 对DN 大鼠肾脏组织中TGF-β1 蛋白表达的影响
Western blot 检测、 分析大鼠肾脏组织中TGF-β1 的蛋白表达, 结果显示, DN 组明显高于对照组(P<0.01), DN+ATRA 组明显低于DN 组(P<0.01), 见图5(a)、图5(b)。 大鼠肾脏组织免疫组化检测结果(图5(c))显示, 对照组大鼠肾脏组织中只有少量TGF-β1 蛋白的阳性表达,与对照组相比, DN 组大鼠肾小球和肾小管中TGF-β1 蛋白的阳性表达明显增多; DN +ATRA组大鼠肾小球和肾小管中TGF-β1 蛋白的阳性表达较DN 组低(图5(d))。 以上结果提示, ATRA能降低DN 大鼠肾脏组织中TGF-β1 的蛋白表达水平。
3 讨论
DN 是糖尿病患者死亡的主要原因之一, 目前也是导致慢性肾病患者最终进展到终末期肾脏病的主要原因之一。 与冠心病患者相比, DN 患者并发心血管病的风险更高。 因此, DN 的预防和治疗对提高糖尿病患者生存质量、 降低患者死亡率至关重要。 近年来, 作为维生素A 的活性代谢产物, ATRA 降低蛋白尿、 抑制TGF-β1 合成和延缓肾病的作用广受关注。 本文在4 周的ATRA 干预后, 检测了大鼠的24 h 尿蛋白定量、Scr 和BUN 水平, 结果提示ATRA 对DN 大鼠的肾功能有明显保护作用。 HE 染色和PAS 染色观察大鼠的肾脏结构变化, 发现ATRA 干预能改善肾脏的病理结构; Masson 染色结果表明ATRA能减轻DN 大鼠的纤维化程度。 说明ATRA 对DN 大鼠肾脏组织结构具有保护作用。
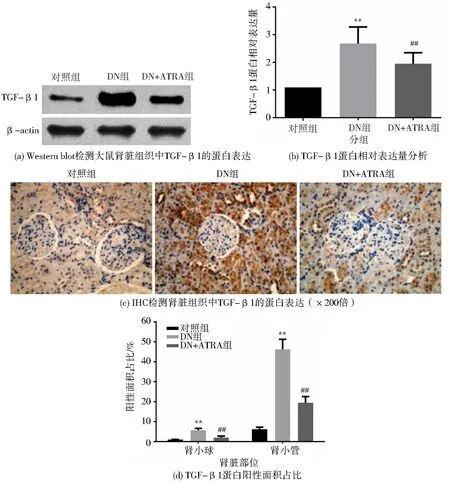
图5 ATRA 对DN 大鼠肾脏组织中TGF-β1 蛋白表达的影响
肾纤维化是DN 的主要病理特征, 且高血糖能诱导TGF-β1 的表达。 有证据表明, TGF-β1可能是DN 的关键介质[10], 中断该系统有望延缓DN 发展。 TGF-β1 的甲基化异常在DN 进程中起了诱导系膜纤维化的关键作用。 在小鼠肾纤维化模型中观察到了甲基化的变化[11], DN 患者TGF-β1 基因表达调控区甲基化水平降低[12]。 因此, 本文用甲基化特异性PCR 法检测大鼠肾脏中TGF-β1 基因的甲基化水平, 结果发现ATRA能够提升DN 大鼠TGF-β1 基因的甲基化水平。TGF-β1 的去甲基化和TGF-β1 mRNA 的上调同时进行[7]。 为了探究ATRA 是否通过降低TGFβ1 基因的去甲基化程度来进一步影响TGF-β1的mRNA 和蛋白表达水平, 本文通过Real-time PCR 检测发现, ATRA 能降低DN 大鼠肾脏组织中TGF-β1 的mRNA 水平。 之后通过检测TGFβ1 在大鼠肾脏组织中的蛋白表达水平, 发现ATRA 能降低DN 大鼠肾脏组织中TGF-β1 的蛋白表达水平。 综上所述, 本文观察到ATRA 能够影响DN 大鼠肾脏组织的纤维化程度, 且能够通过提高DN 大鼠的TGF-β1 基因的甲基化水平来降低TGF-β1 的mRNA 和蛋白表达水平。 有文献指出, ATRA 能通过下调TGF-β1 及其下游的Smad3 的mRNA 和蛋白表达来延缓DN 的纤维化进程[13]。 由此推测ATRA 可能通过影响TGF-β1基因的甲基化水平来减轻DN 大鼠的肾纤维化程度, 延缓DN 的进展速度。
本研究仅观察到ATRA 能影响DN 大鼠的TGF-β1 基因的甲基化、 TGF-β1 的mRNA 和蛋白表达水平, 进而影响DN 大鼠肾脏组织的纤维化程度, 从而推测ATRA 可能通过影响TGF-β1基因甲基化来影响DN, 而对于ATRA 影响TGFβ1 基因甲基化水平的相关机制尚未深入探讨,有待进一步研究。

