超声空化效应增强西妥昔单抗对三阴性乳腺癌的抑制作用
杨嘉嘉 郭晶晶 张 宇 林礼务
三阴性乳腺癌(triple-negative breast cancer, TNBC)是一种特殊的乳腺癌亚型,其好发年龄较年轻、组织学分级高、易发生内脏转移、进展快、预后差。TNBC因为雌激素受体、孕激素受体和人表皮生长因子受体2(human epidermal growth factor receptor-2, HER-2)表达缺失不适宜内分泌治疗及以HER-2为靶点的治疗,化疗是其主要的内科治疗方法[1~3]。TNBC患者接受新辅助化疗后病理完全缓解率较高,但易发生复发转移,临床上仍亟需新的治疗方案[4,5]。由于TNBC中表皮生长因子受体(epidermal growth factor receptor,EGFR)过度表达,表达率高达60%~70%,其信号转导通路与TNBC的发生、发展密切相关,被认为是潜在的TNBC靶向治疗的靶点之一[6,7]。西妥昔单抗是一种重组人和嵌合体鼠的EGFR单克隆抗体,能通过特异性结合于细胞外区域的EGFR而发挥作用。然而现有研究表明西妥昔单抗在TNBC的临床应用中疗效有限,本研究拟联合超声靶向微泡破坏技术与西妥昔单抗进行抗TNBC裸鼠移植瘤的实验研究,探讨微泡破坏引起的空化效应对西妥昔单抗抑制TNBC生长作用的影响[8,9]。
材料与方法
1.材料:(1)实验动物与瘤株:40只5~6周龄SPF级BALB/c nu-nu雌性裸鼠购自上海斯莱克实验动物中心,合格证号:2015000551166,体质量16~20g,饲养在福建医科大学实验动物中心SPF级实验动物室内,实验动物许可证号:SYXK(闽)2016-0006。人乳腺癌细胞株MDA-MB-231由中国科学院上海细胞库提供。动物实验过程严格按照福建医科大学动物实验指导原则进行。(2)主要试剂与仪器:西妥昔单抗购自德国Merck公司,Sono Vue购自瑞士Bracco Imaging B.V.公司,胰酶细胞消化液购自上海碧云天生物技术有限公司,胎牛血清购自美国Gibco公司,盐酸利多卡因购自上海朝晖药业有限公司,TUNEL细胞凋亡原位检测试剂盒购自南京凯基生物发展有限公司;超声波治疗仪购自深圳圣祥高科技有限公司; Aplio 500超声诊断仪购自日本Toshiba公司,配有PLT-805AT探头,频率9MHz。
2.动物模型的建立:MDA-MB-231细胞于含10%胎牛血清的培养基、37℃及5%CO2饱和湿度环境的培养箱中培养,取对数生长期的细胞,经胰酶消化后离心,以0.9%氯化钠注射液调整细胞密度为1×107/ml,于每只裸鼠右侧腋窝皮下接种0.1毫升/只。
3.实验动物模型分组及超声介入治疗:行二维超声检查观察移植瘤生长情况,当移植瘤平均直径达1cm时,将荷瘤裸鼠随机分为4组,每组10只:超声辐照微泡+西妥昔单抗组(A组)予西妥昔单抗混悬液(西妥昔单抗∶0.9%氯化钠注射液为100mg∶50ml)以50ml/kg体质量经裸鼠尾静脉缓慢注射,随后超声微泡造影剂Sono Vue以5ml/kg体质量团注尾静脉,超声波治疗仪设置频率为850kHz、声强0.75W/cm2的超声波能量辐照肿瘤部位,辐照时间3min;西妥昔单抗组(B组)仅予西妥昔单抗混悬液50ml/kg体质量尾静脉缓慢注射;超声辐照微泡组(C组)予0.9%氯化钠注射液50ml/kg体质量尾静脉注射,随后以A组相同方式注射Sono Vue及进行超声辐照;对照组(D组)予尾静脉注射0.9%氯化钠注射液50ml/kg。每组每天给予上述治疗措施1次,连续治疗7天。
4.肿瘤体积测量:分别于首次治疗前及末次治疗后第1天,以Aplio 500超声诊断仪(PLT-805AT探头,频率9MHz)进行二维超声检查,测量肿瘤的最大上下径(L)、左右径(W)、前后径(H),依据公式 V=πLWH/6计算肿瘤体积,取各组肿瘤体积均值进行比较。
5.超声造影检查:分别于首次治疗前及末次治疗后第1天行超声造影检查,检查前以2%盐酸利多卡因5μl/g体质量腹腔麻醉裸鼠,Aplio 500超声诊断仪(PLT-805AT探头,频率9MHz)启动造影模式,机械指数为0.08,经裸鼠尾静脉团注Sono Vue 5ml/kg体质量,随后推注0.2ml 0.9%氯化钠注射液冲管,同时选择TIME及RAW STORE 选项,对造影图像进行录像,整个超声造影过程最大限度固定手的位置,保证图像稳定。造影录像经超声诊断仪自带的Toshiba TCA软件绘制时间-强度曲线(time-intensity curve,TIC),分析各组肿瘤的造影峰值强度(peak intensity,PI)和曲线下面积(area under the curve,AUC)。
6.病理组织学检查:超声造影检查结束后,处死裸鼠,取肿瘤组织,10%甲醛溶液固定,常规脱水,石蜡包埋,连续切片,HE染色,光学显微镜下观察肿瘤组织的病理变化;应用TUNEL细胞凋亡原位检测试剂盒以BIOTIN 标记POD法染色组织切片,光学显微镜下观察,细胞核染成棕色的为阳性细胞。每个切片随机选择5个高倍视野(×400),每个视野分别计数200个细胞,共计1000个细胞,计算阳性细胞数占细胞总数的百分比即为凋亡指数(apoptotic index, AI)。

结 果
1.肿瘤体积:治疗前(接种肿瘤后第15天)超声测量裸鼠移植瘤最大直径均值为1.03±0.16cm,肿瘤呈类圆形或椭圆形;治疗前各组移植瘤体积比较,差异无统计学意义(P>0.05)。末次治疗后第1天测量,各组肿瘤体积均较治疗前有所增长,但A、B、C组肿瘤体积均低于D组(P<0.05),其中A组肿瘤体积最小(P<0.05,表1)。
2.超声造影定量指标:移植瘤富血供区域在超声造影时呈增强表现,乏血供区域呈“充盈缺损”改变(图1A),TIC曲线呈单峰波形(图1B)。治疗前各组造影曲线PI值及AUC值比较,差异无统计学意义(P>0.05),治疗后A组PI值低于其余各组(P<0.05),而B、C、D组PI值组间比较,差异无统计学意义(P>0.05);治疗后AUC值A组低于B、C、D组(P<0.05),C组低于D组(P<0.05),其余各组AUC值组间比较,差异无统计学意义(P>0.05,表1)。

组别体积(cm3)PI(×10-5AU)AUC(×10-5AU·s)治疗前治疗后治疗前治疗后治疗前治疗后AI(%)A组0.52±0.080.64±0.0851.30±8.6734.20±8.662705.53±418.111140.08±314.7044.04±8.36B组0.53±0.070.80±0.10∗52.79±7.5849.41±8.45∗2818.70±364.852299.10±356.45∗38.27±6.69∗C组0.51±0.090.89±0.09∗#52.83±6.2345.93±9.36∗2775.31±415.272023.37±354.98∗32.46±5.89∗#D组0.52±0.050.99±0.09∗#△52.17±6.1451.28±7.27∗2798.92±357.252682.63±444.99∗△1.60±0.73∗#△
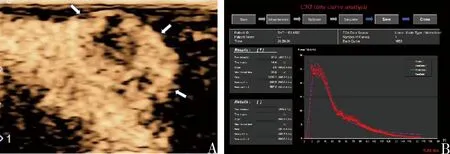
图1 超声造影检查A.裸鼠皮下TNBC移植瘤(箭头所示)经超声辐照微泡联合西妥昔单抗治疗后,超声造影显示肿瘤内局部呈“充盈缺损”改变;B.为A图所示移植瘤的超声造影TIC曲线,PI值为27.3(10-5AU),AUC值为1236.1(10-5AU·s)
3.肿瘤组织HE染色光镜检查:A组裸鼠肿瘤组织大片状坏死,坏死组织结构不清,细胞轮廓消失(图2A);B组及C组肿瘤内见相间分布的坏死组织(图2B、C);而D组肿瘤细胞生长良好,胞质嗜酸性,核大深染(图2D)。
4.各组裸鼠移植瘤治疗后TUNEL检测:A组肿瘤组织内见大量棕色染色的凋亡细胞,呈弥漫片状分布(图3A);B组肿瘤组织内凋亡细胞呈斑片状相间分布(图3B);C组凋亡细胞呈弥漫散在分布(图3C);D组肿瘤细胞生长良好,凋亡细胞鲜见(图3D)。AI值比较显示,A、B、C组AI值均高于D组(P<0.05),其中A组AI值最高(P<0.05),B组次之(P<0.05)。

图2 各组裸鼠移植瘤治疗后的肿瘤组织HE染色(×200)A.超声辐照微泡+西妥昔单抗组(A组);B.西妥昔单抗组(B组);C.超声辐照微泡组(C组);D.对照组(D组)

图3 各组裸鼠移植瘤治疗后的肿瘤组织TUNEL检测(×400)A.超声辐照微泡+西妥昔单抗组(A组);B.西妥昔单抗组(B组);C.超声辐照微泡组(C组);D.对照组(D组)
讨 论
乳腺癌的内科治疗包括化疗、内分泌治疗和靶向药物治疗。靶向治疗特异性较强,毒性不良反应相对较小,是近年来TNBC研究的热点。本研究所使用的西妥昔单抗是针对EGFR为靶点的单克隆抗体,可竞争性地结合EGFR的胞外部分,从而引起肿瘤细胞周期阻滞和凋亡,抑制肿瘤生长、血管形成及侵袭转移,因此被认为是具有潜力的TNBC靶向治疗药物。然而现有的临床研究显示,西妥昔单抗在TNBC治疗的临床应用中疗效尚不明确[9,10]。Williams等[11]采用西妥昔单抗单药治疗TNBC,发现治疗前后肿瘤体积未发生明显变化。Garey等[12]研究发现,对TNBC患者分别采用西妥昔单抗单药及联合卡铂治疗,其有效率分别为6%和16%。Baselga等[13]联合应用西妥昔单抗和顺铂治疗转移性TNBC,总有效率从10%提高到20%,无进展生存期从1.5个月提高到3.7个月,总生存期从9.4个月提高到12.9个月。总体而言,西妥昔单抗联合化疗药物治疗TNBC的效果优于单药治疗,但是化疗药物的使用可能引发较为明显的不良反应[12,14]。
超声靶向破坏微泡技术通过注射一定剂量的微泡造影剂,以一定强度的超声辐照肿瘤局部,使微泡发生破裂,产生空化效应,一方面可能引起微血管壁结构崩解,局部血肿及血栓形成,从而在一定程度上阻断肿瘤血液供应,另一方面能使微血管或细胞的通透性升高,促进药物渗透,该技术具有定点、微创、全身不良反应小的优势[15,16]。目前已有研究表明超声破坏微泡引起的空化效应能提高药物的疗效[17~20]。Luo等[19]采用超声辐照阿霉素载药微泡,能取得较好的抑制肿瘤血管生成及促进肿瘤细胞凋亡的效果。余堰澜等[20]采用超声辐照微泡产生的空化效应联合恩度治疗乳腺癌可显著减少肿瘤血液灌注、抑制肿瘤生长。
本研究采用超声辐照微泡联合西妥昔单抗、及单用西妥昔单抗或超声辐照微泡对裸鼠TNBC移植瘤进行治疗后,肿瘤体积均低于对照组(P<0.05),说明3种治疗方法均具有抑制TNBC生长的作用,其中联合治疗组的肿瘤体积低于其余各组(P<0.05),肿瘤生长受抑制程度最明显。这可能由于超声辐照微泡产生空化效应,导致微血管壁通透性增加,甚至引起微血管的损毁,从而促进西妥昔单抗自血液循环大量渗透入肿瘤间质,提高肿瘤局部的药物浓度,增强药物抗肿瘤作用;同时超声空化效应介导的血流阻断可能发挥一定的抗肿瘤协同效应,使联合治疗的疗效优于单一疗法。超声造影定量指标PI及AUC值反映了肿瘤微循环灌注水平,本研究中C组AUC值低于D组(P<0.05),说明超声辐照微泡可引起肿瘤血液灌注减少,这与以往研究结果相同[20]。B组AUC值与D组比较,差异无统计学意义(P>0.05),这提示单用西妥昔单抗对TNBC肿瘤的血液灌注影响不大,而A组的PI及AUC值均低于其余各组(P<0.05),说明超声辐照微泡联合西妥昔单抗的方法较其他疗法能更显著地减少肿瘤血液灌注。肿瘤组织由于缺血、缺氧而发生坏死,这可能是A组移植瘤中坏死组织范围较大的原因之一。治疗后的TUNEL检测于A、B、C组中均观察到明显的细胞凋亡现象,说明3种治疗方法均能诱导TNBC细胞凋亡,其中A组AI值最高(P<0.05),提示超声空化效应对西妥昔单抗诱导TNBC细胞凋亡具有协同作用。
综上所述,本研究结果显示,超声空化效应能够增强西妥昔单抗对TNBC的抑制作用,超声辐照微泡联合西妥昔单抗治疗裸鼠TNBC移植瘤较单一疗法能显著减少肿瘤血液灌注,促进细胞凋亡及组织坏死,从而抑制肿瘤生长。本研究所讨论的治疗方法较为便捷、易于实现,具有一定的临床应用潜力,值得深入探讨。

