17β-雌二醇对人脐静脉内皮细胞增殖、迁移、侵袭及血管生成的影响
孙明明 刘婷婷 樊倩倩 祝立权 梁 敏 张博男 刁 天 暴 国 陈西华 徐祥波 贺 斌*
1.国家卫生健康委科学技术研究所(北京 ,100081);2.北京协和医学院研究生院
一次成功的妊娠需要足够的胎盘血管化以保证在整个妊娠期维持胎盘血管的数量,良好的胎盘血管网和血流灌注可满足胎儿发育生长的需要[1]。胎盘血管网发育异常直接影响胎盘血液循环,导致子宫胎盘血流量不足,可引起流产、先兆子痫、胎儿宫内发育受限等许多妊娠疾病[2]。妊娠时血清雌激素水平随孕周升高,雌激素在妊娠早期由卵巢黄体产生,妊娠9周后主要由胎儿-胎盘单位合成,至妊娠末期,正常妊娠处于高雌激素状态,雌三醇值为非孕期的1000倍,雌二醇(E2)及雌酮为非孕期的100倍[3]。另一方面,有研究显示孕早期绒毛或胎盘组织中的E2浓度明显高于外周血清,至足月分娩时则相反[4]。雌激素是维持妊娠的重要甾体激素,目前普遍认为雌激素具有促进血管内皮细胞增殖作用,特别是血管的形成[5]。但雌激素是否在妊娠期胎盘血管生长的调节中起重要作用尚未得到充分研究,且妊娠期间E2水平的大幅变化对胎盘血管化的影响也需要更加深入细致的研究。
1 材料与方法
1.1 实验材料和主要试剂
人脐静脉内皮细胞株(HUVEC,北京协和细胞资源中心);17β-雌二醇(E2)、CCK-8试剂盒(美国Sigma公司);Matrigel基质胶(美国BD公司);ECM培养基(美国Sciencell公司);胰蛋白酶(美国Gibco公司);Transweel小室(美国Corning公司);培养箱(Memmert,德国),酶标仪(K3 plus,上海宝玉德),显微镜(LDM6000,德国)。
1.2 实验方法
1.2.1细胞培养人脐静脉内皮细胞常规培养于ECM完全培养基中,培养条件为37℃、5% CO2。细胞单层贴壁生长,待生长到80%~90%细胞发生融合时,0.25% 胰蛋白酶消化,传代培养,收集对数生长期细胞用于后续实验。
1.2.2细胞分组将HUVECs随机分为空白对照组和不同E2浓度(1×10-10、10-9、10-8、10-7、10-6mol/L)干预组,每组设5个复孔。其中10-9~10-8mol/L浓度接近孕期外周血清雌激素生理浓度[6-7]。
1.2.3CCK-8法检测细胞增殖取生长状态良好的细胞,用0.25%的胰酶消化液消化细胞,制得细胞悬液,进行细胞计数,调整细胞浓度为1×105个/ml,每组5个复孔。每孔接种100 μl细胞悬液于96孔板中,置于37℃、5%CO2培养箱中培养24 h;弃掉培养液,每孔加入100 μl含有雌激素的完全培养基,放入培养箱中继续培养,分别培养0,1,2 ,3 d;然后将培养液弃去,在每孔内加入含有10 μl CCK-8试剂的培养基100 μl,根据细胞增殖情况在细胞培养箱中孵育1~4 h;用酶标仪在450 nm波长处测定吸光度。
1.2.4细胞划痕实验取生长状态良好的细胞,计数后调整细胞密度为5×105/ml,接种于6孔板中,37℃、5%CO2培养箱中培养12 h。第2天用枪头在培养皿底部划出水平划痕,用PBS洗细胞3次,去除划下的细胞,加入无血清培养基;放入37℃、5%CO2培养箱中培养,分别在0,12,24,48 h拍照记录;结果数据采用Image-J软件进行分析。
1.2.5细胞侵袭试验将ECM培养基用Matrigel胶按5:1的比例稀释,50 μl/孔均匀铺于Transwell小室放室内37℃静置2 h,使Matrigel胶凝固。取含有不同浓度E2的细胞悬液(1×105个/ml),取100 μl细胞悬液加入到小室中,在24孔板中加入600 μl的完全培养基,将小室置于24孔板中,在37℃、5%CO2培养箱中分别培养12,24,48 h后取出小室;加入4%多聚甲醛室温下固定15 min,5%结晶紫染色15 min,擦去小室中的Matrigel胶及细胞,用倒置显微镜对进行观察,拍照计数。
1.2.6成管试验将预冷的Matrriel基质胶铺于96孔板中,每孔50 μl,放入37℃、5%CO2培养箱中,静置60 min,使其凝固;加入含有不同浓度E2的细胞悬液(2×104个/孔),继续培养4~6 h,观察各组细胞成管数量,并随机选择6个视野拍照,并用Image J软件进行分析处理。
1.3 统计学分析
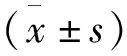
2 结果
2.1 E2对HUVECs增殖的影响
与空白对照组相比,10-8mol/L组细胞活力明显提高(P<0.05),而10-6mol/L组细胞活力明显降低(P<0.01)。见表1。
2.2 E2对HUVECs迁移的影响
与空白对照组相比,10-10mol/L组细胞迁移率升高(P<0.05),随着E2浓度升高,10-9、10-8mol/L组细胞迁移率明显升高(P<0.01),而10-6mol/L组细胞迁移率明显受到抑制(P<0.01),见表1,图1(见插页)。
2.3 E2对HUVECs侵袭的影响
与空白对照组相比,10-10mol/L组细胞侵袭能力升高(P<0.05),随着E2浓度升高,10-9、10-8mol/L组细胞侵袭能力明显升高(P<0.01),而10-6mol/L组细胞侵袭能力明显降低(P<0.01)。见表1,图2(见插页)。
2.4 E2对HUVECs成管能力的影响
不同浓度的E2对HUVECs管腔形成能力显示出不同的作用,当E2浓度为10-9、10-8mol/L时,具有明显促进作用;E2达到10-6mol/L时,表现出明显抑制作用(P<0.01)。见表1,图3(见插页)。
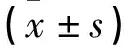
表1 不同浓度E2对HUVEC影响
3 讨论
胎盘位于母胎界面,调节子宫内环境以促进最佳胎儿发育。胎盘血窦密集的血管网络保障了整个孕期母婴之间交换呼吸气体、营养物质和代谢产物,这对胎儿的正常成长至关重要[8]。胎盘血管网系统的异常发育导致胎盘功能不全,这可能导致母体和胎儿循环之间的营养物质和废物交换减少。这种变化可能在不利的子宫环境中表现出来,导致母亲和胎儿的各种妊娠并发症,包括妊娠期高血压、胎儿宫内生长受限、先兆子痫、死产、早产或流产等[9]。因此,胎盘内血管网的正确建立对于胎儿的生长和存活至关重要,并可作为缓解与胎盘血管系统改变有关的临床状况的治疗目标。
胎盘血管网络形成主要包括血管发生和血管生成两个过程,在多种促血管生成因子、抑血管生成因子、缺氧等刺激下,内皮细胞开始增殖、迁移,同时分泌多种酶水解重构基质,最终形成丰富的管腔结构[9],从而促进胎盘的快速生长,并确保胎儿有效的营养供给。大量研究提示雌激素和血管生成因子之间交互作用,并且主要负责调节血管生成过程[10]。
女性的非妊娠期外周血E2浓度约在0.1~2.2 nmol/L范围内[11],妊娠时血清E2水平随孕周增大逐渐升高,E2平均浓度约从孕早期10-9mol/L增加到孕晚期的10-8mol/L[7,12]。本研究选择了1×10-10~1×10-6浓度梯度的E2,研究结果显示,随着E2浓度的升高,E2对脐静脉内皮细胞的增殖、迁移、侵袭以及成管能力的促进作用也随之加强,并在1×10-8浓度时达到高峰,特别是对HUVECs的迁移和侵袭能力可以增加2倍左右,随着E2浓度的继续提高,高浓度的E2则出现相应的抑制作用。结果提示E2对HUVECs的增殖、迁移、侵袭以及成管能力的影响具有剂量效应关系,随着E2浓度增加可以促进HUVECs的增殖、迁移、侵袭和成管,但是过高的浓度可以抑制内皮细胞的增殖、迁移、侵袭和成管。研究显示,先兆子痫患者孕早期雌激素明显降低[13-14],并提出先兆子痫的雌激素缺乏假说[11],但E2参与血管发生在先兆子痫发病机制中的具体作用仍有待于进一步深入研究。胎盘中异常的血管生成可以导致母体螺旋动脉的重塑受损和胎盘灌注不足,已成为胎盘功能不全及其临床后果的主要病理生理特征之一,例如胎儿生长受限和母体先兆子痫等,认为与妊娠期低水平雌激素有关[15],并开始探索E2水平作为早孕流产[16]、先兆子痫[10]等妊娠疾病发生发展的生物标志物的可行性。
值得注意的是,妊娠时胎盘也合成雌激素,并且大约在妊娠9周时成为雌激素的主要来源,有研究显示孕早期胎盘局部微环境具有更高的雌激素浓度[4],而且,E2代谢物2-甲氧雌二醇(2-ME2)是一种有效的抗血管生成因子,无增殖活性[17];2-ME2抑制VEGF合成和血管小管形成,并诱导微管蛋白聚合破坏[18]。这也反应了在胎盘发育的特殊微环境中,E2对胎盘血管网形成的复杂精细调控,相关机制有待于进一步深入研究。

