雌激素受体基因多态性与鲁南地区汉族妇女卵巢反应性的相关性研究*
邱 欣 王 伟 吴秋红 薛子成 李 雨 刘卫东
山东省枣庄市妇幼保健院药学部 277000
目前通过相关生殖助孕技术出生的新生儿占2%~3%[1-2]。在辅助生殖技术中,目前使用最多的是体外受精—胚胎移植(In vitro fertilization and embryo transfer,IVF-ET)技术。该技术治疗过程的第一步即为控制性超促排卵(Controlled ovarian hyperstimulation,COH)。卵巢对外源性促性腺激素的反应能力是IVF-ET成功的关键影响要素之一[3]。但不孕症患者对外源性促性腺激素的反应存在个体差异性,同时引起卵巢反应性差异的真正机制尚未阐明,目前认为主要与患者年龄、卵巢储备、卵巢局部的旁/自分泌活动及遗传等因素相关。
雌激素(Estrogen,E)是一种通过与雌激素受体(Estrogen receptor,ER)结合而发挥作用的类固醇类激素[4]。目前研究发现ER有两种亚型,即ERα和ERβ,分别由ER1和ER2基因编码。由于其存在遗传多态性,可能影响ERα和 ERβ的表达和相关功能,其次不同个体间COH的临床结局也有很大差异,这将导致卵巢反应过低或严重的卵巢过度刺激征的发生[5-6]。因此,本文初步探讨了雌激素受体基因多态性与鲁南地区汉族妇女卵巢反应性的相关性,以期为不孕症患者的临床个体化给药提供参考。
1 资料和方法
1.1 临床资料 入选研究对象为2018年1月—2019年12月在枣庄市妇幼保健院生殖医学中心行IVF-ET技术或卵母细胞显微单精子注射(Intracytoplasmic sperm injection,ICSI) 的100例不孕患者。本研究经山东省枣庄市妇幼保健院伦理委员会批准,受试者均签署知情同意书。纳入标准:(1) 年龄20~40岁;(2) BMI:18~30; (3) 月经周期正常;(4) 基础卵泡刺激素(Follicle-stimulating hormone,FSH)值在5~12IU/L之间;(5) 因女方输卵管因素或男方因素行IVF治疗;(6) 第一次接受COH治疗; (7) 染色体核型正常。排除标准:(1)卵巢或相邻脏器手术史者;(2)其他妇科、内分泌及代谢异常疾病者;(3)异常基础窦卵泡数;(4)其他临床医师或研究人员认为不适合纳入的对象。
1.2 控制性超促排卵方案与取卵 所有患者均使用促性腺激素释放激素拮抗剂(Gonadotropin releasing hormone antagonist,GnRH-A)。于月经第3天根据基础患者FSH、基础窦卵泡数(Antral follicle count,AFC)与BMI等指标采用重组卵泡刺激素75~200IU启动促排卵。当主卵泡群卵泡直径>12mm时,给予GnRH拮抗剂。当主导卵泡群中至少2个优势卵泡直径>18mm,并参考患者雌激素水平,在合适时单次注射人绒毛促性腺激素500~10 000单位诱导排卵,并于36h后行经阴超声引导下取卵术。
1.3 仪器与试剂 荧光检测仪(TL 998A,西安天隆科技有限公司);涡旋混合仪(XW-3,上海沪西分析仪器厂有限公司);低温离心机(Centrifuge 5430R,德国eppendorf);荧光染色原位杂交及染色体核型分析系统(北京华夏时代基因科技发展有限公司)。
GnRH拮抗剂(GnRH-A,ORGALUTRAN:N.V.Organon);人绒毛促性腺激素(中国丽珠制药);氯化铵溶液、核酸纯化试剂(北京华夏时代基因科技发展有限公司,货号:20190211),测序反应试剂盒(北京华夏时代基因科技发展有限公司,货号:20190815)。
1.4 方法
1.4.1 样本收集和分组:所有入组患者取外周静脉血2~3ml置于EDTA抗凝管中。根据COH 的情况将患者分为三组:(1)卵巢高反应组(高反应组):获卵数≥15个。(2)卵巢低反应组(低反应组):当COH 过程中出现以下情况之一即纳入本组:获卵数≤5个,HCG 注射日E2<500ng/L,平均每日Gn剂量≥300IU,总Gn用量≥44支(75IU/支),Gn刺激时间≥15d。(3)正常反应组(正常组):获卵数6~14个,此组作为对照组。
1.4.2 样本前处理:精密量取灭菌注射用水900μl至1.5ml离心管中,加入100μl预处理液和200μl全血样本,涡旋混合后置10min离心(转速3 500r/min,5min),弃上清液。在富集的白细胞沉淀中加入核酸纯化试剂 50μl,反复吹打混匀后室温静置 20~40min,得到白细胞混悬液。精密吸取白细胞混悬液2.0μl加入至测序反应试剂中充分混匀,采用荧光原位杂交技术进行检测,采用染色体核型分析系统直接读取基因分型结果。
1.4.3 基因型测定:按“1.4.2”项下方法提取100例不孕症患者的白细胞混悬液,吸取2.0μl分别加入至ER基因位点测序反应试剂中,充分混匀,采用荧光原位杂交技术进行检测,并使用染色体核型分析系统直接读取基因分型结果。
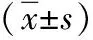
2 结果
2.1 一般资料和Hardy-Weinberg平衡 本试验共纳入100例不孕患者,其一般资料(年龄、体质量、BMI和FSH值)见表1。
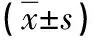
表1 三组患者的基本资料比较
2.2 ERα基因型和等位基因频率比较 高反应组和低反应组患者ERα基因位点PvuⅡ (rs2234693)基因型频率与等位基因频率与正常组之间的差异无统计学意义(P>0.05),结果见表2。高反应组患者ERα基因位点Xba Ⅰ(rs9340799)等位基因频率与正常组之间的差异无统计学意义(P>0.05)。然而,低反应组患者ERα基因位点XbaⅠ(rs9340799)等位基因频率与正常组之间的差异具有统计学意义(P<0.05),结果见表2。

表2 ERα基因型及等位基因分布频率[n(%)]
2.3 ERβ基因型和等位基因频率比较 高反应组和低反应组患者ERβ基因位点RsaⅠ(rs1256049)基因型频率和等位基因频率与正常组之间的差异无统计学意义(P>0.05)。结果见表3。高反应组和低反应组患者ERβ基因位点AluⅠ(rs4986938)基因型频率和等位基因频率与正常组之间的差异无统计学意义(P>0.05)。结果见表3。

表3 ERβ基因型及等位基因分布频率[n(%)]
3 讨论
随着人民生活水平的日益提高,不孕症的发生率也随之逐渐增高,因此越来越多的患者接受辅助生殖助孕技术进行治疗[7]。随着接受COH治疗患者的增加,卵巢过度刺激综合征(Ovarian hyperstimulation syndrome,OHSS)的发生率逐年增加。
相关国内外文献发现ER基因在卵巢反应中起着重要作用[8-11],ER基因突变与COH结局密切相关[4,12]。许多妇科及内分泌疾病如不孕症、复发性流产、子宫肌瘤、子宫内膜癌以及子宫内膜异位症的发生都可能与ER基因多态性相关[13]。ER有ERα和ERβ两个亚型,分别由ER1和ER2基因编码。ER基因具有高度的基因多态性,目前已发现ER1基因有2 800多个SNP位点,ER2基因有720多个SNP位点。其中位于ERl基因内含子l上的PvuⅡ T/C(rs2234693)、XbaⅠ A/G(rs9340799),位于ER2基因的AluⅠ G/A(rs4986938)位点与COH治疗反应性的相关性已被国内外大量研究者进行了探索。Sundarrajan等[12]发现使用IVF治疗的200例新加坡华裔不孕患者与正常人群相比,卵泡数、成熟卵泡数和妊娠率在PvuⅡ CC、TC、TT基因型3组间均存在显著性差异。Georgiou等[4]发现,希腊人群中的ER1基因PvuⅡ T/C位点与COH或IVF患者的妊娠结局显著相关。Altmae等[5]研究也发现,ERl基因PvuⅡ T/C的CC和XbaⅠ A/G的GG基因型对COH治疗有较好的反应,并增加IVF的成功率。
而本研究结果显示:低反应组患者ERα基因位点XbaⅠ(rs9340799)等位基因频率与正常组之间的差异具有统计学意义(P<0.01)。因此,ERα基因位点XbaⅠ(rs9340799)基因多态性与鲁南地区汉族妇女COH中的卵巢低反应相关,G等位基因可增加卵巢低反应的风险。
ER基因在不同地域和种族间的分布存在的差异性也导致了研究结论的不一致[4,12-14]。因此,ER基因多态性与不孕症妇女卵巢反应性的相关性研究仍需要扩大样本量,并在不同地域和种族间进行进一步的研究和探讨。
随着人类从基因水平对许多疾病进行深入的探究,基因组学研究正在不断发展进步,可能在不久的将来会有更多疾病的易感性被证实与其相关基因多态性有关,并进行了多地区、多种族和大样本的系统研究,从而疾病的预防和治疗也将进入新的领域。

