基于CRISPR/Cas9技术电转建立RAW264.7巨噬细胞Mincle敲除株及其对炎症响应的变化研究①
谭睿陟 余 艳 王 丽 何 涛
(西南医科大学附属中医医院,泸州 646000)
越来越多的证据表明,先天性和获得性免疫所涉及的巨噬细胞在多种疾病的病理发展过程中发挥重要作用,如牙周炎、急性肺损伤、非酒精性脂肪肝、急慢性肾病等[1-4]。在疾病发生过程中,巨噬细胞浸润到损伤部位,在某些因子的刺激下分泌出炎症因子,促进了炎症的发生发展,加重了器官损伤[5]。有证据显示,通过系统性地去除单核细胞和巨噬细胞可缓解急性肾损伤,表明巨噬细胞在急性肾损伤中的功能性作用[6,7]。然而在急性肾损伤中完全清除巨噬细胞会导致肾脏修复能力降低,提示完全去除巨噬细胞并不能作为改善疾病炎症的有效方法[8]。由于巨噬细胞具有很强的可塑性,在不同的刺激条件下会发生极化。已有研究证明,TLR4-NF-κB信号是激活M1型巨噬细胞(促炎细胞)并产生iNOS、 TNF-α、 IL-1β、IL-6和MCP-1的重要途径[5,9]。与之相反,M2型巨噬细胞(抗炎细胞)则在疾病中起修复作用,其主要是通过IL-4/IL-13(M2a型)或IL-10、TGF-β1和GM-CSF-1(M2b/c型)诱导而来[9,10]。因此,减少M1巨噬细胞,增加M2巨噬细胞可能是抑制炎症的有效途径。近期有研究表明,巨噬细胞可诱导型C型凝集素(macroph-age-inducible C-type lectin,Mincle)是激活和维持急性肾损伤炎症中M1巨噬细胞表型和功能的关键要素[11]。Mincle为跨膜种系编码的模式识別受体(pattern recognition receptor,PRR),可与损伤相关分子模式蛋白(damage-associated molecular patterns,DAMP)和病原体相关分子模式蛋白(pathogen-associated molecular patterns,PAMP)结合起免疫效应[12,13]。因此在巨噬细胞中敲除Mincle可为巨噬细胞极化相关的炎症研究提供重要素材。CRISPR/Cas9技术是目前最前沿的基因修饰技术,可用于细胞和动物的基因编辑[14]。CRISPR/Cas9载体质粒(融合Cas9和gRNA的质粒)可通过显微注射法注射到小鼠胚胎中建立基因修饰小鼠[15];也可转染到组织器官固有细胞系或肿瘤细胞中建立基因修饰细胞系[16]。然而,转染CRISPR/Cas9载体到免疫细胞建立基因修饰的免疫细胞却非常困难,特别是脂质体转染,这可能是由于免疫细胞对外源物质的抵抗作用。因此,目前多用病毒感染或电转的方式转染CRISPR/Cas9载体,但病毒包装较为复杂,且花费较多[17]。本研究将利用具有四步电转程序的电转仪,通过电转染,基于CRISPR/Cas9技术将Mincle敲除载体转染至RAW264.7巨噬细胞,摸索出最佳的巨噬细胞电转条件,并在敲除Mincle的巨噬细胞中验证LPS刺激下巨噬细胞极性和炎症的改变。
1 材料与方法
1.1材料 鼠源巨噬细胞系RAW264.7细胞购于上海细胞库;px-458骨架质粒购于ADDGENE公司;sgRNA及Real-Time PCR引物由上海生工生物有限公司合成;高效基因电转系统NEPA21购于广州华粤行仪器有限公司;质粒大抽试剂盒(MACHEREY-NAGEL);胶回收试剂盒、质粒小抽试剂盒、细胞基因组DNA提取试剂盒、RNA提取试剂盒(TIANGEN);T4 DNA连接酶、T4 PNK、逆转录试剂盒(Thermo);Real-Time PCR试剂盒(QIAGEN);限制性内切酶BbsⅠ(TaKaRa);DMEM高糖培养基、OPTI-MEM培养基、胎牛血清(Gibco);Mincle抗体、β-actin抗体(Santa Cruz);Alexa 488抗鼠荧光二抗(CST);HRP偶联兔抗鼠IgG(Abway);超敏ECL化学发光底物(四正柏生物);MTT(Affymetrix); IL-1β,IL-6和IL-10 ELISA试剂盒(欣博盛)。
1.2方法
1.2.1Mincle敲除靶点的筛选和寡核苷酸链的合成 根据CRISPR/Cas9的作用原理,在CRISPR在线设计网站中输入鼠源Mincle的cDNA序列(https://zlab.bio/guide-design-resources),选择评分较高且位于2号外显子的靶点作为目标靶点。该靶点位于反义链,在反义链5′端添加CACC,正义链5′端添加AAAC,添加后的靶点序列为:F:5′-CACCGGAGGCCCCGGCTATCGTCC-3′,R:5′-AAACGGACG-ATAGCCGGGGCCTCC-3′;鉴定引物为:F:5′-GTTAGCTTTCTGGGTGAGGA-3′,R:5′-AAACAACAAA-GTCGGTCAAG-3′。
1.2.2px-458-Mincle质粒的构建 sgRNA磷酸化与变性:合成的正反向Mincle-sgRNA各1 μl(100 μmol/L)加入0.5 μl T4 PNK、6.5 μl ddH2O、1 μl 10×T4 Ligation buffer,37℃ 30 min、95℃ 5 min反应后梯度降温至25℃,1∶200稀释备用;载体连接:50 ng用BbsⅠ酶切后回收的线性化px-458载体加入1 μl稀释后的sgRNA变性产物、2 μl 10×T4 Ligation buffer、0.5 μl T4 DNA连接酶,加ddH2O至20 μl,22℃ 10 min;转化:取100 μl感受态细胞于冰上融化,加入上步的连接产物5 μl,混匀后置于冰上30 min,将感受态细胞放入42℃水浴中热激90 s后立即冰浴2 min,加入0.9 ml未加抗生素的LB培养基,37℃温育1 h,4 000 r/min离心3 min,留200 μl上清将菌体打散,均匀涂布与含Amp抗生素的琼脂糖平板上,倒扣于37℃培养箱过夜;克隆挑选:随机挑取在培养皿中长出的单克隆5个,分别将其加入含有Amp抗性的4 ml LB培养基中,37℃摇床上120 r/min温育过夜,分别冻存部分菌液后,用质粒小抽试剂盒提取剩余菌液的质粒DNA,分别将5个克隆的质粒DNA送往公司测序。测序引物:5′-GAGGGCCTATTTCCCATGATT-3′,测序结果显示sgRNA准确插入质粒,即表明px-458-Mincle载体构建成功。
1.2.3RAW264.7细胞培养 RAW264.7细胞采用DMEM高糖培养基培养,加入10%胎牛血清和合适浓度的青霉素、链霉素,37℃ 5%CO2孵育培养。当细胞密度达到80%~90%时即可传代。电转前,将细胞接种于24孔板,待细胞密度长为80%时即可开始电转。
1.2.4px-458-Mincle质粒的电转 将大抽提取得到的px-458-Mincle质粒用OPTI-MEM培养基稀释到1 μg/μl,总体积不低于300 μl。准备一个干净的24孔板,1孔为70%乙醇,2孔为OPTI-MEM培养基,将电极(CUY900-13-3-5,24孔板贴壁转染专用)提前放入超净台紫外照射10 min,然后将电极浸泡于70%乙醇中消毒3~5 s,转入空孔中晾干电极后再将其移入OPTI-MEM中清洗两次。从孵箱中取出细胞,用OPTI-MEM清洗1~2次,吸出OPTI-MEM培养基,加入300 μl质粒稀释液,将电极置于孔中,用手扶稳电极,测量电阻于170~300 Ω之间后即可开始按照设定程序执行电转(表1),第1次电转后将电极旋转90°再执行1次电转,回收质粒稀释液(可冻存后多次使用),加入完全培养基培养48 h观察荧光(px-458载体自带EGFP荧光)并消化提取细胞用于后续鉴定。

表1 电转参数Tab.1 Set parameters
1.2.5电转后细胞存活检测 采用MTT法检测电转后细胞存活情况。接种2×105个细胞于24孔板,培养24 h使其贴壁。按照各电转参数电转后用PBS清洗细胞2次,洗去死细胞,加入200 μl 0.5%MTT溶液培养4 h。弃去MTT溶液后,PBS洗2次,加入400 μl DMSO,室温避光振荡10 min。吸取100 μl紫色溶液至96孔板,并放入酶标仪中采用570 nm波长(参考波长630 nm)测量OD值。
1.2.6Mincle敲除细胞株单克隆的筛选和测序鉴定 将电转后48 h的细胞通过流式分选仪筛选出具有荧光的细胞,以0.5个/孔接种于多个96孔板,也可在超净台中借助显微镜用接有滤头的口径为100 μm的玻璃口吸管吸取单个细胞接种于96孔板。待单个细胞长出克隆以后分盘扩大培养,冻存部分细胞后提取细胞的DNA,并采用鉴定引物扩增PCR,产物送测序,测序结果和Mincle原始序列比较。靶点附近缺失纯合子,且缺失碱基为非3的倍数即为敲除成功,进入蛋白表达鉴定环节。
1.2.7Mincle敲除细胞Mincle蛋白表达的检测
1.2.7.1细胞免疫荧光 野生型RAW264.7细胞和Mincle敲除RAW264.7细胞分别接种于细胞爬片,24 h后去除培养基,加入PBS清洗2次,4%多聚甲醛室温固定30 min,PBS清洗两次后用5%山羊血清室温封闭30 min,随后加入1%山羊血清PBS溶液1∶100 稀释的Mincle一抗,4℃过夜孵育。去除一抗后,PBS洗两次,加入1%山羊血清PBS溶液1∶200稀释的荧光二抗,避光室温孵育1 h,随后PBS清洗两次加入DAPI染核后封片,荧光显微镜检测。
1.2.7.2Western blot 野生型RAW264.7细胞和Mincle敲除RAW264.7细胞分别接种于6孔板,待细胞密度90%后,除去培养基,PBS清洗两次,加入150 μl RIPA裂解液刮下细胞,冰上放置30 min,超声后离心去除沉淀,上清测定蛋白浓度。向10%的聚丙烯酰胺凝胶中加入30 μg的各组蛋白样品,100 V 电泳1.5 h。将凝胶置于PVDF膜,湿转法将蛋白转印到膜上,80 V转膜45 min。5%山羊血清室温封闭1 h,1%山羊血清PBS溶液1∶1 000稀释的Mincle一抗,4℃过夜孵育。去除一抗,TBST洗膜3次,每次5 min,加入1∶3 000稀释HRP偶联兔抗鼠IgG室温孵育1 h,TBST洗膜3次,每次5 min,超敏ECL化学发光底物曝光并上机检测。
1.2.8Mincle敲除细胞LPS刺激后炎症因子和细胞极性标志物表达检测 将通过测序分析、免疫荧光和Western blot检测确认的Mincle敲除细胞和正常RAW264.7细胞接种于12孔板,培养过夜后加入100 ng/ml的LPS刺激12 h,RNA提取试剂盒提取细胞总RNA,并用试剂盒逆转录为cDNA,再用Real-Time PCR试剂盒完成PCR检测,反应程序为:98℃ 10 min,94℃ 30 s,58℃ 30 s,72℃ 30 s,循环40次。对应的引物序列见表2。

表2 引物序列Tab.2 Primer sequences
1.2.9细胞上清中炎症因子分泌的检测 采用ELSIA试剂盒检测各组细胞上清液中促炎因子IL-1β和IL-6,抗炎因子IL-10的浓度。细胞在加入LPS 24 h后收集上清,3 000 r/min离心10 min去除沉淀,将100 μl上清液加入ELISA板反应孔,37℃孵育90 min,洗板3次,每孔加入生物素化抗体稀释液100 μl,37℃反应60 min,洗板3次,加入酶结合物工作液,37℃避光孵育30 min,洗板并加入显色底物和终止液,酶标仪于450 nm波长读取数值,并最终得到对应炎症因子浓度。

2 结果
2.1px-458-Mincle质粒电转RAW264.7细胞的最佳条件 电转结果显示,当电转时间为2.5 ms时,电转效率很低,而当电转时间调整为5 ms,且电压为250 V和300 V时,电转效率显著提升,最高电转率达到了30.7%(图1)。MTT结果表明,当电转时间调整为7.5 ms时,细胞出现大量死亡,(250 V,7.5 ms)和(300 V,7.5 ms)组细胞死亡率与正常组相比,差异有统计学意义(P<0.01),故最佳电转条件为300 V,5 ms。

图1 电转效率检测Fig.1 Electroporation efficiency detection
2.2电转染CRISPR/Cas9质粒有较高的基因敲除成功率 流式细胞分选技术获得的单个荧光阳性细胞分别建立了36个细胞克隆,测序结果显示,突变率为58.33%,纯合子突变率为22.22%,敲除成功率为16.67%(缺失碱基数非3的倍数)(表3),其中敲除成功的细胞编号分别为1B5、1C5、1C6、2A3、2B3、2D3,其测序结果比对见图2。

图2 敲除成功的细胞株序列比对Fig.2 Sequence alignment of Mincle knockout cell line

表3 Mincle敲除结果Tab.3 Results of Mincle knockout
其中,1B5、1C5、2B3、2D3分别在靶点的PAM区前面3~4个碱基处缺失1个碱基,1C6在PAM区前面3~4个碱基处缺失4个碱基,2A3在靶点附近缺失87个碱基,但只有85个缺失的碱基位于外显子,因此6个细胞株在靶点附近缺失的碱基数均非3的倍数。
2.3Mincle敲除细胞的Mincle蛋白表达检测 本研究选用1C6号细胞株采用免疫荧光和Western blot检测Mincle蛋白在敲除细胞中变化。免疫荧光结果显示,1C6号细胞的Mincle蛋白完全缺失。野生型RAW264.7巨噬细胞中Mincle表达于细胞膜,Mincle敲除后,细胞膜及细胞质内均未见Mincle蛋白表达。Western blot结果表明,1C6号细胞中Mincle蛋白条带消失(P<0.001),证明Mincle在该细胞系中敲除成功。见图3。

图3 Mincle敲除RAW264.7细胞中Mincle蛋白缺失Fig.3 Mincle protein is lost in Mincle KO RAW264.7 cellNote:Compared with control,***.P<0.001.
2.4Mincle敲除可显著降低LPS诱导的细胞炎症 未敲除Mincle时,LPS刺激可显著提升IL-1β、IL-6、TNF-α和MCP-1表达,敲除Mincle后,LPS刺激下细胞IL-1β、IL-6、TNF-α和MCP-1表达显著降低(P<0.001),见图4A~D。而Mincle敲除后,抑制炎症的因子IL-10在LPS刺激下表达增加(P<0.01),见图4E。ELISA进一步检测结果显示,Mincle敲除显著降低了LPS刺激下促炎因子IL-1β和IL-6分泌(P<0.001,图4F、G),增加了抑制炎症因子IL-10分泌(P<0.001,图4H),提示Mincle可促进巨噬细胞的炎症因子的表达和分泌,可能参与了巨噬细胞主导的疾病或炎症。
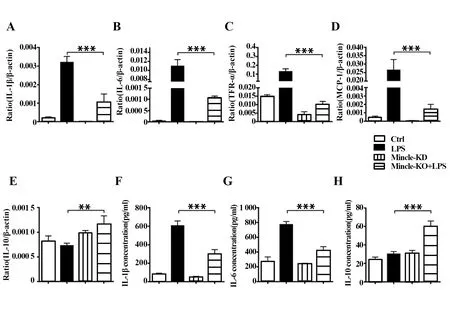
图4 Mincle敲除显著降低了LPS诱导的炎症因子表达Fig.4 Mincle knockout significantly reduces expression of inflammatory factor induced by LPSNote:**.P<0.01,***.P<0.001.
2.5Mincle敲除可平衡LPS诱导的巨噬细胞极性 LPS刺激下,巨噬细胞极性平衡被打破,M1巨噬细胞增加,M2巨噬细胞减少。Mincle敲除后,LPS刺激下的巨噬细胞极性平衡得到有效恢复。iNOS(M1巨噬细胞标志物)表达显著降低(P<0.001),CD206(M2巨噬细胞标志物)表达显著升高(P<0.001),提示Mincle在维护M1巨噬细胞极性中具有重要作用。见图5。

图5 Mincle敲除对M1、M2巨噬细胞标志物表达的影响Fig.5 Effect of expressions on Mincle knockout of M1,M2 macrophage markerNote:***.P<0.001.
3 讨论
本研究采用NEPA21高效电转仪系统进行巨噬细胞系RAW264.7敲除Mincle的条件摸索,成功构建了Mincle敲除RAW264.7巨噬细胞系,并验证了巨噬细胞缺失Mincle后可显著降低LPS诱导的炎症因子表达并平衡巨噬细胞极性。NEPA21电转仪采用了四步法电转程序,包括电穿孔模式、反向电穿孔模式、基因导入模式和反向导入模式,比常规的电转仪转染效率高,且提高了细胞存活率,目前,该电转仪不仅用于贴壁细胞的转染,还可用于悬浮细胞、哺乳动物胚胎和活体器官电转,已广泛用于各种基因修饰研究[18]。课题组的前期研究中采用脂质体转染的方式尝试建立Mincle敲除的RAW264.7细胞株,选用了多种脂质体转染试剂,如Lipofecta-min2000、Lipofectamin3000和LipoD293,即便是采用说明书推荐的最高浓度转染也均不能获得较多的荧光阳性RAW264.7细胞,说明脂质体转染对免疫细胞的低效性,其可能是由于免疫细胞对外源物质的抵抗作用导致的。而慢病毒转染需要病毒包装,花费大量时间和试剂。因此,本研究运用新一代的电转仪NEPA21电转px-458-Minlce质粒建立Mincle敲除的RAW264.7巨噬细胞。参照NEPA21电转仪的说明书设置参数,除了电打孔阶段的电压和电转时间为可修改参数外,其余参数均不变。为了摸索该电转仪对RAW264.7细胞的最佳电转参数,设置了多个电压和电转时间,分别是:(125 V,2.5 ms)、(150 V,2.5 ms)、(200 V,2.5 ms)、(250 V,2.5 ms)、(300 V,2.5 ms)、(200 V,5 ms)、(250 V,5 ms)、(300 V,5 ms)、(250 V,7.5 ms)和(300 V,7.5 ms)。最终通过一系列实验摸索,确定电穿孔电压300 V,电穿孔时间5 ms的参数具有最佳的巨噬细胞质粒转染效率。值得注意的是,该仪器常规细胞的电转仅需要 200 V、2.5 ms,进一步说明巨噬细胞转染的难度大。通过流式细胞分选获取的电转后荧光阳性细胞的Mincle靶点突变率达到58.33%,纯合子突变率高达22.22%,说明CRISPR/Cas9质粒可用于该电转法,且突变效率高,适用于难度大的细胞转染。
Mincle是表达于巨噬细胞上的C型凝集素受体,与多种不同的配体结合能够发挥促炎效果。目前已有研究报道显示,Mincle参与宿主防御,在炎症、免疫性疾病,感染性疾病(包括病毒、真菌、结核杆菌感染性疾病)和肿瘤中具有重要作用[19]。Mincle可促进巨噬细胞诱导的适应性免疫抑制,从而促进胰腺癌的进展,提示Mincle通过调节肿瘤微环境参与肿瘤免疫反应[20]。Mincle还参与自身免疫性眼炎、肝炎、脑炎等多种疾病的发生发展。此外,Mincle可与胆固醇结晶结合活化巨噬细胞促进炎症反应,提示其可能参与了动脉粥样硬化斑块的发生发展[21,22]。同时,Mincle 还与肥胖诱导组织纤维化相关,提示Mincle可能促进巨噬细胞参与组织重构和纤维化[23]。虽然对Mincle的研究日益增多,但目前Mincle参与和诱导这些炎症、免疫疾病的分子和细胞机制尚不明确。近期有研究报道,Mincle在急性肾损伤中维护了M1巨噬细胞极性,促进了炎症的发生发展,在急性肾损伤中沉默Mincle可有效降低M1巨噬细胞数量,减少炎症,保护肾脏,提示Mincle参与炎症反应的机制可能与其对M1巨噬细胞的维护有关[11]。本研究在此基础上,通过电转CRISPR/Cas9质粒的方式在RAW264.7巨噬细胞系中建立Mincle敲除细胞株。通过对Mincle敲除株的研究发现,在RAW264.7巨噬细胞中敲除Mincle可显著抑制LPS诱导的炎症因子表达和分泌M1巨噬细胞标志物iNOS表达,并增加M2巨噬细胞标志物CD206表达,说明Mincle可能通过维护M1巨噬细胞促进炎症反应,抑制巨噬细胞中的Mincle可能是多种炎症疾病的治疗途径和靶点。然而目前的研究均未找到Mincle维护巨噬细胞极性的具体机制,对其的研究也主要体现在作用的验证上。本课题组认为可以从调控巨噬细胞极性的转录因子入手,分析Mincle是否直接或间接地与这类转录因子相互作用,进而维护巨噬细胞极性。课题组的后续研究将运用此细胞株开展Mincle调控巨噬细胞极性的机制研究以及与炎症相关的机制探索。
本研究结果表明采用电转法转染CRISPR/Cas9敲除质粒可有效地在RAW264.7巨噬细胞中建立基因敲除细胞株,其突变效率高,对细胞的损伤小。在RAW264.7巨噬细胞中敲除Mincle显著降低了LPS诱导的细胞炎症因子表达,其可能与抑制了巨噬细胞向M1型转化,恢复其M2型表型有关,说明了Mincle在巨噬细胞炎症反应中的重要作用。
——一道江苏高考题的奥秘解读和拓展