miR-125a靶向E2F2抑制口腔鳞状细胞癌干细胞干性的初步研究①
陈宏丽 赵洪波 尹 刚③
(山西医科大学汾阳学院口腔医学教研室,汾阳 032200)
头颈部肿瘤包括由口腔、咽、喉的黏膜内层引起的异质肿瘤,占全世界肿瘤病例总数的六分之一[1]。口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC) 是最常见的头颈部恶性肿瘤之一,全球每年新发病例约30万例[2]。OSCC是一种具有破坏性的恶性肿瘤,具有高侵袭性和转移性,预后较差[3]。外科手术是早期OSCC治疗的主要方法,疗效尚可,但仍有20%的患者死亡,且手术疗法对于晚期和复发的OCSS患者治疗具有局限性,OSCC的发病机制也尚未完全明确,因此研究OSCC的发病原因,寻找新的治疗途径,从而提高患者生存率是迫切需要的[4,5]。OSCC具有组织异质性和复杂肿瘤微环境的重要特征,与肿瘤干细胞(cancer stem cells,CSCs)密切相关。CSCs是存在于肿瘤细胞的一小部分群体,具有促进使肿瘤恶性增殖、推动肿瘤转移、诱导肿瘤耐药和引起肿瘤复发的恶性生物学行为,统称为干性。CSCs的干性是肿瘤预后较差的重要原因之一[6]。有研究从人鳞状细胞癌细胞系Cal-27可以培养分选出CD133高表达且具有较高自我更新能力的CSCs,因此从CSCs的角度去寻找OSCC新的治疗途径是重要研究方向之一[7]。近年来miRNAs在调控CSCs重要生物学功能方面的研究越来越多,这些研究均表明肿瘤中异常表达的miRNAs通过调控CSCs的干性促进恶性肿瘤的发生发展[8,9]。miR-125a是高度保守的miR-125家族成员,其异常表达在肿瘤的增殖和转移等生物过程中发挥重要作用[10]。在乳腺癌中,抑制miR-125a表达可导致CSCs生成减少。miR-125a在OSCC组织中表达减少,通过负调控雌激素相关受体α抑制OSCC细胞增殖,促进细胞凋亡,而miR-125a表达情况对于OSCC 中CSCs的影响鲜有报道[11]。此外,E2F转录因子2(E2F transcription factor 2,E2F2)在多种肿瘤中为癌基因,可能为miR-125b的靶基因[12,13]。因此本文主要研究miR-125a在CSCs干性中发挥的作用及靶向调控E2F2的初步机制,为发现OSCC新的治疗策略提供研究思路。
1 资料与方法
1.1资料
1.1.1组织样本 根据以下条件:2015年6月~2016年6月入住山西医科大学附属汾阳医院的患者;均签署知情同意书;未患有其他肿瘤或威胁生命健康的全身性疾病;未接受放化疗、靶向治疗等影响肿瘤的治疗;具有完整的病例资料;病理专家证实为OSCC,共收集40例OSCC标本。OSCC患者年龄28~75岁,平均年龄(45.98±21.65)岁,<55岁者15例,≥55岁者25例;男28例,女12例;另选取20例正常口腔黏膜组织作为对照,年龄32~70岁,平均年龄(48.36±25.19)岁,<55岁者8例,≥55岁者12例;男13例,女7例;OSCC组与对照组患者的年龄、性别资料均具有可比性。所有组织标本操作均由我院伦理委员会审核通过。
1.1.2试剂与仪器 TRIzol、反转录及qRT-PCR试剂盒等均购自日本TaKaRa公司;OSCC细胞系Cal-27、人口腔黏膜角化细胞HOK均购自美国ATCC细胞库;DMEM高糖、RPMI1640培养基及胎牛血清FBS均购自美国Gibco公司;miR-125a mimic由上海捷瑞生物有限公司设计合成;MTS购自美国Biovision公司;6孔板、Transwell小室、低黏附板等均购自美国Corning公司;RIPA裂解液、BCA检测蛋白浓度试剂盒均购自美国Solarbio公司;兔抗人OCT4多克隆抗体(ab181557)、鼠抗人Nanog多克隆抗体(ab109250)、兔抗人SOX2多克隆抗体(ab97959)、兔抗人GAPDH多克隆抗体(ab181602)均购自英国Abcam公司。
1.2方法
1.2.1qRT-PCR 将机械研磨破碎的组织及细胞采用TRIzol裂解氯仿提取法获得总RNA。设计合成miR-125a引物F:5′-CCGTCCCTGAGACCCTT-TAAC-3′,R:5′-GTGCAGGGTCCGAGGTATTC-3′。内参GAPDH引物F:5′-GGAGCGAGATCCCTCCA-AAAT-3′,R:5′-GGCTGTTGTCATACTTCTCATGG-3′。将提取的总RNA反转录为cDNA,以cDNA为模板,SYBR Premix ExTaq试剂盒体系进行qRT-PCR,采用2-ΔΔCt法分析各组实验数据,检测miR-125a表达。
1.2.2细胞培养及转染 DMEM高糖+10%FBS培养OSCC细胞系Cal-27,RPMI1640+10%FBS培养人口腔黏膜角化细胞HOK,培养条件为37℃、5%CO2。将Cal-27细胞肿瘤球制成单个细胞后依次与小鼠抗人CD133抗体、小鼠抗人CD44抗体包被的磁珠孵育,分选出CD133+CD44+的CCSCs和CD133-CD44-的细胞,无血清培养基中继续培养。流式细胞术检测CD133+CD44+阳性细胞率[12]。CSCs细胞对数生长期时胰酶消化后铺至6孔板,按说明书将脂质体2000与对照组和miR-125a mimic转染试剂转染至CSCs,分为NC组和miR-125a mimic组,放至培养箱中培养。
1.2.3MTS增殖实验 收集转染48 h后的各组CSCs细胞胰酶消化计数,以2 500个/孔、150 μl培养基接种于96孔板,培养0、1、2、3和4 d,每组设6个复孔,轻轻放至细胞培养箱中培养,细胞完全贴壁后在对应时间每孔加入30 μl MTS工作液,在培养箱中反应2 h后,酶标仪检测490 nm波长处OD值。
1.2.4软琼脂克隆形成实验 收集转染48 h后的各组CSCs细胞胰酶消化计数,以1×105个/孔重悬于1 ml 20%无血清培养基与0.6 %灭菌的软琼脂1∶1混合物,铺至预先铺好固体胶(500 μl 20%无血清培养基与500 μl 1.2%灭菌后的软琼脂1∶1充分混匀后冷却为固态)的6 cm培养皿,置于培养箱中培养,每天在显微镜下观察克隆形态并拍照。
1.2.5Transwell实验 收集转染48 h后的各组CSCs细胞胰酶消化计数,无血清培养基洗3次,以1×105个/孔、100 μl无血清培养基接种于Transwell小室聚碳酸酯微孔膜上室,500 μl完全培养基加入下室作为趋化因子,置于培养箱中培养直至下室穿过10个细胞时终止培养,PBS将聚碳酸酯微孔膜上室面细胞洗掉,甲醇固定微孔膜15 min,苏木素染细胞核。随机计数显微镜下5个视野聚碳酸酯微孔膜下室面细胞。
1.2.6Western blot检测蛋白表达 收集转染48 h后的各组CSCs细胞,加入RIPA裂解液(含有蛋白酶和磷酸酶抑制剂),匀浆机冰上裂解10 min,4℃、13 000 r/min 离心30 min,取上清液,BCA检测蛋白浓度,变性后SDS-PAGE电泳分离蛋白,湿性转膜,5% BSA室温封闭3 h,TBST清洗5 min后加入一抗(1∶500)孵育4℃过夜,TBST清洗5 min×3次后,二抗(1∶1 000)室温孵育2 h,ECL化学发光法曝光条带。
1.2.7miR-125a靶基因的验证 TargetScan7.1软件(http://www.targetscan.org/)预测miR-125a的靶基因。双荧光素酶报告基因实验分别将以下4组共转染至CSCs:E2F2-wt与miR-125a mimics共转染组(E2F2-wt+miR-125a);E2F2-wt与NC共转染组(E2F2-wt+NC);E2F2-mut与miR-125a mimics共转染组(E2F2-mut+miR-125a);E2F2-mut与NC共转染组(E2F2-mut+NC),收集转染48 h的细胞,根据双荧光素酶报告基因检测试剂盒说明书检测各组荧光素酶活性。

2 结果
2.1miR-125a在组织和正常口腔黏膜组织中的表达 qRT-PCR结果表明,OSCC miR-125a在OSCC组织中的表达(1.08±0.44)显著低于正常口腔黏膜组织(1.65±0.47)(t=4.625,P=0.000)。miR-125a在肿瘤直径≥4 cm组织中的表达显著低于直径<4 cm组织,在TNM Ⅲ~Ⅳ期组织中的表达显著低于Ⅰ~Ⅱ期组织,在有淋巴结转移组织中的表达显著低于无淋巴结转移组织,差异均有统计学意义(P<0.05),见表1。

表1 miR-125a在OSCC组织中的表达水平与临床病例特征间的关系Tab.1 Relationship between expression level of miR-125a in OSCC and clinical case
2.2OSCC干细胞的分选与鉴定结果 流式细胞术检测CD133+CD44+细胞阳性率为92.15%,Western blot检测OCT4、 Nanog和SOX2干性标志蛋白在CD133+CD44+细胞中表达显著高于CD133-CD44-细胞(P<0.05),见图1。
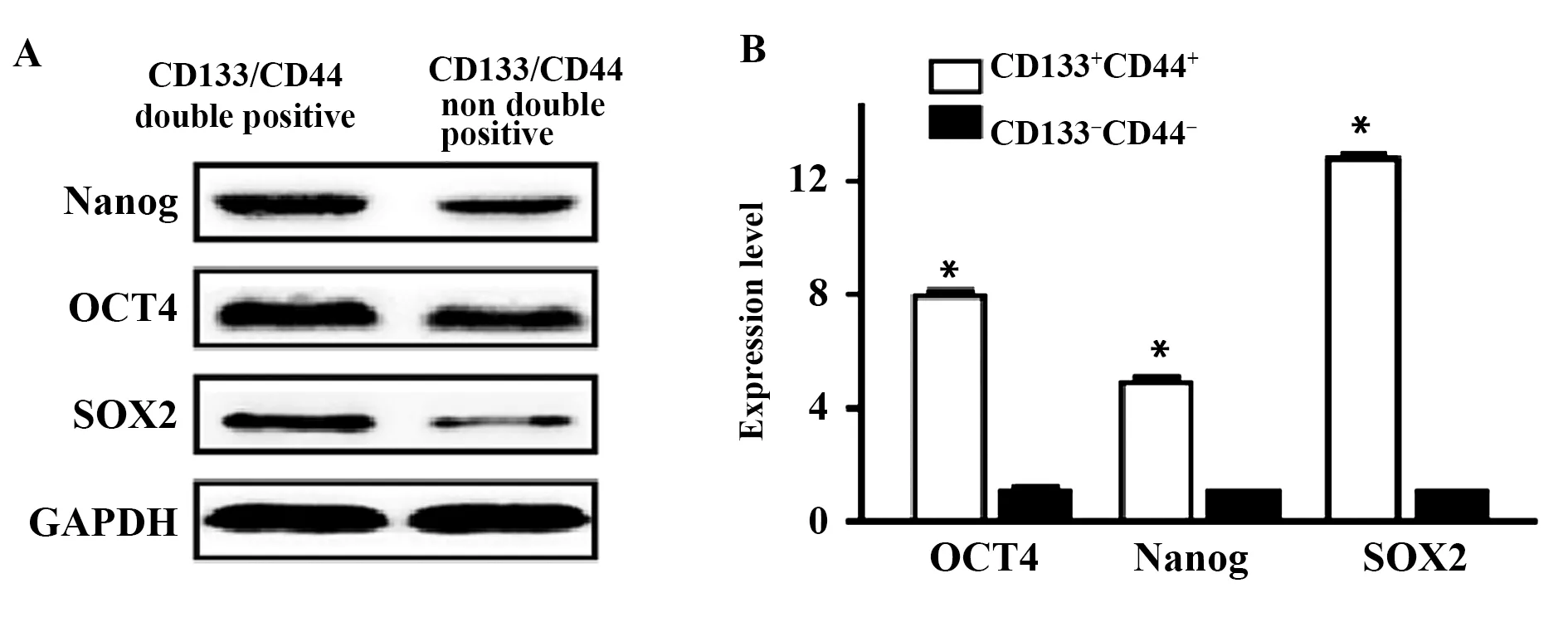
图1 Western blot检测OCT4、Nanog和SOX2干性标志蛋白在CD133+CD44+细胞中的表达水平Fig.1 Western blot detected expressions of OCT4,Nanog and SOX2 stem marker proteins in CD133+CD44+ cellsNote:Compared with CD133-CD44-cells,*.P<0.05.
2.3miR-125a在OSCC干细胞中的表达 qRT-PCR结果显示,miR-125a在CD133+CD44+细胞和CD133-CD44-细胞中的表达为0.26±0.04和0.49±0.10,均低于人口腔黏膜角化细胞HOK(1.02±0.03),在CD133+CD44+细胞中的表达最低。miR-125a mimic转染OSCC干细胞,qRT-PCR检测显示miR-125a mimic组中miR-125a的表达(11.99±2.13)显著高于NC对照组(1.05±0.05),差异有统计学意义(P<0.05),见图2。
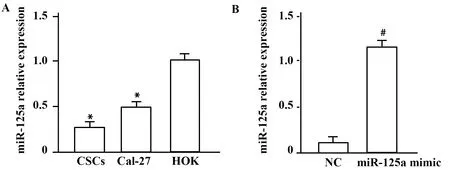
图2 qRT-PCR检测各组细胞中miR-125a的表达Fig.2 qRT-PCR detected expressions of miR-125a in cells of each groupNote:Compared with HOK cells,*.P<0.05;compared with NC group,#.P<0.05.
2.4MTS检测miR-125a过表达对OSCC干细胞增殖的影响 与NC对照组相比,miR-125a mimic组细胞增殖能力明显减弱,差异有统计学意义(P<0.05),见图3。
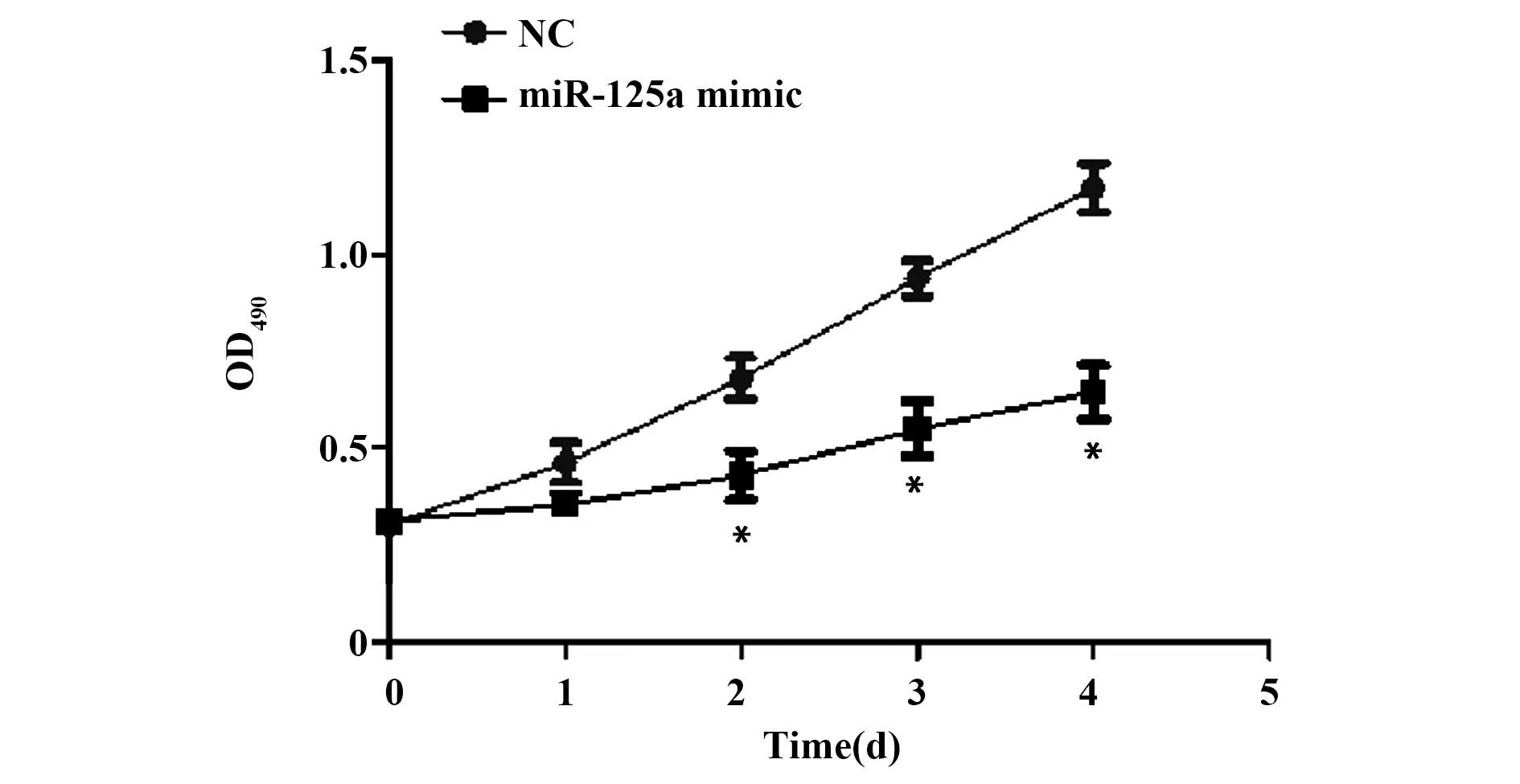
图3 MTS检测miR-125a对OSCC干细胞增殖能力的影响Fig.3 MTS detected effect of miR-125a on proliferation of OSCC stem cellsNote:Compared with NC group,*.P<0.05.
2.5软琼脂克隆检测miR-125a 过表达对OSCC干细胞克隆形成能力的影响 miR-125a mimic组细胞克隆形成能力明显弱于NC对照组,见图4。
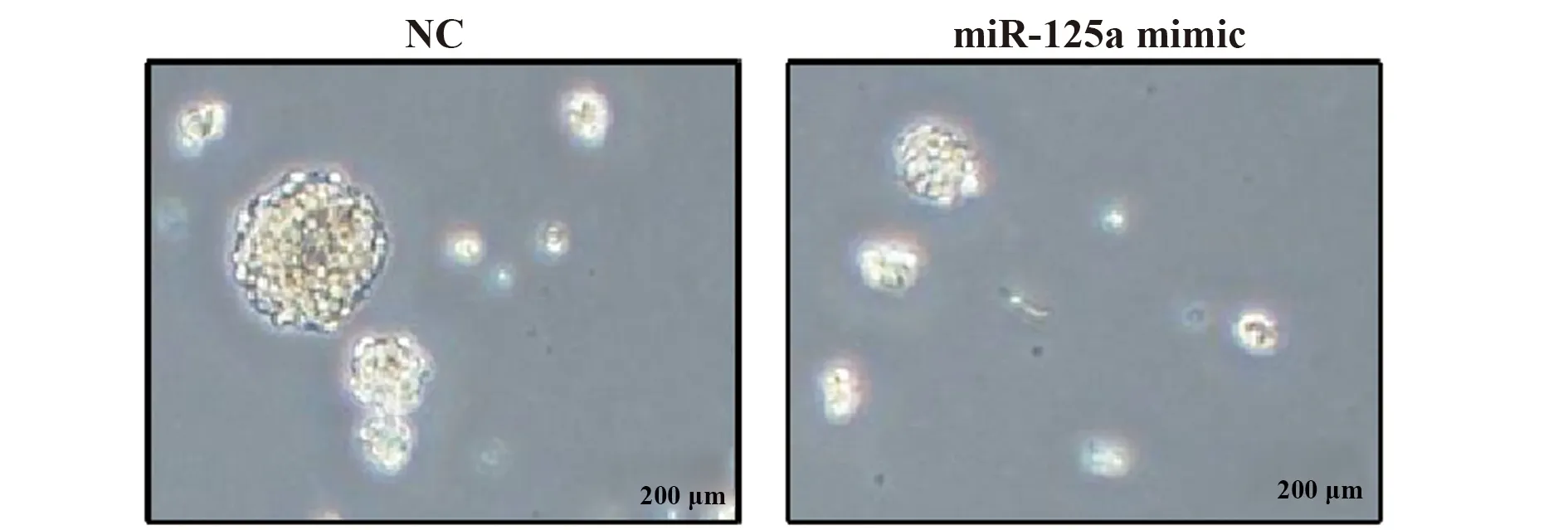
图4 软琼脂克隆形成实验检测miR-125a对OSCC干细胞克隆形成能力的影响Fig.4 Soft agar colony formation assay detected effect of miR-125a on clone formation ability of OSCC stem cell
2.6Transwell检测miR-125a 过表达对OSCC干细胞转移能力的影响 miR-125a mimic组和NC对照组细胞穿膜数分别为(67.98±11.35)个和(101.35±8.56)个。miR-125a mimic组细胞转移能力明显低于NC对照组,差异有统计学意义(P<0.05),见图5。
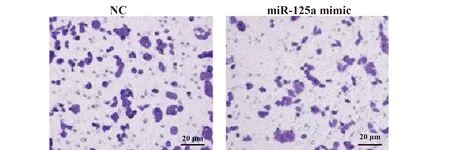
图5 Transwell检测miR-125a过表达对OSCC干细胞转移能力的影响Fig.5 Transwell assay detected effect of miR-125a on OSCC stem cell metastasis
2.7miR-125a对E2F2的调控作用 如图6A所示,TargetScan7.1软件在线预测显示E2F2启动子区有miR-125a的结合位点。对E2F2与miR-125a的结合位点进行突变,突变位点见图6B,双荧光素酶报告基因实验显示,与E2F2-wt+NC共转染组相比,E2F2-wt+miR-125a共转染组的荧光素酶活性显著降低(P<0.05);而E2F2-mut+NC和E2F2-mut+miR-125a组之间的荧光素酶活性差异无统计学意义(P>0.05),见图6C。qRT-PCR结果显示,与对照组相比,miR-125a mimic组OSCC干细胞中E2F2 mRNA和蛋白表达水平显著下降(P<0.05),见图6D、E。

图6 miR-125a对E2F2基因的调控作用Fig.6 Regulation of E2F2 by miR-125aNote:Compared with NC group,P<0.05.
3 讨论
OSCC具有高发病率和死亡率,严重危害人类生命健康[14]。OSCC的局部侵袭和远处转移及患者对化疗放疗的抗性是治疗的主要障碍,也是导致患者预后较差的主要原因[3]。虽然近些年医学的进步使OSCC的治疗效果得到一定改善,但患者5年生存率并未明显提高[15]。分子医学的最新发展使研究者认识到肿瘤细胞生长是破坏细胞增殖、分化和凋亡正常机制的结果。干细胞是具有自我更新和分化潜能的多能细胞,而肿瘤干细胞是目前已经证实的与干细胞具有相似功能的存在于肿瘤细胞中的一小部分细胞群体,是肿瘤细胞增殖的源头和维持肿瘤细胞侵袭和转移的动力,在肿瘤的恶性生物学行为中具有重要地位[16]。Zhang等[17]利用低髓样细胞白血病1(Mcl-1)基因特异性抑制剂S63845或A-1210477抑制Mcl-1表达,细胞凋亡信号启动,肝细胞癌干细胞转录因子Nanog、Sox2和KLF4表达水平降低,并显著抑制了肿瘤球形成,提示肿瘤干细胞具有作为药物靶点的潜能。
越来越多的研究报道miRNAs在调控肿瘤干细胞的干性中发挥重要功能。miRNAs是一类长度为19~25个核苷酸且高度保守的内源性RNA,不具备编码蛋白质的功能,其可作为促癌因子和抑癌因子在肿瘤中发挥促进肿瘤增殖、侵袭和转移等功能[18]。miRNAs同样在肿瘤干细胞干性中具有正调控和负调控作用。在肝癌干细胞中干扰miR-21表达可显著抑制高侵袭肝癌干细胞的增殖和侵袭[19]。miR-30-5p在结直肠癌中表达降低,过表达miR-30-5p可通过抑制USP22显著降低干细胞标志物CD133和Sox2表达、肿瘤球形成和细胞增殖[9]。近年来miRNAs在OSCC中调控肿瘤干细胞的机制逐渐清晰,Lin等[20]报道miR-1246在OSCC组织和肿瘤干细胞中高表达,miR-1246靶向抑制CCNG2可显著降低肿瘤干细胞的干性。ΔNp63和miR-138-5p通过相互作用促进OSCC细胞生长、转移和肿瘤干细胞干性[21]。miR-125a位于染色体19q13.41,属于miR-125家族,miR-125家族成员的异常表达与肿瘤的发生发展密切相关[22]。Yang等[23]发现miR-125a-5p在结肠癌组织和细胞系中表达下调,其在体内抑制结肠癌细胞增殖,在体外通过靶向VEGFA抑制结肠癌细胞的增殖、迁移和侵袭。而miR-125a在骨巨细胞瘤中表达上调,且其高表达与肿瘤局部浸润、分级和复发有关。同时miR-125a可通过靶向TET2和Foxp3刺激IL-17A表达,通过靶向APC和GSK3β刺激β-连环蛋白表达,最终促进基质细胞的致瘤性和增殖[24]。由此可以推断miR-125a在不同肿瘤中的表达水平及作用机制不同,而miR-125a在OSCC中的研究较少,因此作者对此进行了研究。
实验首先检测miR-125a在40例OSCC组织和20例正常口腔黏膜组织中的表达水平,qRT-PCR结果显示miR-125a在OSCC组织中的表达显著低于口腔黏膜组织,而Tiwari等[13]同样采用qRT-PCR检测20例OSCC组织和配对的癌旁组织中miR-125a的表达水平,结果表明,与癌旁组织相比,有16例OSCC组织中miR-125a表达下调,与本文研究结果一致,提示miR-125a可能为抑癌因子。由于吸烟、饮酒等危险因素,OSCC男性患者较多,此外OSCC发病多见于老年人,但随着社会的发展,性行为方式的改变、辐射化学致癌物的接触以及药物滥用导致的免疫抑制等原因使得OSCC发病年龄提前,研究报道有4%~6%的OSCC发生年龄小于40岁,且这种年轻化趋势仍然在发展[25]。
OSCC最常发生于舌部,但肿瘤形成的其他常见部位是唇部和口底区[26]。因此对miR-125a在OSCC患者性别、年龄、肿瘤发生部位、肿瘤大小、TNM分期、淋巴结转移组织中的表达水平进行了检测,结果发现miR-125a在肿瘤直径较大、TNM晚期和淋巴结转移组织中表达降低,表明miR-125a在OSCC中表达下调可能促进OSCC的增殖、侵袭和转移。研究报道肿瘤相关巨噬细胞外泌体中miR-125a表达水平降低,促进肝细胞癌细胞增殖和肿瘤干细胞干性[27]。miR-125a在喉癌组织和肿瘤干细胞中表达下降,过表达miR-125a通过靶向造血细胞特异性蛋白1相关蛋白X-1(HAX-1)逆转喉癌干细胞顺铂耐药[28]。
为了研究miR-125a与OSCC干细胞干性关系,采用无血清培养及磁珠分选的方法将肿瘤干细胞从OSCC细胞系Cal-27细胞中分离并提纯,研究报道OSCC干细胞表面分子为CD133+CD44+,流式细胞术检测CD133+CD44+细胞阳性率为92.15%,Western blot检测OCT4、Nanog和SOX2干性标志蛋白在CD133+CD44+细胞中表达显著升高,表明CD133+CD44+细胞为肿瘤干细胞[29]。qRT-PCR检测结果显示miR-125a在OSCC干细胞中的表达显著低于在Cal-27细胞和人口腔黏膜角化细胞HOK中的表达,HOK细胞中的表达最高,与在OSCC组织中的表达一致。而miR-125a mimic转染OSCC干细胞,MTS增殖实验、软琼脂克隆形成实验和Transwell实验结果显示miR-125a过表达后OSCC干细胞增殖、肿瘤球形成能力和转移能力均下降,显著抑制OSCC干细胞的干性。
生物学功能实验已经证实miR-125a显著抑制肿瘤干细胞的干性,其具体调控机制仍有待进一步研究。miRNAs通过与靶基因mRNA的3′UTR区结合,在转录后调控基因表达发挥作用其靶基因可有数十个到数百个[30]。Tiwari等[13]报道在OSCC细胞中miR-125a靶向抑制雌激素相关受体α表达、降低细胞增殖并促进细胞凋亡、抑制裸鼠移植瘤生长。通过TargetScan7.1软件预测以及荧光素酶报告基因实验,证实E2F2为miR-125b直接调控的靶基因。E2F2是E2F家族成员,是调节各种生物学过程的转录因子家族,研究表明E2F2在宫颈癌、胶质瘤等肿瘤中为致癌基因[12,13]。E2F2在OSCC的研究报道中显示,其启动子区变异增加HPV16血清阳性的OSCC患病风险[31]。Li等[32]发现E2F2变体可作为OSCC患者复发风险的预测生物标志物。同时越来越多的文献报道E2F2与肿瘤干细胞的干性相关,Gujar等[33]报道E2F2是维持胶质瘤干细胞自我更新所必需的。此外E2F2可以作为多种miRNAs的靶基因,miR-4319可通过E2F2抑制三阴乳腺癌干细胞中肿瘤球的自我更新和形成,并抑制体内肿瘤的发生和转移[34]。miR-99a通过其与E2F2的3′-UTR区直接结合抑制肺癌干细胞的干性[35]。而OSCC干细胞转染miR-125a mimic后,qRT-PCR结果显示E2F2 mRNA表达水平显著下降,表明miR-125a可能通过靶向负调控E2F2抑制肿瘤干细胞的干性,其具体作用机制需在后续研究中深入探讨。
综上所述,miR-125a在OSCC组织和肿瘤干细胞中低表达,其低表达与OSCC患者的肿瘤直径、TNM分期及淋巴结转移显著相关,miR-125a可能通过负调控E2F2抑制OSCC干细胞的干性,miR-125a可能为治疗OSCC的潜在靶点,可为干预OSCC恶性生物学行为提供新的研究思路。