α-倒捻子素对大鼠脑缺血再灌注损伤的保护作用及其机制研究①
李 静 隋汝波
(锦州医科大学附属第一医院神经内科,锦州 121000)
脑是人体对缺氧最为敏感的器官,脑组织缺血将会导致脑组织损伤及功能障碍,及时恢复脑部血供有利于减轻损伤。然而脑缺血一定时间后再恢复血液灌注,会加重脑组织结构及功能的损伤,称为缺血再灌注(ischemia-reperfusion,IR)损伤[1]。脑IR涉及多种发病机制,包括氧化应激、内质网应激、细胞自噬、细胞凋亡、炎症反应的启动等[2-5]。针对其各种发病机制的治疗研究在近几年已成为热点,但其理想的有效治疗措施仍有待进一步探索。
山竹,又称凤果,是藤黄科藤黄属常绿乔木山竹的果实。α-倒捻子素作为山竹果壳的提取物之一,具有明显的抗炎、抗氧化、抗肿瘤和抗菌作用[6,7]。研究表明,α-倒捻子素对骨髓来源的肥大细胞中COX-2 mRNA的表达有一定的下调作用[8]。α-倒捻子素能降低磷脂酰肌醇-3激酶(PI3K)的活性,抑制蛋白激酶Akt的磷酸化,影响NF-κB信号通路[9]。Yao等[10]发现,在阿尔茨海默症小鼠模型的脑组织中,α-倒捻子素可明显降低炎症引起的小胶质细胞的激活。Pedraza-chaverrí等[11]发现,α-倒捻子素浓度依赖性减少由3-硝基丙酸诱导的神经细胞死亡,并推测这个过程可能与ROS的减少有关。目前关于α-倒捻子素在脑IR损伤中的作用及其机制的研究却鲜有报道。本实验通过建立大鼠脑IR损伤模型,并分别设立5组实验,观察并分析α-倒捻子素对大鼠脑IR损伤的保护作用及机制,以期为脑IR损伤的有效治疗探索新的方法。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级SD雄性大鼠230~250 g 100只,购于上海斯莱克实验动物有限责任公司,所有动物实验均经伦理委员会批准。
1.1.2主要试剂 二甲基亚砜(DMSO)购自Gibco公司;α-倒捻子素(纯度≥98%)购自北京友谊众生生物科技有限公司,使用时用DMSO稀释至目标浓度;超氧化物歧化酶(SOD)、丙二醛(MDA)测定试剂盒购自南京建成生物工程研究所;ELISA试剂盒购自PeproTech公司;胰酶购自Hyclone公司;BCA蛋白定量试剂盒购自Biovision公司;兔抗MAP2抗体、抗NF-κB抗体、抗CyclinD1抗体、抗c-Myc抗体、抗Bcl-2抗体、抗Bax抗体、抗Caspase-3抗体、抗GAPDH抗体均购自Abcam公司;辣根过氧化物酶标记的驴抗兔抗体购自中杉金桥公司。
1.1.3仪器 紫外分光光度计为Mettler Toledo公司产品;超速离心机、低温离心机为Thermo Fisher公司产品;Mini Protean 3 cell电泳仪、离心机为Bio-Rad公司产品;酶标仪为美国Molecular Derices公司产品。
1.2方法
1.2.1脑IR损伤模型的建立 所有大鼠适应性饲养1周后,术前12 h禁食,用3%戊巴比妥(65 mg/kg)腹腔注射麻醉大鼠后,仰卧位固定于手术台上,颈部剪毛消毒,取颈部正中做一切口,钝性分离周围组织并暴露双侧颈总动脉,利用微血管夹夹闭双侧颈总动脉,夹闭40 min后,撤去血管夹,实现大脑中动脉再灌注,脑IR模型建立完成。
1.2.2实验分组 所有大鼠随机分成5组,每组20只。假手术组(Sham):仅暴露双侧颈总动脉而不夹闭,术后灌胃给予等量DMSO;模型组(IR):按上述方法建立脑IR损伤模型,术后灌胃给予等量DMSO;α-倒捻子素低剂量组(α-M-L 5 mg/kg),α-倒捻子素中剂量组(α-M-M group 10 mg/kg),α-倒捻子素高剂量组(α-M-H group 20 mg/kg)。每组大鼠均给药至术后14 d。
1.2.3神经行为学评分 各组大鼠于术后14 d进行Bederson′s评分:行为都正常记0分;提鼠尾离地约30 cm,手术对侧前肢内旋、内收记1分;推大鼠双肩,手术对侧抗力下降记2分;观察大鼠在水平面行走情况,围绕健侧转圈记3分;不能自主活动记4分。分数越高说明神经损伤越严重。
1.2.4脑组织存活神经元检测 术后14 d每组随机取6只大鼠处死,4%多聚甲醛灌注,再断头取脑并将脑组织浸于4%多聚甲醛中固定过夜,梯度蔗糖脱水过夜,再用OCT包埋剂包埋脑组织,-20℃冰冻30 min后,于冠状面将脑组织自前往后间隔2 mm切取6张连续的脑组织切片,再将脑组织切片放入5%牛血清白蛋白(BSA)和0.1% Triton X-100中室温孵育1 h。在一抗(MAP2,1∶500)中4℃孵育过夜,PBS清洗3次,每次5 min。再在二抗(Alexa Fluor 488,1∶500)中室温孵育1 h,PBS清洗后,细胞核用DAPI染色(1∶1 000),于荧光显微镜下观察,应用Image Pro Plus 6.0图像分析软件处理并作统计,计算每组大鼠脑组织切片中存活神经元的数量。
1.2.5脑组织氧化因子检测 术后14 d,取各组大鼠大脑皮层组织,制成10%的脑匀浆液。3 000 r/min离心10 min,取上清液并按各个试剂盒说明书中的操作说明检测脑组织SOD活性及MDA含量。
1.2.6ELISA检测脑组织中炎症因子含量 术后14 d,取各组大鼠大脑皮层组织,制成10%的脑匀浆液,3 000 r/min 4℃下离心10 min,收集上清液,ELISA试剂盒检测上清液中IL-1β、IL-6和肿瘤坏死因子(TNF)-α含量。使用酶标仪在450 nm下测定OD值。每组实验重复3次。
1.2.7Western blot检测脑组织中NF-κB信号通路相关蛋白及凋亡相关蛋白的表达 术后14 d,取各组大鼠大脑皮层组织,用冰的细胞裂解液充分裂解,10 000 r/min离心10 min,取上清进行BCA蛋白定量。取蛋白样品进行聚丙烯酰胺凝胶电泳和电转膜,90 V恒压模式电泳,220 mA电转90 min,5%脱脂奶粉封闭1 h后,使用抗磷酸化NF-κB(p-NF-κB)抗体(1∶1 000)、抗CyclinD1抗体(1∶1 000)、抗c-Myc抗体(1∶800)、抗GAPDH抗体(1∶5 000)4℃孵育过夜。PBS-Tween20液漂洗,HRP标记的二抗反应,再次用PBS-Tween20液洗膜,ECL显色,凝胶成像仪中曝光和拍照,检测脑组织中NF-κB信号通路相关蛋白的表达。按照上述方法检测凋亡基因蛋白Bax、Bcl-2、Cleaved caspase-3、Cleaved caspase-9的表达。灰度值用Image Pro Plus 6.0软件测定。每组实验重复3次。

2 结果
2.1各组大鼠神经行为学评分及脑组织神经元存活情况比较 除假手术组外,其余各组均表现出神经行为学损伤(P<0.05),其中,模型组神经行为学评分最高(P<0.05),α-倒捻子素高剂量组神经行为学评分明显低于α-倒捻子素低、中剂量组(P<0.05)。模型组脑组织存活的神经元数量最少且明显少于其余各组(P<0.05);α-倒捻子素高剂量组脑组织存活的神经元数量明显多于α-倒捻子素低、中剂量组(P<0.05),α-倒捻子素低剂量组与α-倒捻子素中剂量组的脑组织存活的神经元数量差异无统计学意义(P>0.05)。见图1、表1。

表1 各组大鼠神经行为学评分及神经元存活情况Tab.1 Neurobehavioral scores and neuronal survivals in each
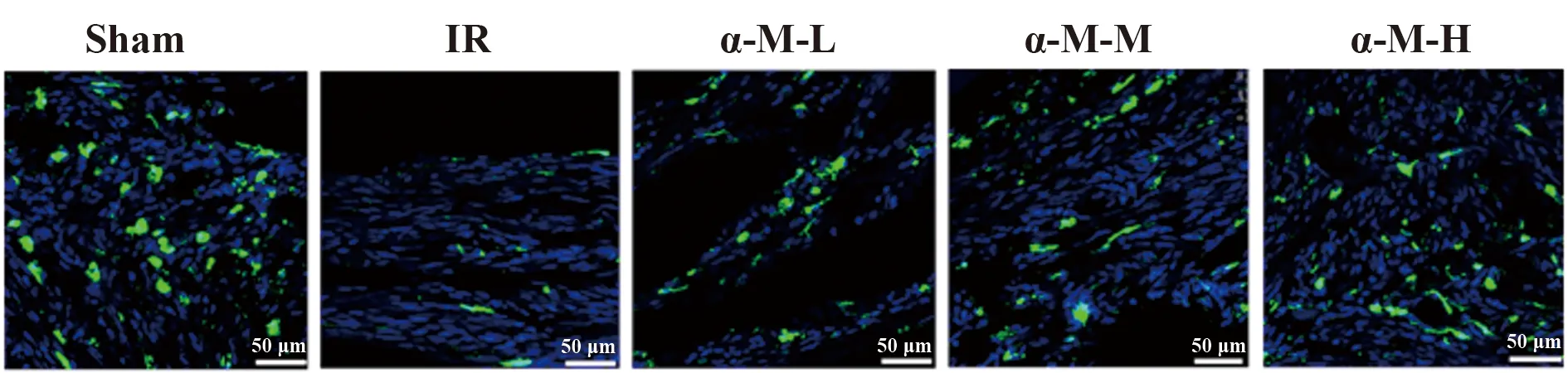
图1 各组大鼠脑组织神经元存活情况Fig.1 Neuronal survivals of brain tissues in each groupNote:Blue for DAPI,green for MAP2.
2.2各组大鼠脑组织中SOD活性及MDA含量的比较 与假手术组相比,其余各组SOD活性均降低(P<0.05),其中,模型组SOD活性明显低于α-倒捻子素低、中、高剂量组(P<0.05),α-倒捻子素高剂量组SOD活性明显高于α-倒捻子素低、中剂量组(P<0.05)。与假手术组相比,其余各组MDA含量均升高(P<0.05),其中,模型组MDA含量最高(P<0.05),α-倒捻子素低、中、高剂量组间MDA含量差异无统计学意义(P>0.05)。见表2。

表2 各组大鼠脑组织中SOD活性及MDA含量Tab.2 Activities of SOD and contents of MDA of brain tissues in each
2.3各组大鼠脑组织细胞中炎症因子含量的比较 与假手术组相比, 其余各组的炎症因子水平均升高(P<0.05),其中,模型组3种炎症因子的水平明显高于α-倒捻子素低、中、高剂量组(P<0.05);α-倒捻子素高剂量组IL-1β、IL-6的水平明显低于α-倒捻子素低、中剂量组(P<0.05);α-倒捻子素中、高剂量组TNF-α的水平明显低于α-倒捻子素低剂量组(P<0.05)。见表3。

表3 各组大鼠脑组织细胞中炎症因子含量Tab.3 Contents of inflammatory cytokines of brain tissuesin each
2.4各组大鼠脑组织中NF-κB信号通路相关蛋白表达量的比较 模型组3种NF-κB信号通路相关蛋白的表达量最高且明显高于其余组(P<0.05),α-倒捻子素低、中、高剂量组p-NF-κB蛋白的表达量差异无统计学意义(P>0.05);α-倒捻子素高剂量组CyclinD1、c-Myc蛋白的表达量明显低于α-倒捻子素低、中剂量组(P<0.05)。见图2、表4。

表4 各组大鼠脑组织细胞NF-κB信号通路相关蛋白的相对表达量Tab.4 Relative expressions of NF-κB signaling pathway-related proteins in each

图2 Western blot检测NF-κB信号通路相关蛋白的表达Fig.2 Western blot was used to detect expressions of NF-κB signaling pathway-related proteins
2.5各组大鼠脑组织中凋亡相关蛋白表达量的比较 模型组Bax、Cleaved caspase-3、Cleaved caspase-9的表达量最高且明显高于其余组(P<0.05),Bcl-2的表达量最低且明显低于其余组(P<0.05);α-倒捻子素高剂量组Bcl-2的表达量明显高于α-倒捻子素低、中剂量组(P<0.05);α-倒捻子素低、中、高剂量组间Bax,Cleaved caspase-3,Cleaved caspase-9的表达量差异无统计学意义(P>0.05),与假手术组相比均有明显差异(P<0.05)。见图3、表5。
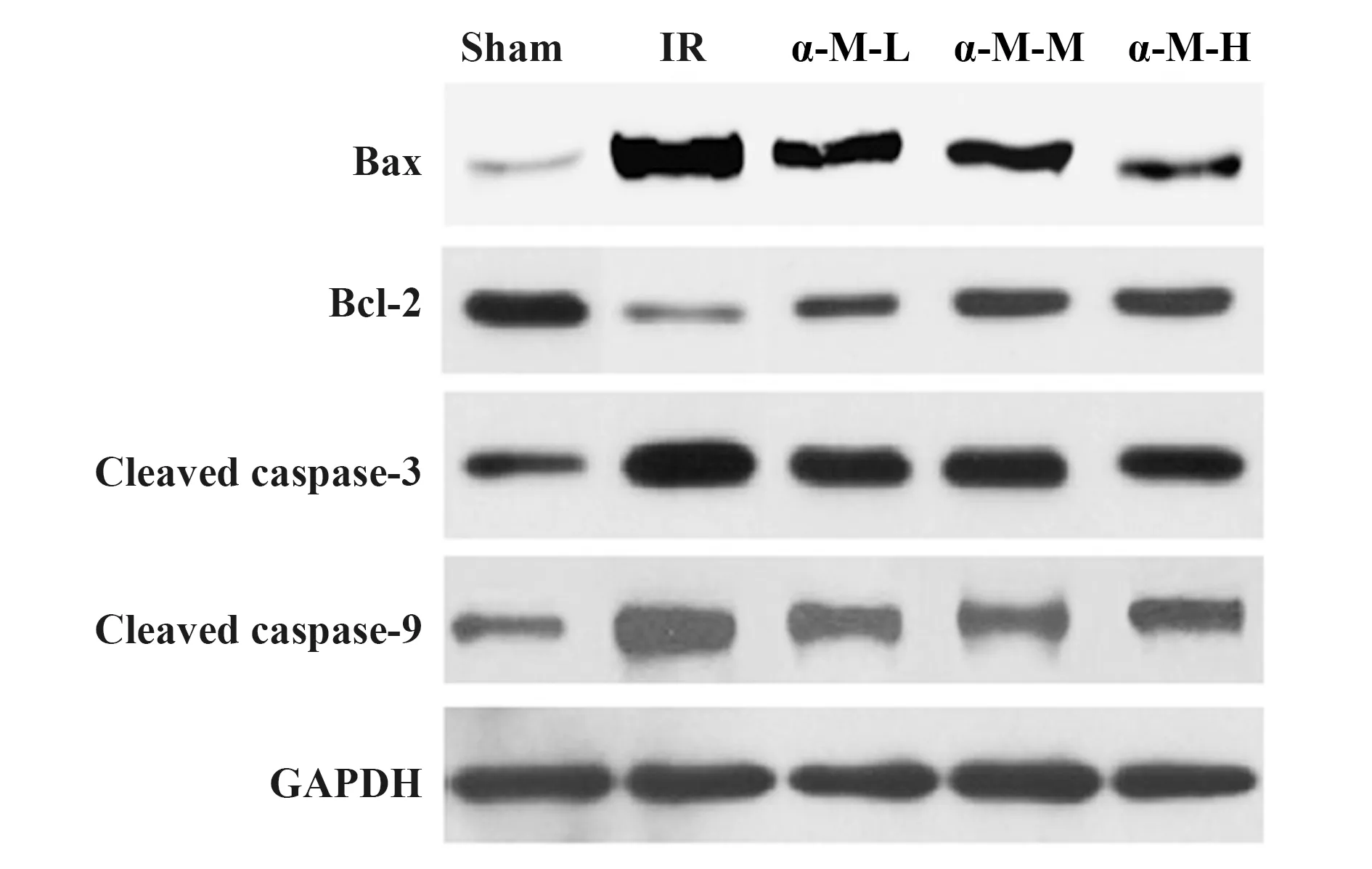
图3 Western blot检测凋亡相关蛋白的表达Fig.3 Western blot was used to detect expressions of apoptosis-related proteins

表5 各组大鼠脑组织细胞凋亡相关蛋白的相对表达量Tab.5 Relative expressions of apoptosis-related proteins in each
3 讨论
急性缺血性脑卒中发生时脑血流的中断可引起能量的大量消耗甚至导致神经元的死亡,当缺血脑组织再次血流灌注后,可导致再灌注损伤,涉及一系列病理生理过程[12]。脑IR损伤后,所产生的氧化应激反应会通过活性氧的直接损伤和间接损伤两种方式损伤神经元[13,14]。其中,活性氧可通过胞膜中脂质过氧化、酶被氧化失活、碱基被修饰等,直接导致细胞损伤[15,16]。还可通过激活线粒体介导的凋亡途径、改变NF-κB信号通路通等间接造成神经细胞损伤或凋亡[17,18]。α-倒捻子素作为一种植物提取物,可通过抗炎、抗氧化等作用保护组织细胞[9]。研究发现,α-倒捻子素可通过抑制TLR4/NF-κB信号通路缓解LPS诱导的细胞炎症[19]。史继德等[20]的研究表明了α-倒捻子素能够抑制炎症反应,抑制骨关节炎细胞的凋亡。
本次研究首先按照标准的方法建立了脑IR损伤模型,保证了实验干预因素的一致性,神经行为学评分可从功能角度反映脑IR损伤程度,结果表明α-倒捻子素可明显减轻脑IR损伤后神经行为学损伤程度,并且在本次实验中高剂量的α-倒捻子素表现出更好的疗效。脑IR损伤引起脑组织功能障碍的主要原因之一是损伤可引起大量神经元凋亡[21]。因此本研究对各组大鼠的脑组织进行了组织学观察,结果提示脑IR损伤大鼠脑组织的神经元会大量凋亡,而α-倒捻子素可有效促进神经元的存活,对神经元发挥保护作用。SOD广泛存在于人体,是脑组织中清除自由基的有效成分[22]。MDA是脂质过氧化的最终产物,可间接反映氧自由基的生成量和细胞损伤的程度[23]。进一步检测各组大鼠脑组织中SOD活性及MDA含量,结果表明α-倒捻子素可增强脑IR损伤后大鼠脑组织中SOD活性,同时降低MDA的水平,从而有效减轻氧自由基的破坏作用,保护脑神经细胞。
研究表明,脑IR损伤后,大量的活性氧自由基的产生还可进一步引发炎症反应,破坏血管壁,损伤血脑屏障,引起脑组织的继发性损伤[24]。本实验检测了各组大鼠脑组织细胞中炎症因子的水平,发现脑IR后可诱导脑组织中炎症因子的大量释放,而经过α-倒捻子素治疗后,炎症因子的水平会大幅下降,并且α-倒捻子素剂量越高,炎症因子水平越低,说明α-倒捻子素能有效抑制脑IR损伤引起的炎症反应。Franceschelli等[9]的研究表明α-倒捻子素能降低磷脂酰肌醇-3激酶(PI3K)的活性,抑制蛋白激酶Akt的磷酸化,影响NF-κB信号通路的研究结论。如上述,本研究已明确α-倒捻子素可对大鼠脑IR损伤起到保护作用,为进一步探索α-倒捻子素在发挥保护作用过程中的具体机制,对各组大鼠脑组织中NF-κB信号通路相关蛋白表达量进行了测定,结果提示了α-倒捻子素能有效抑制NF-κB信号通路的激活,并且α-倒捻子素的剂量越高,NF-κB信号通路相关蛋白的表达量越低,对NF-κB信号通路激活的抑制进而发挥了抗炎作用。为探究α-倒捻子素是否抑制了细胞凋亡效应及其可能的机制,检测了各组大鼠脑组织中凋亡相关蛋白的表达情况。Bcl-2基因是一种癌基因,具有抑制凋亡的作用,Bcl-2的过度表达能增强所观察细胞对大多数细胞毒素的抵抗性[25]。Bax、Cleaved caspase-3、Cleaved caspase-9是3种与细胞凋亡密切相关的基因,其表达水平的升高会诱导细胞趋向于凋亡甚至加快细胞凋亡[26]。研究发现Bcl-2的表达升高与Bax、Cleaved caspase-3、Cleaved caspase-9表达升高分别与线粒体相关的凋亡信号通路的抑制和激活相关[27]。本研究结果表明α-倒捻子素在降低炎症水平、促进神经元存活同时抑制了细胞凋亡效应并且其抑制凋亡效应可能与线粒体凋亡信号通路的失活有关。
综上所述,α-倒捻子素对大鼠脑IR损伤具有保护作用,其作用机制可能与抗氧化、降低损伤后炎症反应、抑制NF-κB信号通路的激活、抑制线粒体凋亡信号通路介导的细胞凋亡效应有关。