皱纹盘鲍(Haliotis discus hannai Ino)肌肉酶解产物制备及其免疫活性研究
任鼎鼎,黄梦怡,郑惠娜,2,3,4*,曹文红,2,3,4,林海生,2,3,4,秦小明,2,3,4,章超桦,2,3,4
1(广东海洋大学 食品科技学院,广东 湛江,524088)2(广东海洋大学 深圳研究院,广东 深圳,518108)3(国家贝类加工技术研发分中心(湛江),广东省水产品加工与安全重点实验室,广东省海洋生物制品工程实验室,广东 湛江,524088)4(海洋食品精深加工关键技术省部共建协同创新中心(大连工业大学),辽宁 大连,116034)
皱纹盘鲍(HaliotisdiscushannaiIno),又称“腹鱼”,属于软体动物门的单壳贝类[1]。2018年中国的鲍鱼养殖产量为163 169 t,比2017年增长9.85%,主要分布在广东、福建、山东等地区[2-3]。鲍鱼肉质鲜美,蛋白质含量高,氨基酸和维生素种类齐全,具有丰富的营养价值和药用价值[4-5]。然而,目前除部分鲜销外,多数以干制品及罐头制品等粗加工产品为主[6-7],高附加值、精深加工制品较少,缺乏相关的理论基础和数据支撑。
生物酶解法是提高蛋白质高值化利用的重要手段。目前,国内外利用生物酶解法制备具有各种生物活性的酶解产物的相关研究很多。如张帅等[8]采用碱性蛋白酶和中性蛋白酶水解的河蚬肉酶解产物对乙醇脱氢酶具有激活作用,可延长小鼠的醉酒时间以及缩短醒酒时间,由此得出河蚬水解蛋白肽具有解酒护肝的功效。LEE等[9]采用碱性蛋白酶、胃蛋白酶、木瓜蛋白酶等对金枪鱼进行水解,并分离鉴定出具有较高抑制血管紧张素转化酶活性的多肽。JANG等[10]采用碱性蛋白酶进行水解,并用超滤、高效液相色谱以及反相高效液相色谱进行分离纯化,得到抗氧化肽,且质量浓度为1 mg/mL时,1,1-二苯基-2-三硝基苯肼自由基清除率达到90%。LI等[11]从牡蛎酶解液中分离纯化得到具有免疫调节的短肽,能够促进巨噬细胞的增殖和吞噬能力,诱导NO、肿瘤坏死因子α、白细胞介素-6的产生。因此,以海洋蛋白资源为底物,利用生物酶解技术开发具有各种生物活性功能的多肽制品对促进海洋蛋白资源高值化利用具有重要的意义。目前,鲍鱼肌肉酶解产物相关研究主要集中在抗氧化[12]、抗肿瘤[13]等生物活性方面,鲍鱼肌肉免疫活性的研究未见报道。
生物活性肽免疫活性的评价主要通过动物模型来实现,目前以小鼠、大鼠等哺乳动物较为广泛[14-15],但存在用量大、价格高等缺陷。斑马鱼作为一种新型的动物模型,具有体积小、易生长、用量小等优势[16],已经广泛应用在癌症[17]、神经疾病[18]、代谢疾病[19]、免疫活性[20]等方面。
本文采用动物蛋白酶和风味蛋白酶为水解酶,以皱纹盘鲍肌肉为原料,优选最佳酶解时间,进一步采用斑马鱼动物实验模型,探讨鲍鱼肌肉酶解产物以及超滤组分对斑马鱼免疫活性的影响,为开发鲍鱼生物功能制品提供理论基础。
1 材料与方法
1.1 材料与仪器
皱纹盘鲍(HaliotisdiscushannaiIno)11~12月购买于湛江市霞山区东风批发市场,规格70 g左右;斑马鱼(35 日龄),上海佳誉水族馆;动物蛋白酶(9.8×104U/g)、风味蛋白酶(6.8×104U/g),食品级,广西南宁庞博生物工程有限公司;斑马鱼溶菌酶(lysozyme, LYS)Elisa试剂盒、斑马鱼碱性磷酸酶(alkaline phosphatase, ALP)Elisa试剂盒、斑马鱼免疫球蛋白G(immunoglobulin G, IgG)Elisa试剂盒,江苏酶免实业有限公司;BCA蛋白浓度测定试剂盒,南京诺唯赞生物科技有限公司等;
LPG-5高速离心喷雾干燥机,常州苏正干燥设备有限公司;DW-86L338 J超低温冰箱,青岛海尔特种仪器有限公司;DHG-9240A电热鼓风干燥箱,上海一恒科学仪器有限公司;电子调温万用炉(一联),北京市永光明医疗仪器有限公司;UV-2550紫外分光光度计,日本岛津公司;3-550PD马弗炉,美国VULCAN公司;K-424凯氏定氮消化炉,瑞士Buchi公司;B324凯氏定氮蒸馏器,瑞士Buchi公司;GR22GII高速冷冻离心机,日立工机株式公社;Mini Pellicon超滤系统,Merck Millipore 有限公司等。
1.2 实验方法
1.2.1 样品预处理
将新鲜鲍鱼去除壳和内脏,采用质量浓度120 g/L NaCl溶液搅拌清洗20 min,去除表面黑渍后,每袋500 g贮存于-20 ℃,备用。
1.2.2 鲍鱼酶解工艺优化
根据参考文献[21]稍作修改。将新鲜鲍鱼肌肉洗净沥干,分别称取5份(每份1 kg)于锥形瓶,按质量浓度0.333 g/L加入提前预冷的蒸馏水,自然条件(pH 6.8)下按原料质量的0.3%分别加入动物蛋白酶和风味蛋白酶,于53 ℃恒温摇床中分别酶解1、2、3、4和5 h(每隔1 h取出1份),100 ℃中灭酶10 min,迅速冷却后,于4 ℃,6 000 r/min离心20 min去除杂质,收集上清液后继续于4 ℃,4 000 r/min离心20 min去除部分油脂,然后各取50 mL酶解液进行水解度(degree of hydrolysis,DH)和蛋白回收率的测定,确定最佳酶解时间。将酶解1、2、3、4和5 h后剩余的鲍鱼酶解液(abalone enzymatic hydrolysis of peptides,AHP)进行喷雾干燥,以鲍鱼酶解粉1(AHP-1)、鲍鱼酶解粉2(AHP-2)、鲍鱼酶解粉3(AHP-3)、鲍鱼酶解粉4(AHP-4)和鲍鱼酶解粉5(AHP-5)为样品保存备用。
1.2.3 不同干燥方式酶解产物的制备
在最佳酶解时间下按上述操作制备冷冻干燥鲍鱼多肽(FD-AHP)样品和喷雾干燥鲍鱼多肽(SD-AHP)样品;同时将酶解液超滤,得到>10 kDa、5 k~10 kDa、<5 kDa组分,-45 ℃下冷冻干燥后备用。
1.2.4 一般营养成分分析
水分测定用直接干燥法(GB 5009.3—2016)[22];脂肪测定用索氏抽提法(GB 5009.6—2016)[23];灰分测定用高温灼烧法(GB 5009.4—2016)[24];总糖测定用硫酸-苯酚法(GB/T 9695.31—2008)[25];蛋白质测定用凯氏定氮法(GB 5009.5—2016)[26]。
1.2.5 蛋白回收率和DH测定
采用凯氏定氮法[26]测定AHP上清液和原料中的蛋白含量,按公式(1)计算蛋白回收率:

(1)
采用凯氏定氮法测定总氮及非蛋白氮含量[26],甲醛滴定法测定α-氨基态氮[27],按公式(2)计算DH:
(2)
式中:w1,酶解液中的α-氨基态氮质量分数,%;w2,原料中的α-氨基态氮质量分数,%;w3,总氮质量分数,%;w4,非蛋白氮质量分数,%。
1.2.6 斑马鱼模型建立
健康的35日龄斑马鱼,共684条,平均体质量(45±5) mg,体长1.5~2 cm,共19组(每组12 条,3次平行)。实验中用空气石进行恒定通气,温度为(25.2±0.8) ℃,pH为(7.6±0.3),溶解氧范围为(7.22±0.19) mg/L。前14 d的适应期用空白组(NC)喂养,一日2次喂鱼,每日所需量按每箱鱼的总质量的15 g/kg进行换算,每隔2周进行1次称重,持续8周[28]。将FD-AHP、SD-AHP、>10 kDa、5 k~10 kDa、<5 kDa组分分别以质量分数为1%、2%和3%喷洒在饲料上,将其充分混匀制备饲料[29],同时用盐酸左旋咪挫为阳性组(PC)作对照实验。
1.2.7 免疫活性相关指标测定
1.2.7.1 鱼匀浆液的制备
实验周期结束后,将斑马鱼捞出置于冰块中致晕,除去头部和鳍。取1 g样品加9 mL 0.01 mol/L Tris-HCl缓冲液(pH 7.2),用手动匀浆器充分匀浆。悬浮液于4 ℃下4 000 r/min离心15 min,收集上清液进行LYS活性、ALP活性以及IgG含量等指标的测定[30]。
1.2.7.2 LYS活性测定
根据LYS Elisa试剂盒操在450 nm处测定标准曲线及样品活性;其中标准曲线回归方程为y=0.006 7x+0.050 1,R2=0.998 1。
1.2.7.3 ALP活性测定
根据ALP Elisa试剂盒在450 nm处测定标准曲线及样品活性;其中标准曲线回归方程为y=0.009x+0.007 1,R2=0.998 1。
1.2.7.4 IgG含量测定
根据IgG Elisa试剂盒说明,在450 nm处测定标准曲线及样品活性,其中标准曲线回归方程为y=0.044 8x+0.049 1,R2=0.999 6;用BCA法测定总蛋白浓度,其中标准曲线回归方程为y=0.044 8x+0.049 1,R2=0.999 6,根据试剂盒样品的说明,测定后按公式(3)计算IgG含量:
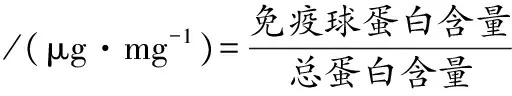
(3)
1.2.8 数据处理
2 结果与分析
2.1 不同酶解时间制备的酶解产物基本营养成分分析
为确定最佳酶解时间,本研究分析了不同酶解时间制备的酶解产物基本营养成分,结果见表1。以干基计,鲍鱼酶解产物的蛋白质含量均较高,最高可达(88.92±2.10)%;脂肪含量较低,最高仅达到(0.13±0.01)%;总糖含量最高达到(17.46±0.88)%。鲍鱼酶解产物的蛋白含量均高于河蚬[8]、牡蛎[21]等。由此可以看出,鲍鱼酶解产物是一种高蛋白的优质海洋食品。同时,不同酶解时间的酶解产物营养成分差异性不显著。

表1 新鲜鲍鱼、酶解产物基本营养成分组成比较 单位:%
2.2 酶解时间对酶解产物DH及蛋白回收率的影响
不同酶解时间的DH及蛋白回收率见图1。随着酶解时间的增加,DH及蛋白回收率呈不断增加的趋势,在1~4 h内,DH及蛋白回收率增长较快;而酶解4 h后增长较缓,5 h的酶解产物与4 h酶解产物的DH和蛋白回收率均无显著性差异(P>0.05), 此结果与张华丹等[31]研究结果一致。可能是因为酶解4 h之内,底物与酶的质量浓度较高,接触面积较大,酶解速率较高,随着时间的增加,肽被酶解成更小的氨基酸导致短肽含量减少,同时酶活力下降,蛋白回收率增长缓慢[32]。因此,从生产经济成本考虑选择鲍鱼酶解产物的最佳酶解时间为4 h。
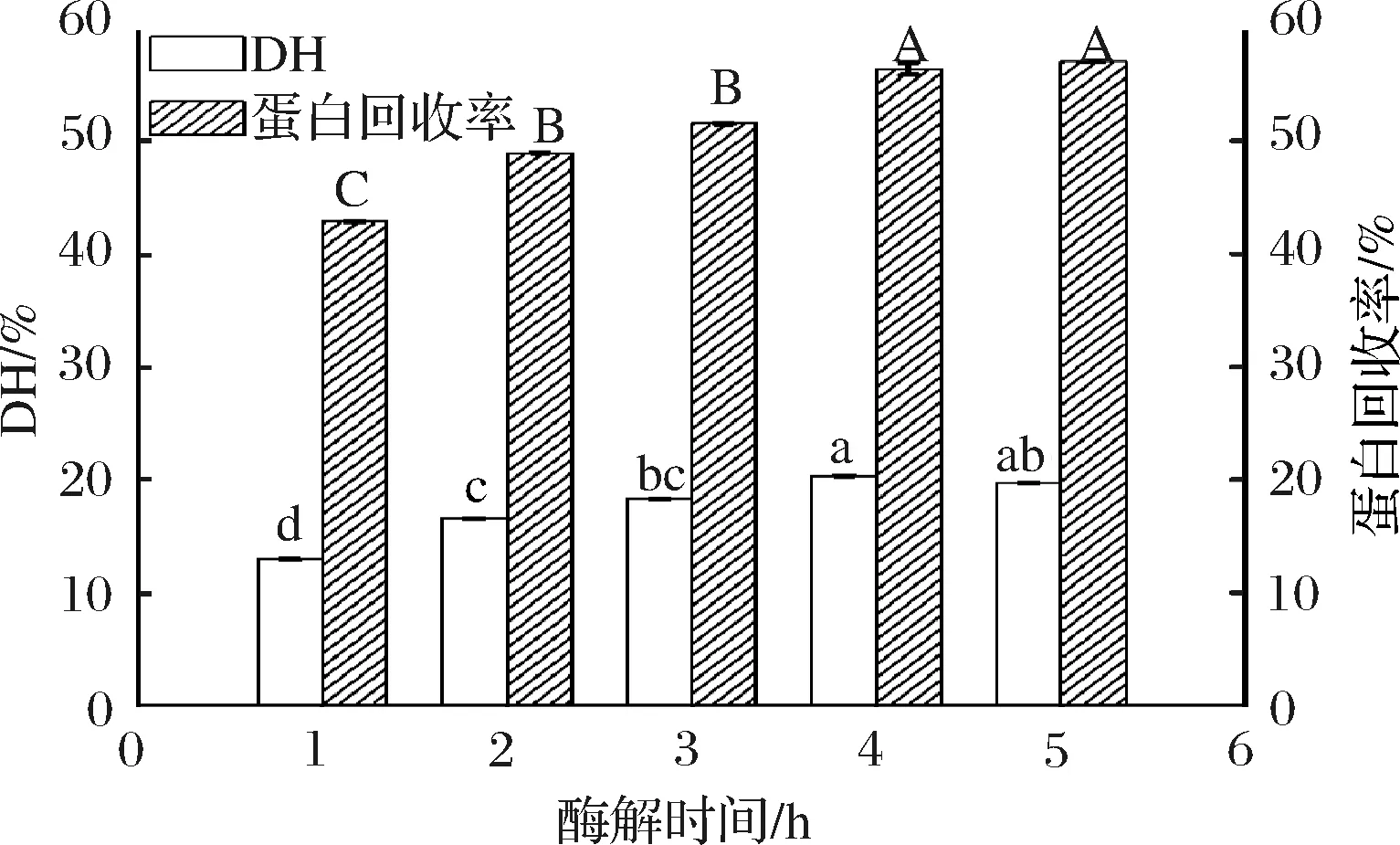
图1 不同时间酶解产物的DH及蛋白回收率比较Fig.1 Comparison of DH and protein recovery of enzymatic hydrolysis products at different hydrolyzing times注:不同字母表示样品之间有显著性差异(P<0.05)(下同)
2.3 鲍鱼酶解产物免疫活性
2.3.1 鲍鱼酶解产物及超滤组分对LYS活性的影响
LYS是一种富含宿主血清的抗菌酶,其活性是体液免疫和先天免疫系统的重要组成部分,可以在机体内催化水解细菌细胞壁溶解死亡,增强巨噬细胞的吞噬功能和消化能力,从而起到免疫防御的作用[33]。图2-a显示,在不同干燥方式的酶解产物中,各处理组的LYS活性均高于NC组。同时发现喂养FD-AHP组的LYS活性较强,且FD-AHP 1%的效果最好,达到(166.04±23.48)U/L,与NC、PC相比,具有显著性差异(P<0.05);同时将FD-AHP 1%与NC、PC组对比发现,均具有极显著差异(P<0.01)。而喂养SD-AHP组的LYS活性低于FD-AHP组,最低为(113.62±30.48)U/L,可能是由于温度过高,在一定程度上造成了活性成分的损失,而冷冻干燥温度较低,保护了营养成分。在FD-AHP 1%、2%、3%中喂养1% FD-AHP组的LYS活性较强,明显高于2%和3%组可能是因为剂量提高对斑马鱼蛋白消化利用率降低有关[34]。
图2-b显示,在超滤组分中,喂养<5 kDa组的LYS活性较强,但各剂量之间没有显著性差异(P>0.05)。研究结果显示喂养<5 kDa 2%组的LYS活性最高,达到(1 481.29±160.70)U/L,将喂养<5 kDa 2%组与NC、PC组两两对比,均具有极显著差异(P<0.01),说明在各处理组中,喂养<5 kDa的斑马鱼的LYS活性最强,可能是因为<5 kDa酶解超滤产物含有更多增强LYS活性的营养物质[35],同时有研究发现一定程度的营养物质(如蛋氨酸等)可以显著提高LYS活性[36]。由此可以看出,鲍鱼酶解产物可提高斑马鱼LYS活性,且冷冻干燥组分以及<5kDa超滤组分活性更强。然而,相关研究表明,多糖饲养后在一定程度上也能提高鱼类的LYS活性[37],样品中有效组分相关作用有待进一步研究。
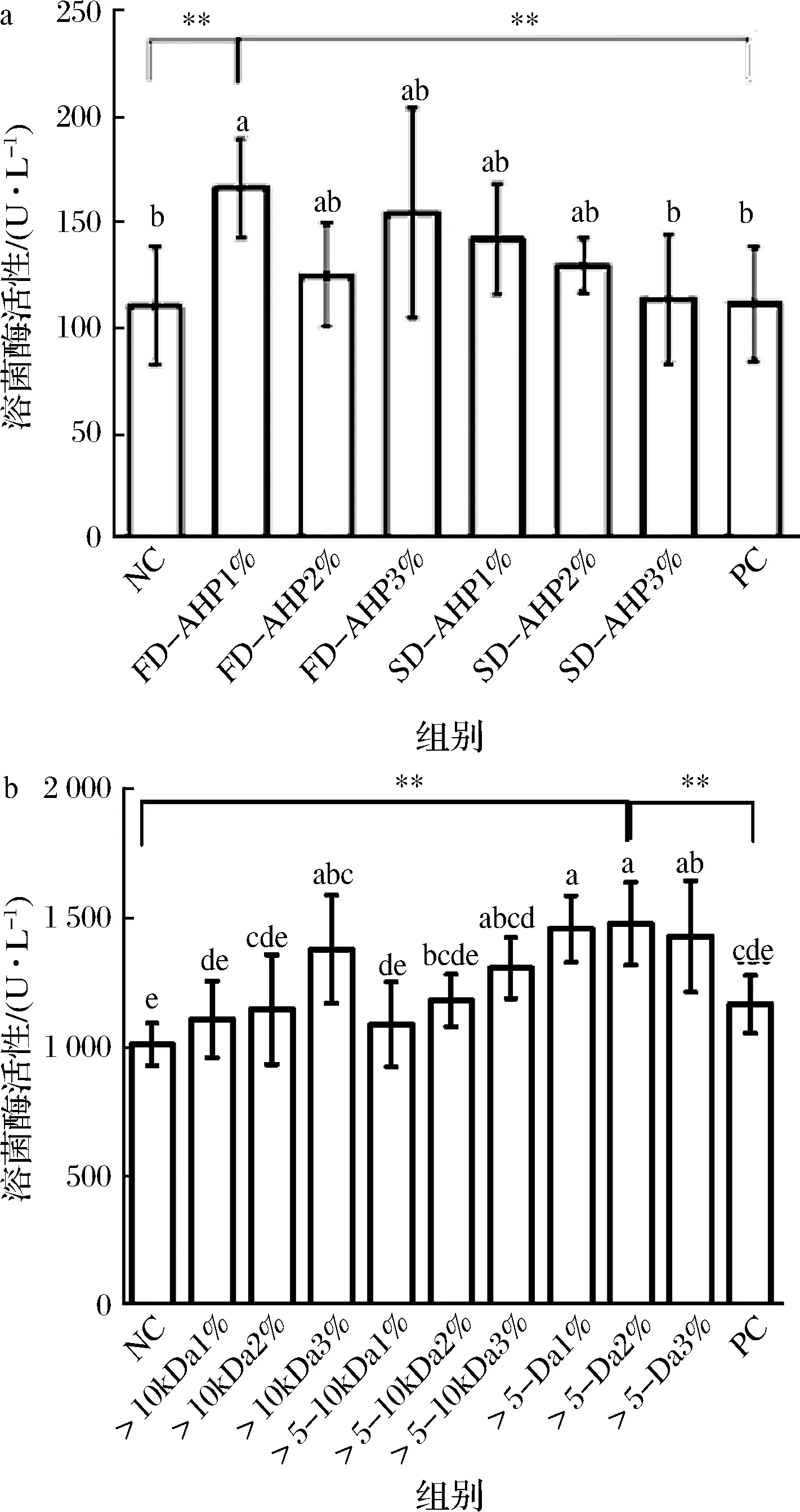
a-干燥方式;b-超滤组分图2 鲍鱼酶解产物干燥方式及超滤组分对LYS活性的影响Fig.2 Effect of drying mode and ultrafiltration component of abalone on LYS activity注: FD-AHP1%冷冻干燥酶解产物剂量为1%,FD-AHP 2%冷冻干燥酶解产物剂量为2%;FD-AHP 3%冷冻干燥酶解组分剂量为3%;SD-AHP 1%喷雾干燥酶解产物剂量为1%;SD-AHP 2%喷雾干燥酶解产物剂量为2%;SD-AHP 3%喷雾干燥酶解产物剂量为3%。*表示两两对比的显著性差异(P<0.05);**表示两两对比的极显著差异(P<0.01)(图3~4同)
2.3.2 鲍鱼酶解产物及超滤组分对ALP活性的影响
ALP是生物体内一种重要的磷酸单脂酶,可催化磷酸基团的转移反应,参与蛋白质的合成,同时因其水解活性而具有抗菌性能,可以改善免疫功能,在免疫反应中发挥着重要的作用[38]。图3-a显示,各处理组均能提高斑马鱼的ALP活性;但喂养FD-AHP组的ALP活性较强,且喂养1% FD-AHP组的ALP活性最高,达到(7.46±1.02)IU/L;同时将喂养FD-AHP 1%组与NC、PC组比较发现,均具有极显著性差异(P<0.01)。这进一步说明,冷冻干燥能够更好地保留样品的活性避免由于高温而造成活性丧失[39]。
图3-b显示,在不同超滤组分中,喂养<5 kDa样品组的ALP活性整体较好,且喂养<5 kDa 2%样品组的ALP活性最高,达到(1 617.39±206.70I)U/L;将喂养<5 kDa 2%样品组与NC、PC组进行比较,均具有极显著差异(P<0.01)。可能是因为<5 kDa超滤组分的相对分子质量较小,更有利于斑马鱼的消化吸收[40],同时<5 kDa超滤组分具有提高ALP活性的成分,可能与一些微量元素有关[41]。相关研究表明,多糖饲养后有提高血清中碱性磷酸酶活性以及上调免疫因子的作用[42]。数据表明,鲍鱼酶解产物可以提高斑马鱼ALP活性,同时可以看出冷冻干燥组分以及<5 kDa超滤组分活性较好。
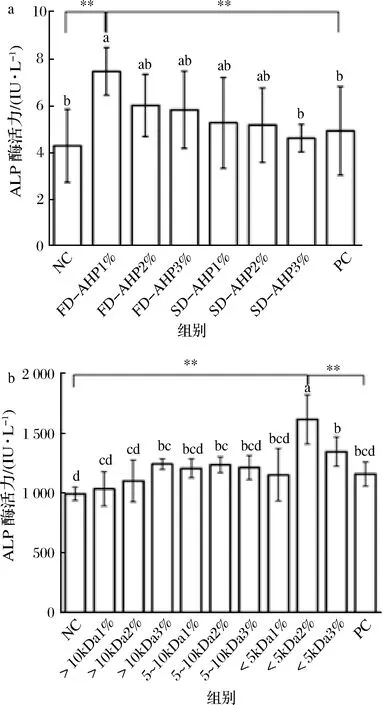
a-干燥方式;b-超滤组分图3 鲍鱼酶解产物干燥方式及超滤组分对ALP活性的影响Fig.3 Effect of drying mode and ultrafiltration component of abalone on ALP activity
2.3.3 鲍鱼酶解产物及超滤组分对IgG含量的影响
IgG是一类重要的免疫效应因子,主要存在于血液和组织分泌液中,可以中和毒素并阻止病原体的侵入,减少病毒对机体的伤害,还可以形成免疫系统从而提高免疫力[43]。图4-a显示,IgG含量不具有规律性,除喂养3%FD-AHP样品组的IgG含量较低[(0.17±0.02)μg/mg],其余组分均可以提高IgG含量。喂养1% FD-AHP组分达到最大值,为(0.31±0.09)μg/mg;而将1%FD-AHP组与NC组对比发现,具有显著性差异(P<0.05),而与PC组对比发现,不具有显著性差异(P>0.05)。同时,冷冻干燥样品组随着剂量的提高,IgG含量逐渐下降,这可能与斑马鱼自身的生理功能以及对营养物质的消化利用率有关,蛋白含量的增加造成斑马鱼消化负担过重,未能充分消化利用[44]。而在SD-AHP组分中随着剂量的增加,IgG含量先降低后升高,3%剂量效果最好,达到(0.31±0.04)μg/mg。可能是因为IgG主要分布在血清和组织中,鲍鱼酶解产物刺激机体产生免疫反应,从而分泌免疫球蛋白;而喷雾干燥较冷冻干燥具有良好的溶解性,斑马鱼在水体环境中通过组织吸收一部分,从而影响斑马鱼的免疫系统,因此喷雾干燥较冷冻干燥更易增加IgG含量[45]。
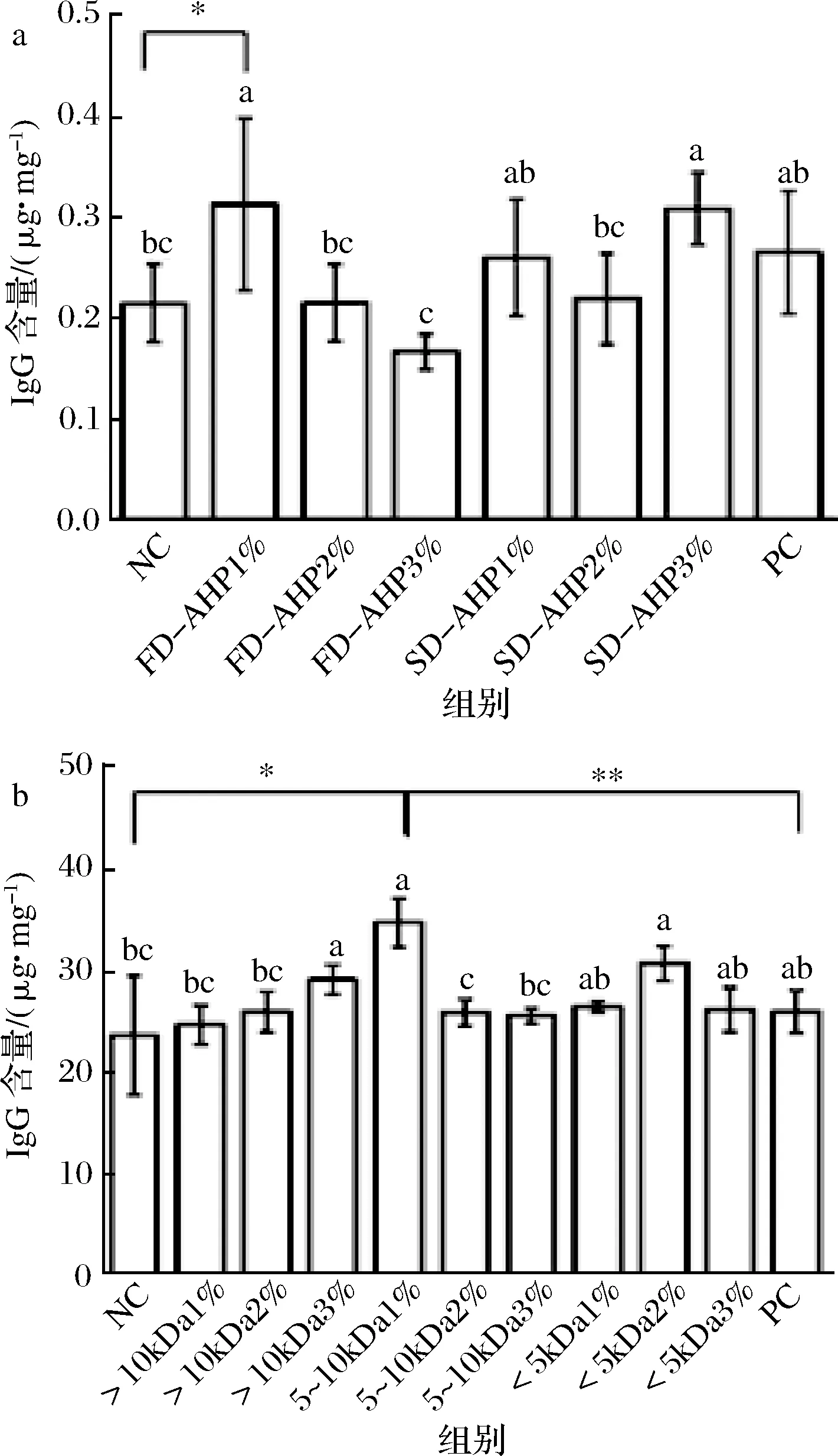
a-干燥方式;b-超滤组分图4 鲍鱼酶解产物干燥方式及超滤组分对IgG含量的影响Fig.4 Effect of drying mode and ultrafiltration component of abalone on IgG concentration
图4-b显示,在超滤组分中,喂养>10 kDa 3%、5 k~10 kDa 1%和<5 kDa 2%组分与NC相比,具有显著性差异(P<0.05),但3者之间并没有显著性差异(P>0.05),且喂养5 k~10 kDa 1%样品组的IgG含量最高,达到(34.77±2.40)μg/mg,同时与NC组进行比较,具有显著性差异(P<0.05);与PC组对比发现,具有极显著差异(P<0.01);这可能是5 k~10 kDa组分中含有较多能提高IgG免疫的活性物质,而剂量的提高反而导致IgG含量下降,这可能与斑马鱼对鲍鱼蛋白的消化吸收利用率有关,也可能与鱼自身的性质、生理功能和肠道功能等多种因素有关[46]。然而,从研究结果可以看出,斑马鱼IgG含量变化与样品剂量关系不明显,这有待进一步研究。
3 结论
研究结果表明,无论是冷冻干燥还是喷雾干燥制备的AHP均可以提高斑马鱼的免疫活性。与喷雾干燥制备的AHP对比,采用冷冻干燥方式制备的AHP免疫活性较强。在各超滤组分中,<5 kDa超滤组分的免疫活性较强,研究结果为AHP开发生物功能营养健康食品提供参考数据。

