高危急性淋巴细胞白血病患儿预后危险因素分析
吴泽霖,卫凤桂,邹亚伟,关镜明,梁铭,卢婕伦,陈德晖,陈福雄,吴梓梁 广州医科大学附属第一医院,广州510120
急性淋巴细胞白血病(ALL)是儿童最常见的恶性肿瘤之一,随着治疗方案的逐步改良和完善,ALL患儿的预后得到很大改善,但仍有少数患儿预后不良,复发及治疗相关死亡是治疗失败的主要原因[1]。对于具有一项或多项高危因素的高危或超高危ALL患儿,其复发风险及治疗难度更高,是临床上面临的重大挑战。本研究回顾性分析符合现行高危标准的37例高危ALL患儿的临床资料,并探讨影响患儿预后的相关因素。现报告如下。
1 资料与方法
1.1 临床资料 选择2005年2月~2015年6月广州医科大学附属第一医院儿科血液肿瘤专科收治的高危ALL患儿37例,均符合现行的高危ALL诊断标准[2, 3]。37例患儿中,男25例、女12例;年龄≥10岁9例,<10岁28例;MICM免疫分型:B-ALL型23例,T-ALL型14例;不良细胞遗传学改变阳性13例、阴性24例,阳性患儿中BCR/ABL(Ph+)阳性5例(T-ALL型2例、B-ALL型3例),MLL基因重排8例(T-ALL型7例、B-ALL型1例);初诊白细胞(WBC)计数≥100×109/L 18例,<100×109/L 19例;泼尼松试验反应良好17例,泼尼松试验反应不良20例;患儿入院后采用以ALL IC-BFM 2002方案[3]为基础的改良方案进行诱导治疗,治疗第33天微小残留病变(MRD)阳性(≥1×10-3)9例,MRD阴性(<1×10-3)28例。本研究通过医院伦理委员会审核,患儿监护人均签署知情同意书。
1.2 预后随访方法 通过住院、门诊、电话及微信方式进行随访,随访截止时间是2018年12月,采用寿命表估算5年无事件生存率(EFS)。
1.3 统计学方法 采用SPSS22.0统计软件。不同性别、年龄、MICM免疫分型、不良细胞遗传学改变、初诊WBC计数、泼尼松试验反应、治疗第33天MRD水平患儿的5年EFS比较采用Log-Rank检验,对有意义的因素进行COX多因素回归风险模型分析。P<0.05为差异有统计学意义。
2 结果
37例患儿5年EFS为49.5%。Log-Rank检验结果显示,不良细胞遗传学改变阳性、泼尼松试验反应不良、治疗第33天MRD阳性的高危ALL患儿5年EFS低于不良细胞遗传学改变阴性、泼尼松试验反应良好、治疗第33天MRD阴性者(P均<0.05)。不同性别、年龄、MICM免疫分型、初诊WBC计数的高危ALL患儿5年EFS比较均无统计学差异(P均>0.05)。COX多因素分析结果显示,不良细胞遗传学改变阳性、治疗第33天MRD阳性是高危ALL患儿5年EFS降低的危险因素(P均<0.05)。见表1、表2。
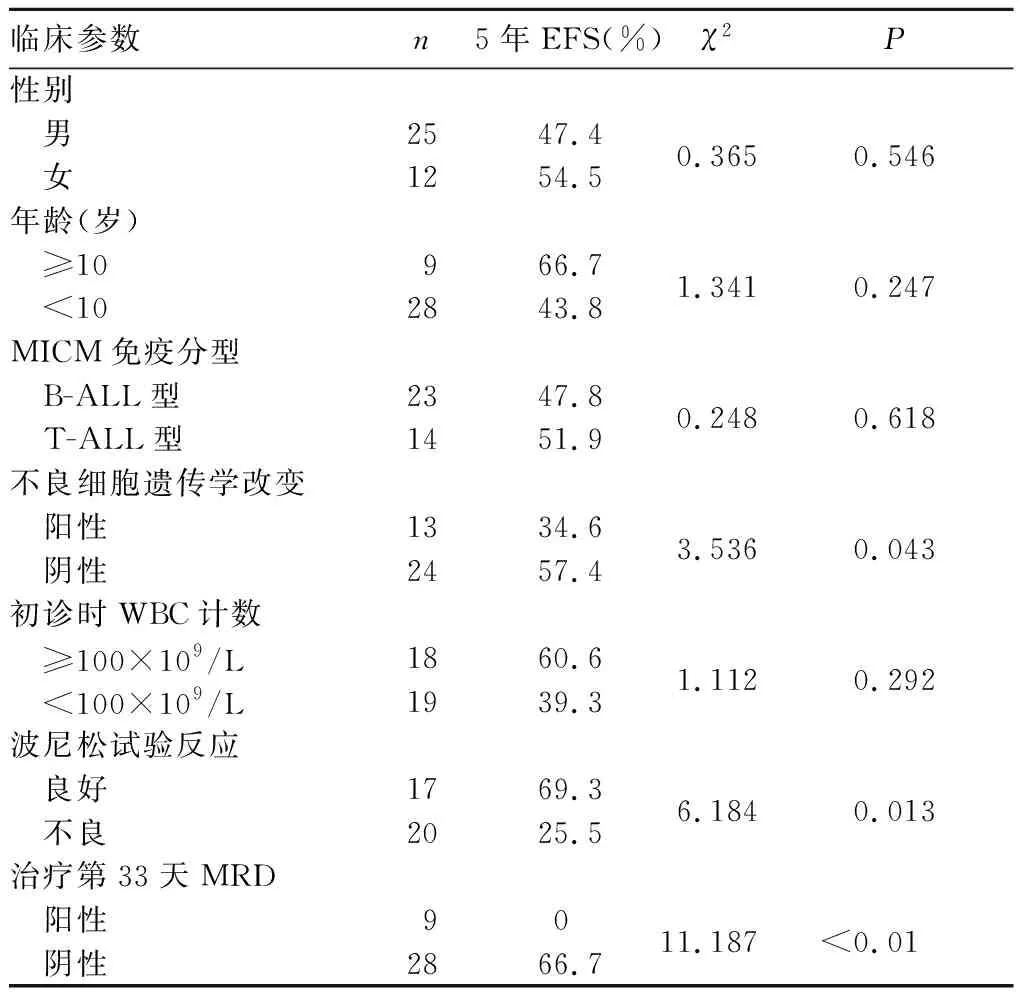
表1 高危ALL患儿不同临床参数间5年EFS比较

表2 影响高危ALL患儿5年EFS的COX多因素分析结果
3 讨论
儿童ALL目前主要的治疗手段仍为化疗,随着化疗方案的不断完善及支持治疗的进步,标危ALL患儿的5年EFS可达到90%[2, 3]。部分高危、难治或复发患儿需要结合造血干细胞移植、嵌合抗原受体T细胞免疫疗法(CAR-T)或者靶向药物治疗。但相关研究显示,高危ALL患儿的5年EFS仅为46%~76%,远远低于普通ALL患儿的5年EFS(90%)[4]。随着治疗技术的发展,发病年龄、初诊时WBC计数、T细胞、髓外白血病这些曾经列为高危的因素目前已调整为中危的标准。早期治疗反应不佳、不良的白血病细胞生物学特性(包括BCR/ABL、MLL基因重排等不良的细胞遗传学改变、原发耐药)仍是影响高危ALL患儿预后的相关因素[2, 3]。
虽然初始治疗反应的相关分子机制仍未明了,但泼尼松试验及MRD检测对高危ALL患儿的预后预判及调整个体化治疗策略均具有重要意义[5]。泼尼松试验能提示白血病细胞内在耐药性,是较早用来判断治疗反应的方法之一,试验反应良好是早期治疗反应好的指标之一,提示预后好,反应不良提示预后不佳。Schrappe等[6]研究表明,泼尼松试验反应不良的ALL患者6年ESF只有34%,而泼尼松试验反应良好者6年ESF达82%。如果患者初始白血病细胞负荷过高,使用皮质激素7 d后原幼淋巴细胞也难以降至1×109/L,从而影响敏感性的判断,这是泼尼松试验的局限性。本研究泼尼松试验反应不良20例,其5年EFS仅为25.5%;泼尼松试验反应良好17例,其5年EFS为69.3%。本研究泼尼松试验反应不良并不是患儿预后不佳的危险因素之一,分析原因可能与部分泼尼松试验反应不良患儿诱导治疗第33天的MRD为阴性(提示其对药物敏感)有关。因此,在对高危ALL患儿进行预后评估时要结合泼尼松试验结果和诱导治疗第33天的骨髓形态学缓解状态及MRD检查结果[5]。
MRD监测贯穿ALL治疗全过程,与患儿复发密切相关,是判断预后的重要因素。研究显示,诱导缓解治疗后MRD阳性的ALL患儿存在极大复发风险,预后较差[5, 7]。本研究结果显示,治疗第33天MRD阳性是高危ALL患儿预后不良的危险因素之一。在巩固期及维持期,MRD监测同样重要,部分标危患儿在治疗过程中MRD持续阳性,存在复发风险,需重新划分为高危;或者部分高危患者MRD监测阴性转阳性或者持续阳性,为超高危,需加强化疗强度或者改变治疗策略,包括联合CAR-T、选择新药、异基因造血干细胞移植等[8]。
染色体结构畸变以及融合基因是ALL的生理学特征,Ph+、MLL基因重排等不良细胞遗传学改变的ALL患儿复发率高、预后不良,危险度分型直接归入高危组[9~12]。ALL患儿中Ph+发生率接近5%,并随年龄递增上升至15%~30%[12]。仅常规化疗的Ph+ALL患儿很少转阴,平均生存期仅12个月[13, 14],而加用络氨酸激酶抑制剂后患儿预后得到改善[12, 14]。文献报道,强化疗联合酪氨酸酶抑制剂伊马替尼可明显提高Ph+ALL患儿的3年ESF,而骨髓移植联合伊马替尼的安全性及有效性均无明显优势[15]。本组资料5例Ph+患儿中1例男性患儿为T-ALL型,并伴WBC计数升高,该患儿对化疗耐受好,在强化疗基础上加用伊马替尼,并参考Silverman等[16]的研究每周使用大剂量左旋门冬酰氨酶1次,用足30次,Ph+持续转阴,目前已无事件生存达101个月。MLL基因重排是血液系统恶性肿瘤常见的遗传学改变,此类患儿治疗效果差,极易复发,5年EFS仅为47%[17]。5%~10%的T-ALL型患儿伴有MLL基因重排[9]。本研究结果显示,不良细胞遗传学改变阳性是高危ALL患儿预后不良的危险因素之一;本研究MLL基因重排患儿8例,T-ALL型7例、B-ALL型的婴儿白血病1例。
综上所述,不良细胞遗传学改变阳性、治疗第33天MRD阳性是高危ALL患儿预后不良的危险因素。本研究的不足在于病例数偏少,尚需增加病例数进一步研究。随着精准医学的发展,硫代嘌呤甲基转移酶基因多态性、药物转运蛋白等药物基因组学检测的逐步开展,对高危ALL患儿进行个体化治疗,并加强支持治疗,提高化疗耐受性,均可有效改善高危ALL患儿的预后。

