COVID-19在不同时期的胸部CT表现及出院后核酸复阳肺内病灶变化特点
林红东,蓝博文,周玉祥,马伟琼,陈镜聪
惠州巿中心人民医院放射科,广东 惠州 516001
COVID-19是由SARS-Cov-2感染引起的急性呼吸道传染病。国内文献[1-2,5-9]对COVID-19的临床特点表现及胸部CT表现报道较多,但对其病灶动态变化及转归特点较少,尚未发现有关COVID-19患者出院前与出院后(核酸检测复阳)的肺内病灶前后变化特点的报道。本研究回顾性分析我院54例COVID-19确诊病例的临床及胸部CT影像学资料(其中11例患者出院后核酸检测复阳),归纳总结COVID-19患者在住院期间及出院后(核酸检测复阳)肺内病灶变化及转归特点,以提高影像科及临床医师对COVID-19胸部CT影像学表现及转归特点的认识,更好指导临床对治疗效果的评估。
1 资料与方法
1.1 临床资料
收集2020年1~3月54例COVID-19患者临床及影像学资料。纳入标准:COVID-19核酸检测阳性,病程中胸部CT检查3次,且入院时及出院前必须有1次胸部CT检查。排除标准:COVID-19核酸检测阳性,但胸部CT未见异常;病程中胸部CT检查小于3次或入院时及出院前无胸部CT检查。其中男26例,女28例,年龄1~75岁。40例有发热症状,14例无发热,其中3例无症状,11例仅表现为咽痛或干咳。
1.2 检查方法
采用Philips 16排CT扫描仪行胸部CT平扫,管电压120 kV,管电流300 mA,层厚1.25 mm,层间距1.25 mm,吸气后屏气扫描,扫描范围从肺尖到肺底。
1.3 图像分析
由2位高年资主治医师独立对图像分析,意见不统一时,由高级职称指导、协商后达成一致意见。观察内容包括,基本征象(密度、数量、分布、是否有网格影、边界是否清晰、支气管血管束改变),病灶在不同时期动态变化(形态、密度、是否有吸收或新增、首次吸收时间等)。将病灶新增、首次吸收时间分3个时间段记录(一段7d,二段7~14d,三段14d)。
2 结果
2.1 流行病学史及临床分型
42例近14 d去过武汉市或湖北省,12例无去武汉市或湖北省史;普通型51例,重型3例。
2.2 基本征象
单叶单灶2例,单叶多灶3例,多叶多灶例49例;沿胸膜下分布为主(n=46,图2B~C),沿血管束分布为主6例(图2B),沿肺叶分布2例;磨玻璃(GGO)54例,GGO伴局灶实变28例(图1B、4B),GGO伴细网格征34例(图1A),GGO伴晕征23例(图2B),含气囊腔征3例(图1B);血管束增粗14例(图2B),支气管增粗或扩张18例;1例伴双侧少量胸腔积液。
2.3 不同时期病灶密度、形态变化及开始吸收时间段
早期CT表现为单灶或多灶斑片GGO影;进展期病灶明显增多、密度增高,范围增大(从斑片、小片状变成片状、扇形或楔形);1周后发展为重症期,CT表现双肺多发或弥漫GGO,胸膜下或肺外带形成片状实变,3例病灶内可见含气囊腔,其中1例为蜂窝征;转归期病灶开始吸收减少,47例病灶首次吸收时间在7~14 d,7例病灶首次吸收时间在14 d后,表现为病灶缩小,密度不均匀减低,以边缘为主,中心区域密度不均匀增高,局部形成纤维条索(图1C、2C、3C)。6例在转归期出现新增病灶或病灶范围增大(图1A~B、图2B~C)。9例出院后7~15 d出现核酸检测复阳,2例核酸复阳出现在15 d后,但其肺内病灶较上一次CT(出院前)吸收减少,未见新增病灶。46例符合临床出院标准时,出院前胸部CT仍见多发磨玻璃病灶。
3 讨论
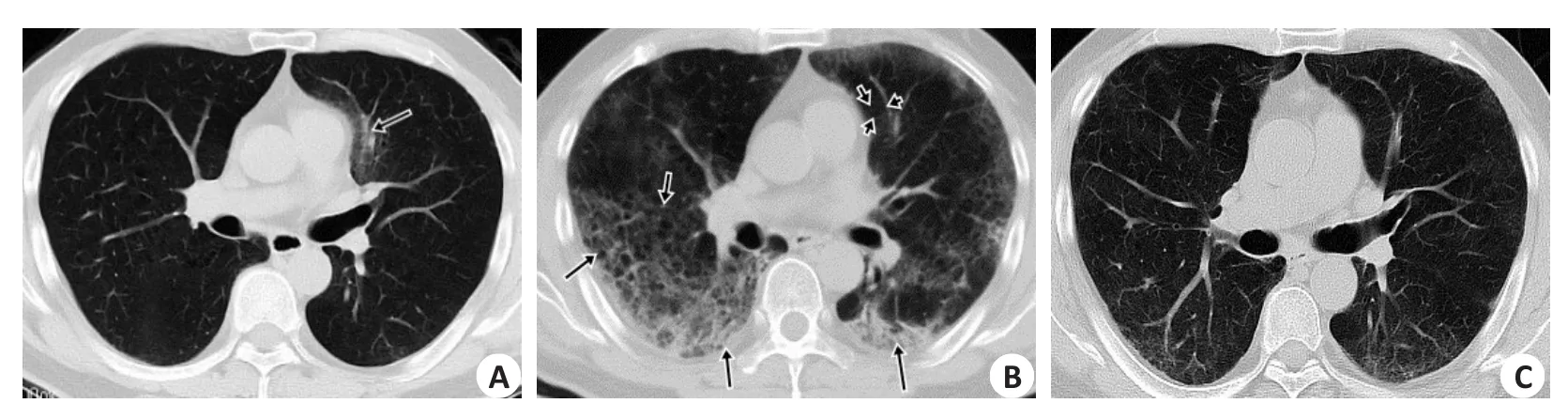
图1 患者男性,56岁,发热1周Fig.1 Male patient, 56 years old, fever for aweek.
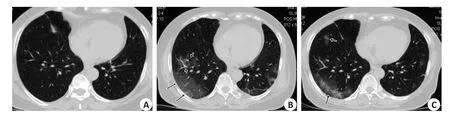
图2 患者女性,68岁,发热5dFig.2 Female patient, 68 years old, fever for 5 days.
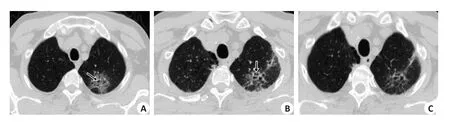
图3 患者男性,69岁,发热2dFig.3 Male patient, 69 years old, fever for 2 days.
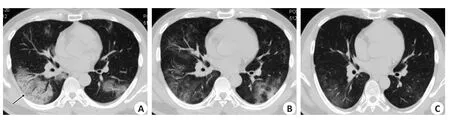
图4 患者男性,41岁,发热6dFig.4 Male patient, 41 years old, fever for 6 days.
COVID-19病原体是SARS-CoV-2[6-7],是β属新型冠状病毒,单股RNA,大小60~140 nm,椭圆形或圆形,主要通过飞沫或接触传播,临床主要表现发热、干咳,部分患者表现为腹泻,亦可无症状隐性感染,潜伏期1~14 d,平均3~7 d[8]。本组病例中14例(26%)患者入院时无发热症状,但胸部CT提示肺部感染。COVID-19不同时期影像学表现不同,也有一定的交叉重叠,依据指南[9]将CT表现分为早期、进展期、重症期及转归期。本组病例通过多次(至少3次)胸部CT检查动态分析COVID-19病灶的演变及转归过程。COVID-19早期出现在发病1周内,胸部CT表现单灶或多灶斑片状或结节样磨玻璃影,边缘欠清,可见晕征,沿胸膜下(肺野外带)、血管束分布,以双肺下叶居多。本组病例54例(100%)均可见磨玻璃密度影,23例(44%)可见晕征,2例(3.7%)为单发病灶,52例(96.3%)为多发病灶,与文献报道相近[1-2]。随着时间的推移及疾病的进展,病灶逐渐增多,并融合成大片状,宽基底紧贴胸膜,形成扇形或楔形改变,在磨玻璃样密度为背景下可见细网格征(小叶间隔增厚),出现局灶或片状实变,内可见增粗血管束及支气管,少数病灶沿支气管血管束分布,呈云絮样、烟花样改变。本研究中34例(63%)磨玻璃密度内可见细网格征,28例(52%)出现局灶或节段性实变,14例(27%)内可见血管束增粗,18例(33%)见支气管增粗或轻度扩张。随着病程的进一步发展,大部分进展期患者(96%)进入转归期,即吸收、消失期,此期病灶相对稳定并开始逐渐吸收,表现为病灶范围缩小、密度不均匀减低,边界变模糊,内部区域细网格、条索样密度增高影,最后大部分病灶可完全消失,少部分则形成条索状、网格样纤维灶,且沿着胸膜下或血管束长轴平行分布,增粗血管束及支气管恢复正常。本组病例吸收散变化过程与已有研究相符[3-4];少部分进展期患者(4%)转为重症期,CT表现双肺弥漫磨玻璃密度背景下出现节段或肺叶实变,甚至形成“白肺”改变[5,10];少数病例出现含气囊腔,甚至蜂窝样改变,此期病灶范围较进展期广,实变较多。本研究1例重症患者出现节段性蜂窝肺改变;3例(6%)入院时为普通型,1周后发展为重型,重型比普通型患者病灶范围更广,实变区域更大,常为肺段或肺叶实变,以胸膜下更为明显,本研究与现有研究报道基本一致[11-12]。有文献报道右肺中叶和远离胸膜的部位受累提示病变范围比较广泛[13],右肺中叶和远离胸膜的部位受累间接提示转重症的重要征象[12],原因可能为COVID-19疾病进展按从外到内、从下到上的发发展趋势[14]。本组病例中5例为单叶受累,49例为多叶受累(包括右肺中叶),病灶以胸膜下分布为主,远离胸膜区域也有受累,仅有3例转为重症,其中1例在转归期右肺中叶出现新增病灶,本研究结果并不支持以上文献报道观点。
本研究发现COVID-19在转归过程中出现“此消彼长”征象,即大部分病灶吸收的同时出现新增病灶或病灶范围增大,与柏玉涵等[15]的研究相符合;本组6例(12%)出现这一征象,其中5例在7~14d期间出现这一变化,1例出现在14 d后,笔者推测出现这一特征原因是病灶新旧不一,原有病灶在机体免疫力相互作用开始吸收,新增病灶可能是病毒肺内播散,导致两者病程时间不同。
有学者认为CT影像所见肺部受累程度总体上与疾病严重程度、临床转归基本一致[8,16],但本研究发现COVID-19在进展期、重症期胸部CT表现与疾病严重程度基本一致,而在转归期影像学表现相对滞后于临床表现。这与郭佑民等[17]的研究相符。本组54例患者符合临床出院标准时,46例(85%)出院前胸部CT仍见多发磨玻璃、条索样病灶,8例(15%)出院前CT显示肺内病灶基本消失;11例(20.4%)患者出院后出现核酸检测复阳,但其胸部CT病灶却较上一次CT(出院前)吸收减少,未见新增病灶。COVID-19转归期病灶吸收消散慢,前期吸收较后期快,磨玻璃病灶比实变消散快。本组47例(87%)病灶首次吸收在7~14d间,7例(13%)病灶首次吸收时间在14d后。COVID-19胸腔积液少见,本研究54病例仅1例出现少量胸腔积液,与文献报告相符[5-6,11]。
COVID-19典型影像表现为沿胸膜下分布的磨玻璃密度灶,小叶间隔增厚,病灶内血管束增粗,节段实变,其病理本质是肺泡炎、肺间质炎症。SARS-CoV-2病毒与肺泡上皮细胞膜表面ACE2受体结合,入侵肺泡上皮细胞,导致肺泡细胞肿胀、增生,肺泡腔浆液、纤维蛋白渗出,肺间质血管充血、扩张,炎症细胞浸润[18-19]。汪翊等[16]认为而病灶内出现含气囊腔是COVID-19罕见征象,本组病例中3例可见有病灶可见含气囊腔,其中1例蜂窝状改变;有学者认为COVID-19病灶内气腔为病变坏死后形成的空洞[20],本研究认为病变内含气囊腔是由于小气道损伤、气道内黏液造成小气道堵塞[19],导致肺泡过度充气,形成含气囊腔,因此在转归期大部分含气囊腔消失。
COVID-19不同时期影像学表现不同,其转归过程有一定的特征及规律,转归期病灶吸收消散慢,影像学表现滞后于临床表现,少部分病例可出现“此消彼长”的变化。因此,正确认识和掌握COVID-19的CT影像学变化过程对其早期诊断、排查、疗效评估具有非常重要的临床价值。

