体外法研究乙酸发酵型脂肪酸组合对瘤胃细菌乙酸发酵的影响
习瓒娜 经语佳 戴乐军 王梦芝*
(1.扬州大学动物科学与技术学院,江苏扬州225009;2.连云港生物工程中等专业学校,江苏连云港222065)
日粮组成是引起乳脂率变化的重要因素,调控日粮可使乳脂率降低46%左右[1]。乳脂降低综合征的发病机制主要包括日粮因素造成乳脂合成前体物质不足和瘤胃氢化异常产物抑制乳腺脂肪酸合成等[2-3]。大约50%的乳脂是以瘤胃发酵产生的乙酸为原料由乳腺合成,其余部分则由饲料的脂肪或体内积蓄的脂肪供给。瘤胃发酵产生的乙酸的比例升高会明显提高牛奶中乳脂含量,且乳脂率与瘤胃内乙酸/丙酸比呈正相关[4-5]。研究表明,在泌乳奶牛日粮添加脂肪或脂肪酸是调控奶牛泌乳性能和能量代谢的有效途径[6-7]。膳食植物油和油籽补品可以改善牛奶中的脂肪酸组成,并且在奶牛日粮中添加亚油酸有助于消化膳食纤维并提高牛奶质量[8-9]。Bayat 等[8]试验发现脂质调控了微生物群落结构,并增加不饱和脂肪酸和总共轭亚油酸的比例,同时不影响消化率、瘤胃发酵、瘤胃微生物数量和牛奶产量。在奶牛日粮中添加棕榈油可减少原虫数量,但不会影响瘤胃中的纤维素分解细菌数量[10]。一些研究发现,油脂或脂肪酸的混合添加存在互作作用,如:低浓度的精油组合,可以减轻甲烷排放和反刍动物的氮排泄[11];杨舒黎[12]研究发现,添加植物油混合组相对于单一添加植物油,对淀粉分解菌和蛋白质分解菌存在一定的加性效应。本实验室已筛选出饱和程度不同的长链脂肪酸在乙酸发酵模式下的最优组合[13],但目前对该脂肪酸组合是否是通过调控瘤胃细菌群体结构来影响瘤胃发酵模式尚不清楚。因此,本试验主要通过体外培养乙酸型脂肪酸组合,检测其体外发酵参数及相关瘤胃细菌含量,以期阐明脂肪酸组合影响瘤胃发酵模式的微生物机制,从而为其在反刍动物生产实践中的应用提供一些参考。
1 材料与方法
1.1 试验动物与饲养管理
试验选取3头4岁龄、体重为(650±18) kg、平均产奶量为(19.5±0.5) kg并装有永久性瘤胃瘘管的荷斯坦奶牛为瘤胃液供体,试验期间瘘管牛饲喂奶牛场提供的常规饲粮,精粗比为4:6,在每日07: 00 和19: 00等量饲喂,自由饮水。
1.2 试验设计与体外培养底物
试验组在培养底物中添加1.5%硬脂酸、0.5%油酸、1.0%亚油酸、1.5%亚麻油酸进行试验,用棕榈酸钙平衡能量。另外设1个无底物的空白对照组,每组各设3个重复,培养底物组成见表1。

表1 体外培养底物的组成(%)
1.3 体外培养试验
1.3.1 瘤胃液的采集
在晨饲前利用自制真空负压装置从3 头瘘管牛各采集瘤胃液200 ml,4 层纱布过滤后将瘤胃液混合均匀,39 ℃水浴保温迅速送回实验室,准备体外培养。
1.3.2 体外培养
参照Menke等[14]的方法。
1.3.3 取样设计
分别在培养后0、3、6、9、12、18、24 h取样,即刻测定pH 值,取1 ml 立即加MFS 原虫染液固定用于原虫细胞计数,其余样品于-20 ℃保存,用于培养液氨态氮(NH3-N)浓度、微生物蛋白、原虫蛋白和细菌蛋白的测定以及DNA的提取。
1.4 指标的测定
1.4.1 pH值的测定
采用上海雷磁试验设备厂pHS-3C 型pH 计进行测定。
1.4.2 NH3-N浓度的测定
NH3-N浓度采用冯宗慈等[15]的方法进行测定。
1.4.3 培养液挥发性脂肪酸(VFA)浓度测定
采用日本岛津GC-14B气相色谱仪进行测定[16]。
1.4.4 微生物的分离与测定参照王梦芝等[17]的方法进行分离与测定。
1.5 微生物DNA的提取与荧光定量PCR
1.5.1 微生物DNA提取
分别取不同采样时间点培养液做以下操作:
①样品离心(14 000 r/min,10 min)后弃上清,加油提液5 ml(100 mmol/l Tris-Cl,50 mmol/l EDTA,2%CTAB),混匀;
②加100 μl 5 mg/ml 蛋白酶K,1/10 体积的20%SDS,完全冻至成冰后55 ℃水浴60 min,重复冻融3次;用等体积的苯酚/氯仿/异戊醇(V/V/V=25/24/1)先抽提1次,离心(12 000 r/min,10 min);
③取上水相,再用等体积的氯仿/异戊醇(V/V=24/1)抽提和离心数次至上水相澄清(无色);
④取水相,加0.6 体积的异丙醇,冰上静置沉淀DNA 之后离心去上清,70%乙醇洗沉淀2~3 次,自然干燥,适量TE溶解;
⑤Nanodrop1000 测定所提取DNA 浓度和纯度,0.7%琼脂糖电泳检测DNA片段大小。
1.5.2 荧光定量PCR反应条件
①95 ℃预变性30 s;
②95 ℃变性5 s,60 ℃退火和延伸34 s并采集荧光信号,共40个循环;
③熔解曲线分析,以0.1 ℃/s的速度从60 ℃升至95 ℃,60 ℃和95 ℃各保温15 s,每升0.1 ℃采集一次荧光。以Bacterial-U为内参,计算各细菌的相对含量。
1.6 引物设计
在GenBank上查找琥珀酸拟杆菌(Fibrobacter suc⁃cinogenes)、黄色瘤胃球菌(Ruminococcus flavefaciens)等不同菌株的16S rDNA 序列,然后利用DNAStar 中MegAlign 进行序列比对,寻找种内保守区域,利用Primer express 5.0 进行引物设计,并通过GenBank 中Blast 检测引物特异性。以细菌通用引物细菌U(Bac⁃terial-U)为内参,对各细菌进行相对定量。细菌引物序列见表2。

表2 细菌引物信息与序列表
1.7 数据分析
采用Excel 2016软件整理数据,试验结果用“平均值±标准差”表示,用SPSS 25.0 软件中Compare Mean的independent-samples T-Test程序进行分析检验。
2 结果与分析
2.1 乙酸型脂肪酸组合体外培养对pH 值和NH3-N浓度的影响
由表3 可知,体外培养的pH 值在5.56~6.91 之间波动,并且对照组与试验组之间差异不显著(P>0.05);NH3-N 浓度各组总体呈先降低再升高的变化趋势,各组NH3-N浓度在9.05~15.05 mg/dl之间,在体外培养18 h 时,对照组NH3-N 浓度显著高于试验组(P<0.05),其他时间点差异不显著(P>0.05)。
2.2 乙酸型脂肪酸组合体外培养对VFA的影响
如表4所示,总挥发性脂肪酸(TVFA)浓度随时间的推移逐渐升高,试验组的TVFA浓度9 h后及其均值显著高于对照组(P<0.05);乙酸占TVFA的比例变化平缓,有下降趋势,且试验组各时间点乙酸占TVFA的比例总体高于对照组,其均值显著高于对照组(P<0.05)。
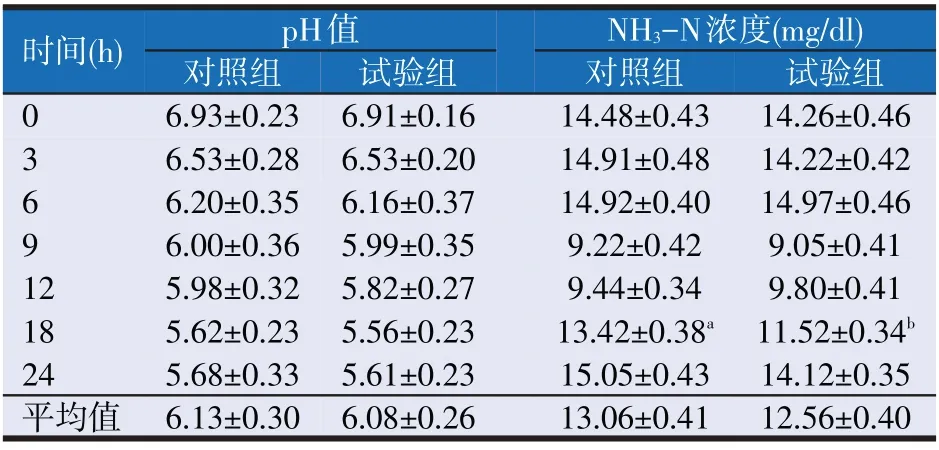
表3 乙酸型脂肪酸组合体外培养对pH值和NH3-N浓度的影响

表4 乙酸型脂肪酸组合对TVFA浓度和乙酸占TVFA比例的影响
2.3 乙酸型脂肪酸组合体外培养对微生物蛋白和原虫蛋白/细菌蛋白的影响
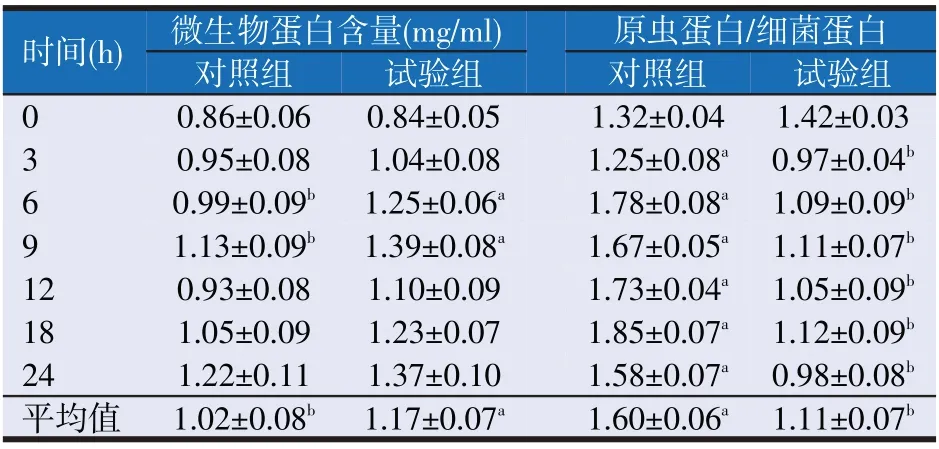
表5 乙酸型脂肪酸组合对微生物蛋白含量和原虫蛋白/细菌蛋白的影响
如表5所示,乙酸型脂肪酸组合的微生蛋白含量显著高于对照组(P<0.05),而其原虫蛋白/细菌蛋白的比例却显著低于对照组(P<0.05)。
2.4 乙酸型脂肪酸组合体外培养对瘤胃细菌的影响
如表6所示,试验组中嗜淀粉瘤胃杆菌、琥珀酸拟杆菌的相对含量均显著高于对照组(P<0.05),试验组中溶纤维丁酸弧菌的相对含量显著低于对照组(P<0.05),而白色瘤胃球菌、黄色瘤胃球菌、蛋白溶解梭菌、降解淀粉瘤胃球菌、埃式巨球菌在组间差异均不显著(P>0.05)。
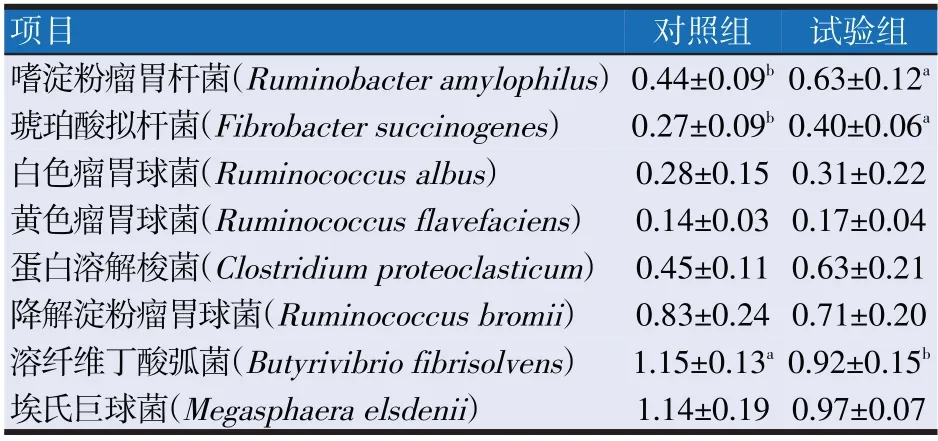
表6 乙酸型脂肪酸组合对瘤胃细菌含量的影响
3 讨论
3.1 脂肪酸制剂体外培养对pH 值和NH3-N 浓度的影响
pH 值和NH3-N 浓度是反映瘤胃发酵的重要指标,瘤胃液NH3-N浓度变化反映瘤胃微生物对日粮氮的降解速度和瘤胃微生物对NH3-N 的利用速度[18]。瘤胃微生物最适NH3-N 浓度为6.3~27.5 mg/dl[19]。有研究表明,补充亚麻油不会对奶牛的瘤胃pH 值产生影响[20]。此外,使用不同类型的膳食油在他人的研究中也报道了相同的结果[10,21-23]。,不同的脂肪酸对NH3-N浓度的影响没有显著差异[23-24]。本试验结果显示培养液pH值和NH3-N浓度在组间没有显著性的差异,都处于瘤胃微生物适宜生长的范围。该结果与前人的试验结果基本一致。这说明脂肪酸组合对瘤胃微生物体外培养的发酵状态没有影响。
3.2 脂肪酸制剂体外培养对VFA的影响
泌乳奶牛乳脂肪酸有两种主要来源,一种是乳腺上皮细胞从血液中摄取瘤胃发酵产生的乳脂合成前体物乙酸和β-羟丁酸,另一种是日粮来源的长链脂肪酸,主要是C18[25]。增加乳腺乳脂前体物的供给能改变泌乳奶牛乳腺脂肪酸的代谢[26-27]。在日粮中添加油脂或脂肪酸能够改变瘤胃微生物区系及其发酵过程[28]。Zhang 等[29]提出不饱和C18脂肪酸改变瘤胃发酵模式和微生物种群分布,可增加TVFA 浓度。而本试验添加乙酸发酵型的长链脂肪酸组合,结果发现,瘤胃发酵产生的TVFA 浓度以及其中乙酸的比例都显著提高,这进一步表明脂肪酸组合的添加有利于瘤胃发酵,趋使瘤胃发酵模式向乙酸型发酵模式变化。
3.3 脂肪酸制剂体外培养对微生物蛋白和原虫蛋白/细菌蛋白的影响
有研究表明,日粮中添加脂肪酸能抑制瘤胃中原虫和部分菌群的生长,使微生物总量和活力改变,增加微生物蛋白的合成,从而引起瘤胃微生物菌群结构的变化,进而影响瘤胃的发酵[30-34]。添加不同浓度油脂(桉树油)发现,油脂在瘤胃脂解后生成游离脂肪酸的不饱和键能控制原虫和部分细菌,从而调控了原虫蛋白与细菌蛋白的比例[35]。而本试验结果显示,试验组微生物蛋白含量显著高于对照组,而其原虫蛋白/细菌蛋白的比例却显著低于对照组。可说明脂肪酸组合提高了瘤胃微生物的总量,抑制了原虫数量进而抑制其吞噬细菌等活动,提高了原虫蛋白/细菌蛋白中细菌群体的比例,使原虫蛋白/细菌蛋白的比例降低。表明脂肪酸组合能够调控体外培养瘤胃微生物的群体量和群体结构。
3.4 乙酸发酵型脂肪酸组合体外培养对瘤胃细菌的影响
日粮添加不同来源或不同水平的脂肪对瘤胃发酵参数及微生物区系有一定的调控作用,不同来源脂肪和不同添加水平脂肪对瘤胃发酵功能的影响程度都不同[32-33]。瘤胃中的纤维降解菌主要包括白色瘤胃球菌、黄色瘤胃球菌和产琥珀酸丝状杆菌,分别占总纤维分解菌的33%、2.6%和46%[36-37]。白色瘤胃球菌和黄色瘤胃球菌是反刍动物瘤胃中降解植物细胞壁活性最高的细菌[38],都属于革兰氏阳性菌,能产生大量的纤维素酶和半纤维素酶,分解纤维素和纤维二糖,产生甲酸、乙酸和琥珀酸。嗜淀粉瘤胃杆菌是主要的淀粉分解菌之一,其主要产物为乙酸和琥珀酸[39]。本研究中,试验组中嗜淀粉瘤胃杆菌、琥珀酸拟杆菌的相对含量均显著高于对照组,这恰恰证明了我们试验所选脂肪酸组合为乙酸型脂肪酸组合,这说明脂肪酸组合可能是通过调控瘤胃细菌数量来改变瘤胃发酵模式的。溶纤维丁酸弧菌与琥珀酸拟杆菌、黄色瘤胃球菌等其他瘤胃微生物协同共生,对维持微生物动态平衡起重要作用[38]。试验组中溶纤维丁酸弧菌的相对含量显著低于对照组,这与前人的试验结果一致[12,40]。但目前对瘤胃细菌的研究结果各有差异,肉牛饲粮添加豆油和胡麻油的研究并没有发现瘤胃淀粉分解菌的变化[41];乌日娜[42]添加6%的植物油脂时显著降低了瘤胃产琥珀酸丝状杆菌含量;金龙等[43]体外发酵添加4%的棕榈仁油提高了黄色瘤胃球菌含量;Candyrine等[44]在饲粮中添加油脂对黄色瘤胃球菌无影响。这些结果的不一致可能是由于油脂的添加比例不同或不同油脂混合后的互作效应对瘤胃微生物的影响不同造成的。当油脂添加超过一定比例时,油脂可能附着于瘤胃中菌体表面,影响细菌的活动及其酶的分泌,从而影响微生物代谢,或可能由于某些脂肪酸对微生物有一定的毒害作用,损害了部分纤维素降解微生物的胞膜而抑杀微生物[12,40]。
4 结论
乙酸发酵型脂肪酸组合能够调控瘤胃发酵模式,促进了微生物的发酵活力,与对照组相比,试验组将乙酸占TVFA的比例从73.54%提高至75.59%,趋使瘤胃发酵模式向乙酸型发酵模式变化,进而可能影响奶牛的泌乳性能,但乙酸型脂肪酸组合对奶牛泌乳性能的影响尚有待于进一步的试验证明。

