茶渣固态发酵产红曲霉色素的工艺参数探索
周昀


摘 要:對茶渣固态发酵产红曲霉色素工艺条件进行优化。在单因素试验基础上,以硫酸铵、茶渣、大豆油添加量为影响因素,以红曲色素总色价为响应值,采用BoxBehnken中心组合试验设计数学模型,优化茶渣固态发酵产红曲霉色素的培养条件。结果表明:影响茶渣固态发酵产红曲霉色素的因素大小依次为硫酸铵、大豆油、茶渣;茶渣固态发酵产红曲霉色素的最佳培养条件为硫酸铵添加量1.66%、茶渣添加量35.37%、大豆油添加量2.4%以及接种量3%,根据模型预测的总色价为(1076.4±30.2)U·g-1。进行重复验证试验,经测定实际所得总色价为1063 U·g-1,总色价实测值与回归模型的预测值相对误差1.26%,说明回归方程与实际情况拟合较好。
关键词:茶渣;红曲霉;红曲色素;固态发酵
中图分类号:TS209 文献标志码:A 文章编号:0253-2301(2020)08-0001-06
Abstract: The technological conditions of producing the Monascus pigment by solidstate fermentation of tea residue were optimized. On the basis of the single factor experiment, with the ammonium sulfate, tea residue and soybean oil as the influencing factors and the total color value of Monascus pigment as the response value, the BoxBehnken central composite design was used to design a mathematical model, in order to optimize the culture conditions for the production of Monascus pigment by solidstate fermentation. The results showed that the factors affecting the production of monascus pigment by solidstate fermentation of tea residue were the ammonium sulfate, soybean oil and tea residue in order. The optimum culture conditions for producing the Monascus pigment by solidstate fermentation of tea residue were the ammonium sulfate (1.66%), tea residue (35.37%), soybean oil (2.4%) and inoculation amount (3%). And the total color value predicted by the model was (1076.4±30.2)U·g-1. Then, the repeated verification tests were carried out and the actual total color value was determined to be 1063 U·g-1. The relative error between the measured value of total color value and the predicted value of the regression model was 1.26%, indicating that the regression equation fit well with the actual situation.
Key words: Tea residue; Monascus; Monascus pigment; Solidstate fermentation
红曲霉产的红曲色素作为一种天然色素,广泛使用在食品加工业中[1]。红曲色素目前已确定结构的有红曲红、红曲橙和红曲黄3种,与其他色素相比具有降血脂、降血压等生理活性,且稳定性高,着色力强等优势[2],开发色价高的红曲色素成为近年来红曲霉产物的研究热点。与此同时,由于茶叶中含有较多的营养成分,作为传统饮料,制作茶叶、茶饮料生产中产生了大量废弃茶叶副产品。茶渣中保留了大量纤维素、木质素、茶多酚、氨基酸及微量元素等有效成分,具有潜在利用价值[3]。福建省作为产茶大省,茶叶消费副产品相当巨大,茶渣等再利用的研究对促进福建省农业残余产业发展具有重要意义。本研究以茶渣为固态发酵基质,对其固态发酵产红曲霉色素的工艺进行优化,以期为茶渣的合理开发利用提供参考依据。
1 材料与方法
1.1 供试材料
1.1.1 菌种 红曲霉菌株S2:由本实验室筛选保藏。
1.1.2 主要仪器 6孔圆形深孔板(上海联硕生物科技有限公司);T6型紫外可见分光光度计(北京普析通用仪器有限责任公司);hh6数显恒温水浴锅(常州金坛宏华仪器厂);LRH生化培养箱(上海恒科学仪器公司);VD850型洁净工作台(苏州净化设备公司);YB500A高速多功能粉碎机(上海力箭机械有限公司);Readmax1900全波长酶标仪(上海闪谱生物科技有限公司)。
1.1.3 主要试剂 可溶性淀粉、麦芽糖、蛋白胨、琼脂、K2HPO4、NaNO3、KCl、MgSO4·7H2O、ZnSO4·7H2O、硫酸铵、酵母浸粉、蔗糖、甘油、牛肉浸膏、70%乙醇(73.7 mL 95%乙醇用超纯水定容到100 mL),均为国产分析纯试剂。茶碎茶梗及豆粕购自网络平台,金龙鱼食用油购自超市。
1.2 培養基
1.2.1 微量元素配方 0.3%NaNO3、0.1% ZnSO4·7H2O、0.1% MgSO4·7H2O、0.2%K2HPO4。
1.2.2 斜面培养基 PDA培养基:马铃薯去皮,切成小块,称200 g加水1 L,煮沸保持30 min,4层纱布过滤去渣,滤液加入琼脂20 g、葡萄糖20 g,加热溶解,定容至1 L。分装到试管中,硅胶塞封口包扎好后于121℃高压灭菌30 min。取出后试管摆斜面,冷却后留存备用。
1.2.3 固体发酵培养基 取20 g茶碎茶梗略粉碎后加少量超纯水浸泡10 min后滤去水分得到茶渣,另加入45 g超纯水及上述微量元素浸泡过夜,添加额外氮源后倒入250 mL三角烧瓶内于121℃高压灭菌30 min。使用6孔深孔板时,配置同等比例的料水后分别于每孔中添加8 g料水,121℃高压灭菌30 min。
1.3 试验方法
1.3.1 斜面培养及菌悬液的制备 保藏的红曲霉接种于斜面培养基,在30℃培养箱中活化7 d;刮下斜面上孢子转移到另一个含有10 mL的生理盐水试管中,振荡5 min形成菌悬液。
1.3.2 单因素试验 单因素试验均以单纯茶渣固体培养基、不添加氮源及红曲菌的样品作为参比样。
(1)不同氮源类型对红曲霉产色素的影响。在固体发酵培养基基础上,分别额外添加1.5%的氮源(蛋白胨、酵母浸粉、硫酸铵及豆粕,其他氮源以蛋白胨含氮量折算)。以1.5%接种量接入菌悬液,30℃下静置培养7 d。
(2)不同氮源添加量对红曲霉产色素的影响。在固体发酵培养基基础上,分别额外添加1%、1.5%、2.5%和3%的(NH4)2SO4。以1.5%接种量接入菌悬液,30℃下静置培养7 d。
(3)不同茶渣添加量对红曲霉产色素的影响。在固体发酵培养基基础上,采用额外添加1.5%氮源硫酸铵,分别添加25%、30%、35%和40%茶碎茶梗。以1.5%接种量接入菌悬液,30℃下静置培养7 d。
(4)不同食用油添加量对红曲霉产色素的影响。在固体发酵培养基基础上,采用额外添加1.5%氮源硫酸铵和35%的碳源茶碎茶梗,分别添加1%和2%大豆油。以1.5%接种量接入菌悬液,30℃下静置培养7 d。
(5)不同接种量对红曲霉产色素的影响。在6孔板固体发酵培养基基础上,采用额外添加1.5%硫酸铵(氮源)和35%茶碎茶梗(碳源),在每孔分别添加1%、3%、5%和10%菌悬液,30℃下静置培养7 d。
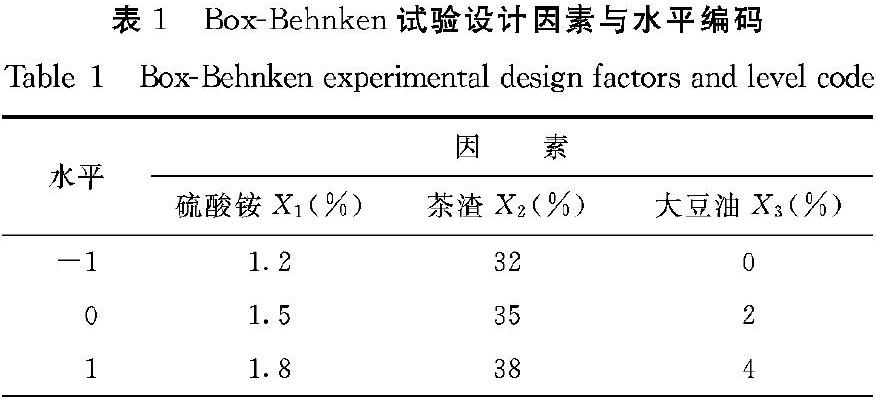
1.3.3 茶渣培养基正交试验 使用JMP13软件设计BoxBehnken中心组合试验,试验设计因素及水平列于表1。以硫酸铵(氮源)、茶渣(碳源)和大豆油添加量为3个因子自变量,红曲色素总色价为响应值。使用JMP13软件对响应面结果进行逐步回归分析。
1.3.4 发酵产物色价的测定 取发酵物0.5 g,以超纯水或70%乙醇定容至10 mL,60℃恒温水浴锅中浸提1 h后超声振荡及过滤。取滤液0.5 mL用超纯水或70%乙醇适当稀释后分别在410、465、510 nm处测定吸光度值分别为黄、橙和红的色价。6孔板培养时使用全波长酶标仪进行色价的测定,制备待测样方法一致。总色价=(OD410+OD465+OD510)×稀释倍数[4]。
2 结果与分析
2.1 不同氮源类型对红曲霉产色素的影响
由图1可知,无额外添加氮源的条件下红曲霉产醇溶性和水溶性色素均很少,可能是因为茶叶本身的含氮量只有3.5%~4.5%[5],经过浸泡后流失部分水溶性氨基酸使残留的茶蛋白含量更低,不足以支持红曲霉对氮源的需求。水溶性色素产量甚少,故此后仅测定醇溶性色素含量。而各氮源对红曲霉产醇溶色素的促进作用为硫酸铵>牛肉浸膏>蛋白胨>酵母浸粉>豆粕,以唯一无机氮源硫酸铵的效果最佳,醇溶性色素的产量可达到274 U·g-1,为未添加额外氮源参比样的5.5倍左右。有机氮源中牛肉浸膏的效果较好,但鉴于价格考虑,硫酸铵无疑是外加氮源的最佳选择。
2.2 不同硫酸铵添加量对红曲霉产色素的影响
由图2可知,硫酸铵添加量为1.5%时,3种醇溶性色素总产量可达222 U·g-1,低于或高于1.5%添加量都会造成醇溶性色素生成的减少。过高的氮源反而会抑制3种醇溶色素的产生,可能和促进菌体生长而抑制了代谢产物的产生有关。
2.3 不同茶渣添加量对红曲霉产色素的影响
由图3可知,茶渣占发酵物总质量的35%时,3种醇溶性色素的产量最高(红色素191.4 U·g-1、橙色素109.8 U·g-1、黄色素62.2 U·g-1,总色素量363.4 U·g-1)。但茶渣量并非越多越好,当其占比为40%时,由于水分含量降低且茶叶吸水性较强,导致发酵物较干,不利于红曲霉的发酵,所产醇溶性色素比添加30%茶渣时低。
2.4 不同大豆油添加量对红曲霉产色素的影响
由于周波等[6]在之前的研究中发现使用食用植物油确实可以促进液态发酵红曲霉色素的产量,故在茶渣培养基基础上添加了不同含量的大豆油进行试验。由图4可知,添加植物食用油可以促进红曲霉产醇溶性色素,且随着食用油添加量增加色素有增长的趋势,在添加总量为2%的大豆油后醇溶性色素产量达到811 U·g-1。
2.5 不同接种量对红曲霉产色素的影响
由图5可知,过多接种量对于红曲霉产色素不利,可能是菌株之间竞争营养抑制了色素的产生,这种效应在容量较小的深孔板培养环境中体现得更加明显,添加3%菌悬液时3种醇溶性色素的产量都达到峰值(总产量972 U·g-1)。
2.6 BoxBehnken中心组合试验结果
2.6.1 回归方程分析 BoxBehnken中心组合试验设计结果列于表2。根据表2试验结果,以总色价(Y)为响应值,以标准最小二乘法进行二次回归方程拟合,得到总色价(Y)的回归方程,即Y=-12218.014+3849.44X1+562.93X2+139.56X3-798.61X12-7.18X22-29.16X32 -33.89X1X2。
回归分析及方差分析结果见表3,由表3可知,模型P<0.0001,表明回归模型高度显著。该模型的相关系数R2=0.97,说明拟合程度极好,可用于后续茶渣发酵红曲霉色素的产量预测所用。对回归方程的各项方差进一步检验可知,X1、X2、X3三因素对红曲色素产量的影响强度顺序为硫酸铵添加量(X1)>大豆油添加量(X3)>茶渣添加量(X2)。因素X1、X3及二次项
X12、X22、X32对总色价具有极显著影响(P<0.01),因素X2及交互项X1X2对总色价具有显著影响(P<0.05)。
2.6.2 响应面双因子效应分析及预测刻画器 从图6~8的双因子效应分析中可知,3个因素的交互作用显著,且根据JMP软件特有的预测刻画器可以调节相关因素得到预测的总色价。由图9可得最佳培养条件为硫酸铵添加量1.66%、茶渣添加量35.37%、大豆油添加量2.4%以及接种量3%,根据此预测所得的总色价为(1076.4±30.2)U·g-1,与代入回归方程所得总色价1076.37 U·g-1一致。
2.7 验证试验
为确定建立模型与试验结果是否相符,采用最佳培养条件添加1.66%硫酸铵、35.37%茶渣和2.4%大豆油,接种量为3%时进行可靠性重复试验3次。经测定实际所得红曲霉色素总色价为1063 U·g-1,与模型预测范围相差不大,说明模型设计合理,预测结果准确。
3 结论
本研究采用单因素试验对氮源类型、硫酸铵、茶渣、大豆油添加量及接种量进行筛选研究,试验结果表明外加氮源能明显促进茶渣培养基中红曲霉产色素,其中硫酸铵的效果最为明显,而醇溶性色素的产量又明显高于水溶性色素,硫酸铵添加量为1.5%时所产醇溶性色素最高。茶渣作为唯一的碳源,其添加量在35%时醇溶性色素产量最高,说明红曲菌具有分解纤维素和木质素转变成还原糖的能力,其纤维素酶活性的测定是后续研究工作的重点。添加食用大豆油确实会增加醇溶性色素的产量,且产量与添加量成正比。在单因素试验基础上采用响应面法优化茶渣固态发酵产红曲霉素工艺条件为硫酸铵1.66%、茶渣35.37%、大豆油2.4%及接种量3%,在此最佳工艺条件下红曲霉产醇溶性色素可达1063 U·g-1。茶渣色素产量与其他粮食类固体培养基的色素产量[7]相比较低,这可能是因为粮食类培养基的碳源利用更加容易,而茶渣中的碳水化合物以纖维素为主。在今后研究中可考虑添加外源性纤维素酶提高茶渣培养基的利用率。
参考文献:
[1]FENG Y I,SHAO Y C,ZHOU Y X,et al.Effects of glycerol on pigments and monacolin K production by the high monacolin K producing but citrinin free strain,Monascus pilosus MS1[J].
European Food Research Technology,2015,240(3):635.
[2]梁彬霞,白卫东,杨晓暾,等.红曲色素的功能特性研究进展[J].中国酿造,2012,31(3):21-24.
[3]肖正广,周国兰.茶渣的综合利用及研究进展[J].贵州茶叶,2017,45(4):23-25.
[4]吕旭聪,翁星,韩妙坤,等.福建红曲中红曲菌的分离鉴定及菌株特性研究[J].中国食品学报,2012,12(2):88-97.
[5]顾谦,陆锦时,叶宝存.茶叶化学[M].合肥:中国科学技术大学出版社,2005:66.
[6]周波,钟海雁,林亲录.食用植物油对红曲黄色素合成代谢的影响[J].食品工业科技,2012(13):92-95.
[7]童爱均,吕旭聪,刘晓艳,等.固体发酵基质和外加碳氮源对红曲霉色素产量的影响[J].中国调味品,2015(5):5-10.
(责任编辑:林玲娜)

