培养基对蛹虫草多糖含量及其生物活性的影响
何雯雯 池升春 李卫旗 贺 亮*
(1浙江大学生命科学学院,浙江杭州310058;2浙江省林业科学研究院,浙江杭州310023)
蛹虫草是拟青霉寄生鳞翅目蛹及其幼虫后形成的复合体[1],含有多糖、虫草素、腺苷、虫草酸等多种生物活性成分,具有抗氧化[2]、抗肿瘤[3]、增强机体免疫力等功效[4]。蛹虫草作为冬虫夏草的同属真菌,两者具有相近的化学成分及生物学功效,因此可以作为冬虫夏草的替代品。根据子实体形态,蛹虫草可分为孢子头、圆头、尖头三种。圆头形蛹虫草出草率高、长势好、不易退化,因此试验用圆头形蛹虫草菌株。
目前,我国人工栽培蛹虫草主要培养基为大米、小麦。笔者以大米、小麦、黄豆、花生、桑蚕、柞蚕、玉米为培养基培养蛹虫草,研究不同培养基对蛹虫草多糖生物活性的影响,以期为蛹虫草定向培养提供理论依据。
1 材料与方法
1.1 材料与仪器
试验材料:圆头形蛹虫草菌株(Cm-2 菌株),由浙江大学生命科学学院提供;大米、小麦、花生、玉米、黄豆、柞蚕、桑蚕,均购于沃尔玛超市。
试剂、药品:葡萄糖、苯酚、浓硫酸、乙醇、氯化钠、磷酸二氢钾、磷酸氢二钾、苯甲酸、D-阿拉伯糖、D-半乳糖、D-甘露糖、L-鼠李糖、D-木糖、D-半乳糖醛酸、D-葡萄糖醛酸、L-岩藻糖、D-核糖、三氯乙酸、甲醇、盐酸羟胺、乙酸酐、二氯甲烷、无水硫酸钠、铁氰化钾、三氯乙酸、氯化铁、硫酸亚铁、水杨酸、过氧化氢、DPPH·溶液,均购于国药集团化学试剂有限公司。
仪器设备:DEAE-阴离子交换柱,英国Watman公司;离子交换层析柱(2 cm×35 cm),美国GE 医疗集团;Sephacryl S-100 HR 层析柱(1.6 cm×60 cm),美国GE 医疗集团;DB-5MS 石英毛细管柱(30 mm×0.25 mm×0.25 μm),赛默飞世尔科技(中国)有限公司;U-1900 型可见分光光度计,日本HITACHI集团。
1.2 试验方法
1.2.1 蛹虫草菌种的固体培养
蛹虫草菌种经液体发酵3 d 后,过四层纱布,收集滤液待接种。分别制备以大米50 g、小麦50 g、花生50 g、玉米50 g、黄豆50 g 为基础物的固体培养基。喷雾接种液体菌种2 mL,每种培养基重复10瓶;选取56 只柞蚕(单重500 g),背部注射液体菌种1.5 mL;选取262只桑蚕(单重500 g),背部注射液体菌种0.5 mL。然后在温度21 ℃,空气相对湿度80%,光照200 lx(每天10 h),培养35 d。
1.2.2 蛹虫草子实体多糖提取及含量测定
将蛹虫草子实体干燥、粉碎,过80 目筛后,用80%乙醇脱脂除去色素。取1 g样品,按料液比50∶1、微波功率400 W、提取时间2 h,提取蛹虫草子实体粗多糖。制作葡萄糖标准曲线,苯酚-硫酸法测定多糖含量[5]。
1.2.3 蛹虫草子实体多糖的分离纯化
将10 mg/mL 多糖样品溶于蒸馏水,用0.5 mol/L溶液在DEAE-阴离交换柱(2 cm×35 cm)中以1 mL/min 的流速逐渐洗脱样品。每管收集6 mL 洗脱液,测多糖含量。将10 mg/mL 多糖溶液过S-100凝胶柱纯化,该柱用0.05 mol/L 磷酸缓冲液洗脱,流速为0.5 mL/min,即得蛹虫草子实体多糖纯品。
1.2.4 蛹虫草子实体多糖的单糖组成测定
气相色谱-质谱联用法(GC-MS)分析条件:DB-5MS 石英毛细管柱、30 mm×0.25 mm×0.25 μm、程序升温、起始温度为150 ℃、停留时间为1 min、以3 ℃/min 升温至250 ℃、停留5 min、氦气为载气、柱流速1 mL/min、分流比10∶1、接口温度200 ℃、离子源温度250 ℃、检测器电压350 V。
1.2.4.1 单糖标准品的预处理
准确称取100 mg单糖标准品,将其溶于100 mL的50%苯甲酸溶液中,冰箱4 ℃保存。
1.2.4.2 乙酰化及GC-MS检测
样品加入1 mL 4 mol/L 的三氯乙酸,真空干燥箱120 ℃水解4~6 h。冷却至室温,加入甲醇旋干,重复3 次,除去三氯乙酸。将盐酸羟胺溶液加入干燥的样品中,真空烘箱90°C 氧化30 min。冷却后,加入1 mL 乙酸酐,真空烘箱90 ℃下氧化30 min,加入1 mL 二氯甲烷充分摇动,加入无水硫酸钠振荡去除水分,过滤膜,待GC-MS检测。
1.2.5 蛹虫草子实体多糖体外抗氧化活性测定
1.2.5.1 还原力测定
采用普鲁士蓝法,VC作阳性对照[6]。
1.2.5.2 ·OH清除率测定
采用水杨酸比色法,VC作阳性对照[7]。
1.2.5.3 DPPH·清除率测定
采用DPPH法,VC作阳性对照[8]。
2 结果与分析
2.1 供试固体培养基对蛹虫草子实体多糖含量的影响
葡萄糖标准曲线方程为y=0.015x+0.0701,R2=0.9941,根据标准曲线计算供试固体培养基培养蛹虫草子实体多糖的含量。

图1 供试培养基培养蛹虫草子实体多糖含量
由图1 可见,小麦培养基培养蛹虫草子实体多糖的含量最高,为5.45%,桑蚕培养基培养蛹虫草子实体含量最低,仅为0.9%。食药用菌子实体及菌丝体的长势除与培养基自身所含营养成分种类和含量有关外,还与培养基基质颗粒间隙、持水性强弱等因素有关[9]。黄豆、玉米、花生的持水性较差,灭菌后松散成粒、质地坚硬[10];大米、小麦灭菌后变软,易结成块,且大米、小麦含有丰富的淀粉、蛋白质及微量元素,经菌丝各种酶共同作用降解大分子物质,可改善其营养结构,为蛹虫草子实体生长提供充足的碳源、氮源及微量元素等;柞蚕、桑蚕本身含水量及提供的生长空间有限,菌种侵入其体内后,需要一定的适应时间,导致子实体生长速度相对缓慢[11]。
2.2 供试固体培养基对蛹虫草子实体多糖的单糖组成影响
根据DEAE-Sepharose Fast Flow 洗脱曲线收集含量较高的多糖组分,再根据Sephacryl-S100 洗脱曲线进一步分离纯化。当Sephacryl-S100 洗脱曲线为单一且对称的峰形时,则表明分离得到了均一的多糖组分,将该多糖组分浓缩、冻干后即得纯品多糖。用Xcalibur 1.2 软件分析蛹虫草子实体多糖的单糖组成,根据保留时间确定单糖类型,根据峰面积确定每种单糖的百分比。如表1 所示,不同类的固体培养基培养的蛹虫草含有不同类型的单糖,花生培养基、大豆培养基的蛹虫草多糖中单糖种类最多,为6种,桑蚕、柞蚕培养基最少,为3种,供试7种培养基培养蛹虫草多糖中均检测到甘露糖、葡萄糖、半乳糖单糖。食药用菌多糖的合成、分泌过程复杂,培养基的组成、发酵条件、菌株均能影响其单糖组成、比例及生物活性。玉米等7种基质本身所含营养成分含量、种类以及酶系不同,可供蛹虫草子实体生长的营养物质也不同,因此每种基质培养的蛹虫草子实体多糖的单糖组成、含量各异。
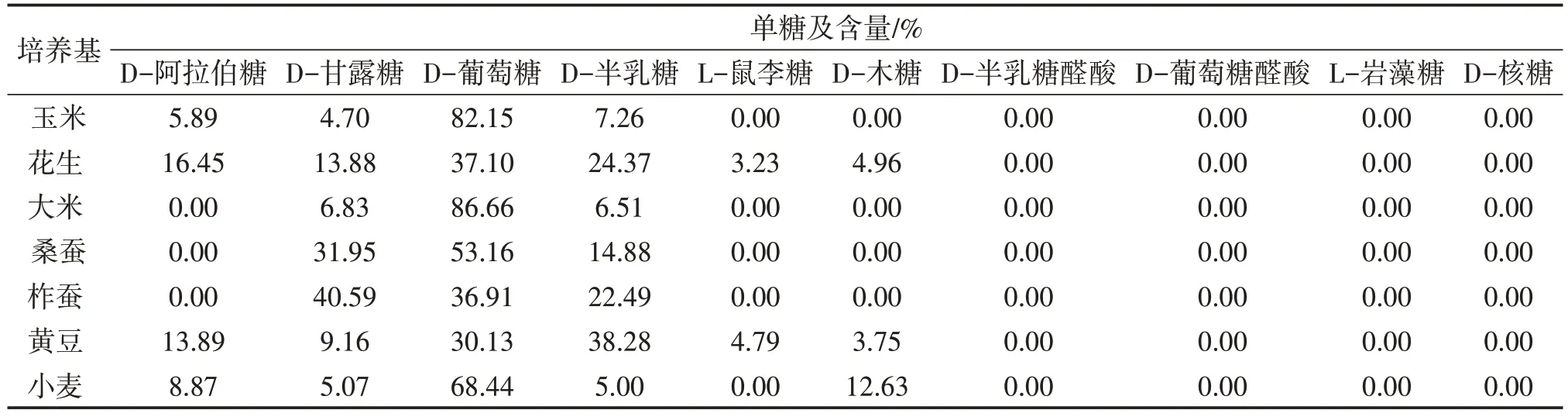
表1 供试固体培养基培养蛹虫草的多糖中单糖组成
2.3 供试固体培养基对蛹虫草子实体多糖体外抗氧化活性的影响
2.3.1 对还原力的影响
多糖类物质总还原力的高低与物质的抗氧化活性呈正相关[12]。多糖类物质能把Fe3+还原成Fe2+,根据显色反应可初步判断其还原程度,吸光度值越大表示该物质还原力越强[13]。由图2 可见,大米培养的蛹虫草子实体多糖还原力高于其余6 种培养基,表明其具有良好的抗氧化活性。当多糖浓度为12 mg/mL 时,大米培养蛹虫草多糖的还原力最高,OD 值为1.64,可达对照VC 的还原力水平;在此浓度,其他培养基培养蛹虫草多糖的还原力OD 值分别为 0.99(黄豆)、0.79(柞蚕)、0.87(花生)、1.35(玉米)、1.08(小麦)、0.81(桑蚕)。

图2 蛹虫草子实体多糖还原力
2.3.2 对·OH清除率的影响
水杨酸可以捕获由Fenton 反应产生的·OH,在510 nm 处测定吸光度值,即可计算多糖对·OH 的清除率。由图3可见(VC为对照),供试固体培养基培养蛹虫草子实体多糖对·OH清除率呈剂量效应,但差异很小。当多糖浓度为12 mg/mL时,对·OH 清除率最高,分别为(黄豆、柞蚕、花生、玉米、大米、小麦、桑蚕)42.0%、39.7%、35.1%、45.8%、53.7%、37.5%、41.9%。
2.3.3 对DPPH·清除率的影响

图3 蛹虫草子实体多糖对·OH清除率
DPPH·是一种以氮为中心的自由基,溶液呈深紫色。多糖作为一种良好的自由基清除剂,可以与DPPH·结合,溶液会变为浅黄色或无色,可根据颜色初步判断清除能力的高低。由图4 可见,随着蛹虫草子实体多糖浓度的升高,其对DPPH·的清除能力增强。以VC 作阳性对照,当多糖浓度为12 mg/mL 时,大米、玉米培养的蛹虫草子实体多糖对DPPH·清除率较高,分别为81.4%、72.6%,效果明显;花生、小麦培养的蛹虫草子实体多糖对DPPH·清除率较低,分别为50.6%、49.8%。

图4 蛹虫草子实体多糖对DPPH·清除率
2.3.4 差异显著性分析
方差分析得到组间差异显著性结果(表4)。由表4 可见,组间还原力水平的P为0.006,表示组间差异极显著;对·OH 清除率,组间显著性分析所得P=0.986>0.05,表明组间差异不显著,这与上述试验结果一致;对DPPH·清除率,组间显著性分析所得P为0.036,表明组间差异显著。
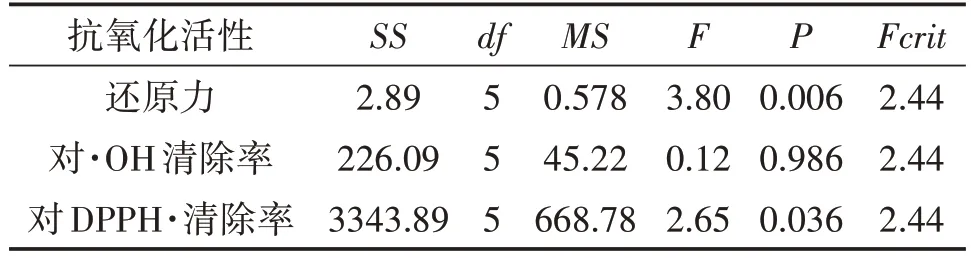
表4 多糖抗氧化活性差异性分析
3 小结与讨论
蛹虫草多糖含量是衡量其品质的重要指标。研究发现,7 种固体培养基培养的蛹虫草,其子实体多糖含量及其单糖组成、体外抗氧化活性均不同。其中大米、小麦培养基所产蛹虫草子实体多糖含量最高,适合进行大规模的工业化生产。大米、玉米培养基子实体多糖的单糖组成中,葡萄糖占比较高,抗氧化效果较好。选择有利于提高蛹虫草子实体多糖含量的培养基培养蛹虫草,可大大降低成本,提高生产效率。此外,培养基所含成分对蛹虫草活性物质合成的作用机理、对其营养及用途将是今后研究的重要方向。

