电子供体在2,4,6-三氯酚和硫酸盐同时降解中的作用
孙立柱 沈永 王成琦


摘 要: 在不少工业废水中,往往同时存在2,4,6-三氯酚(TCP)和硫酸盐等污染物。生物还原法是一种有效的方法,能同时去除水中的这些污染物。采用了丙酮酸(C3H4O3)作为外源电子供体还原TCP和硫酸盐。当单独还原TCP或硫酸盐时,它们的还原速率随着C3H4O3加入量的增加而增加。当TCP与硫酸盐共存时,加入相同量的C3H4O3,由于TCP与硫酸盐还原菌对电子的竞争作用,导致它们的还原速率均有所降低。当C3H4O3进一步增加时,这种对电子的竞争情况可以得到缓解。
关键词: 硫酸盐; 2,4,6-三氯酚(TCP); 还原; 生物降解; 电子供体
中图分类号: TQ 174.75 文献标志码: A 文章编号: 1000-5137(2020)05-0575-06
The role of electron donor in simultaneous degradation of 2,4,6-trichlorophenol and sulfate
SUN Lizhu, SHEN Yong, WANG Chengqi
(Everbright Water(Suzhou) Co., Ltd., Suzhou 215128, Jiangsu, China)
Abstract: It is common that industrial wastewater contains 2,4,6-trichlorophenol(TCP) and sulfate simultaneously.Biological reduction is an effective method to remove the pollutants in the wastewater simultaneously.Pyruvic acid was used as an external electron donor to reduce TCP and sulfate in this work.TCP and sulfate removal rates increased with the increase of pyruvic acid added when they were biodegraded alone.TCP and sulfate removal rates decreased with the same amount of pyruvic acid added when they were biodegraded simultaneously,due to the competition for electron donor between TCP and sulfate-degrading bacteria. The competition for electrons could be relieved when the amount of pyruvic acid was further increased.
Key words: sulfate; 2,4,6-thrichlorophenol(TCP); reduction; biodegradation; electron donor
0 引 言
在木材防腐剂、除草剂、杀菌剂、制药、染料、造纸和焦化等工业废水中,往往既含有大量的硫酸鹽,又含有其他高浓度有机污染物,诸如2,4,6-三氯酚(TCP)等[1],形成了一种复合的工业废水污染。
TCP是一种氯酚类化合物,由于该类物质是人工合成的具有芳环结构和氯原子结构的生物外源性物质,在自然环境条件下,缺乏能有效降解该类化合物的生物体,常常可以检测到该类物质的存在[2-3]。另外,TCP等化合物对人还具有较强的毒害作用,它可以通过皮肤表面或口腔黏膜等的接触途径,进入到人体,对眼睛、皮肤和上呼吸道产生强烈的刺激作用。与此同时,氯酚类化合物还能与细胞中的蛋白质接触,形成不溶性蛋白质,使其发生变性,从而使细胞失去活性。近年来大量的研究资料表明氯酚类化合物对人类还具有“三致”作用[4-7]。
工业废水中的硫酸盐随着废水的排放,会引起地表水的酸化,使天然水体中的水生动物无法生存,同时也会导致水生植物死亡。相比氯酚类污染,硫酸盐本身毒性相对较小,但硫酸盐在自然环境中还原所产生的硫化物却会导致水体散发臭气,影响周边环境[8-9]。此外,硫化物还会与生物染色体中的铁(Fe)离子发生反应,从而抑制生物体的呼吸,当水体中硫化物的质量浓度达到10 mg·L-1时,就会对生物产生毒害作用[10-11]。
对于这些污染物,相比物理、化学等处理方法,生物方法显然更为经济可行。其中对于氯酚类化合物,既可以采用好氧方法[12-13],也可以采用厌氧方法[14-15]。这些方法均可以使氯酚类化合物得到有效降解。但是对于硫酸盐而言,一般采用厌氧方法,使其得到还原[16]。对氯酚类有机物与硫酸盐共存的废水,应用厌氧方法。在厌氧过程中,氯酚类污染物发生还原脱氯反应,而硫酸盐则还原为硫化物,从水中去除。通过还原的方法去除这两类物质的污染物,需要提供电子供体。本研究拟采用厌氧方法,对同时含有TCP和硫酸盐的工业废水进行还原。加入丙酮酸(C3H4O3)作为外源电子供体,研究TCP和硫酸的还原速率,以及两者同时还原时,对电子需求的竞争情况。该研究可以为实际的工业废水有效处理提供理论和实践依据。
1 材料与方法
1.1 化学试剂、TCP以及硫酸盐溶液的制备
实验所用化学试剂均为分析纯,购自上海国药集团。配制模拟的TCP和硫酸盐废水:称取400 mg的TCP和140 mg的硫酸钠粉末分别加入到1 L去离子水中,配制成质量浓度为400 mg·L-1(即2 mmol·L-1)的TCP母液和140 mg·L-1(即1 mmol·L-1)的硫酸盐母液,并置于4 ℃的冰箱中备用。实验时,根据实验情况将母液稀释到一定的质量浓度。氮(N)、磷(P)等无机营养液的配制:将19.19 g氯化铵(NH4Cl)、7.40 g三水合磷酸氢二钾(K2HPO4·3H2O)和4.40 g磷酸二氢钾(KH2PO4)均匀溶解于1 L去离子水中。微量元素的配制:将24 mg六水合氯化镍(NiCl·6H2O)、190 mg六水合氯化钴(CoCl2·6H2O)、150 mg五水合硫酸铜(CuSO4·5H2O)、150 mg七水合硫酸鋅(ZnSO4·7H2O)、6 mg硼酸(H3BO3)和24 mg钼酸钠(Na2MoO4·2H2O)均匀溶解于1 L去离子水中。磷酸盐缓冲溶液的配制:将8.50 g KH2PO4、21.75 g K2HPO4·3H2O、33.40 g七水合磷酸氢二钠(Na2HPO4·7H2O)和1.70 g NH4Cl均匀溶解于1 L的去离子水中。
1.2 污泥驯化
污泥取自某城市污水处理厂的曝气池。对所取污泥分为两个阶段进行驯化。第一阶段先进行好氧驯化:取300 mL污泥置于1 L量筒中,加入一定量的苯酚溶液、营养液和微量元素溶液后,定容至1 L,在好氧条件下进行驯化,此过程持续一周,期间每天更换一次溶液,苯酚溶液的质量浓度从5 mg·L-1逐渐升至50 mg·L-1。随后,再用TCP进行一个月的驯化,在此过程中,苯酚的质量浓度逐渐降低至0 mg·L-1,而TCP的质量浓度逐渐升至20 mg·L-1,期间每天更换一次新鲜溶液,直至20 mg·L-1的TCP能在24 h内得到完全降解,则第一阶段驯化结束。在第二阶段驯化过程中,将第一阶段驯化好的污泥移入500 mL的锥形瓶中进行厌氧驯化。此时,加入C3H4O3、氮磷营养液、缓冲溶液。同时分别在锥形瓶内加入7 mL TCP母液和75 mL的硫酸盐母液,并分别加入自来水到250 mL。将锥形瓶密封后置于磁力搅拌器上进行厌氧驯化。此过程每3 d更换一次新鲜溶液。更换溶液后,利用氮气充气,以保证锥形瓶内的厌氧条件。
1.3 TCP和硫酸盐的生物降解
实验共分为3组进行。第一组是单独降解初始物质的量浓度约为50 μmol·L-1的TCP,并以C3H4O3作为外加碳源,其物质的量浓度分别为0.36 mmol·L-1和0.72 mmol·L-1。第二组是单独生物降解物质的量浓度为0.28 mmol·L-1硫酸盐溶液,同样分别以物质的量浓度为0.36 mmol·L-1和0.72 mmol·L-1的C3H4O3作为碳源进行2组实验。第三组是同时降解TCP和硫酸,它们的物质的量浓度分别是50 μmol·L-1TCP和0.28 mmol·L-1硫酸盐,此时,C3H4O3物质的量浓度分别是0.36 mmol·L-1,0.72 mmol·L-1和1.08 mmol·L-1。以上实验均用500 mL的锥形瓶置于磁力搅拌器上进行。每间隔一定时间取样分析TCP和硫酸盐的物质的量浓度。
1.4 分析方法
所有样品在分析之前,均经过孔径为0.22 μm和型号为MCE-13 mm的滤膜过滤。TCP的分析采用型号为UltiMate 3000的高效液相色谱(美国赛默飞公司),流动相甲醇与水的体积比为V(甲醇)∶V(水)=80∶20,流速为1 mL·min-1。色谱柱型号为ZORBAX SB-C18的反相柱(5 μm,4.6×150 mm,Agilent),柱温为25 ℃。硫酸盐的分析采用型号为DIONEX ICS-5000离子色谱(Dionex)。
2 结果与讨论
2.1 电子供体与TCP降解速率之间的关系
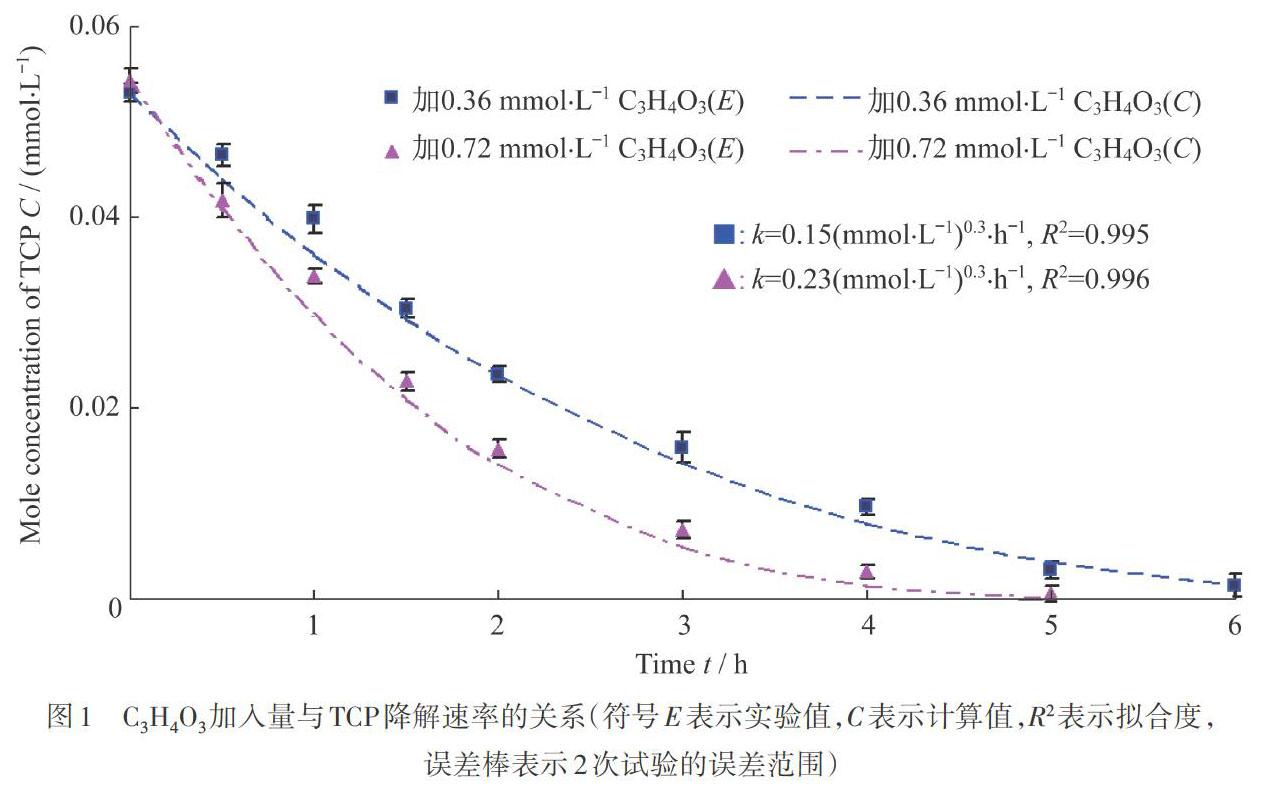
图1所示是TCP在厌氧条件下的生物降解情况。在初始浓度为0.05 mmol·L-1的TCP生物降解过程中,分别加入了2种浓度的C3H4O3作为电子供体进行还原脱氯。TCP的生物降解过程符合分数级动力学:,对其积分后得到,其中,k表示降解动力学参数,C0表示底物的初始浓度,C表示t时刻后底物浓度,α表示反应级数。通过试差法得到其动力学参数符合0.7级(α=0.7)动力学,其单位为(mmol·L-1)0.3·h-1。
C3H4O3在生物降解过程中,按照下式释放出电子:
已有文献表明[17-20],TCP在厌氧条件下会发生还原脱氯反应,在具有电子供体的情况下,逐步脱氯转化为二氯酚(DCP)、氯酚(CP)和苯酚,并释放氯化氢(HCl)。然后在好氧条件下,发生单加氧反应,开环转化为有机酸,最后矿化为二氧化碳(CO2)和水(H2O)。加入的电子供体越多,TCP还原脱氯的速率也就越快。当C3H4O3加入量從0.36 mmol·L-1增加到0.72 mmol·L-1时,TCP的还原脱氯速率提高了53%。该结果表明,TCP的还原脱氯与所提供的电子供体成正比。
2.2 电子供体与硫酸盐降解速率之间的关系
根据CAO等[21]研究表明,硫酸盐可在硫酸盐还原菌的分解代谢作用下,利用C3H4O3作为有机碳源及电子供体,硫酸盐作为电子受体,被还原为硫离子(S2-),并产生硫化氢(H2S)。图2表示加入C3H4O3的量与硫酸盐还原速率之间的关系。硫酸盐的降解速率也同样符合级数为0.7级的分数级动力学参数。
从图2中可以看出,随着C3H4O3加入量的增加,硫酸盐的还原速率也在增加。当C3H4O3加入物质的量浓度从0.36 mmol·L-1增加到0.72 mmol·L-1时,硫酸盐的还原速率提高了23.5%。该结果同样说明,硫酸盐的还原与电子供体的供应量成正比关系。在此过程中,硫酸盐被还原为H2S而从水中逸出。实验表明,在含有硫酸盐的水中,没有加入外源电子供体时,硫酸盐则几乎不能被去除。经过5 h的生物反应,硫酸盐的浓度依然与初始浓度一样(图2中没有标示)。但值得注意的是,由于在还原过程中会产生还原产物H2S,危害生态环境及人体健康,建议污水处理厂配备相应除臭系统,消除H2S对环境的影响。
2.3 TCP与硫酸盐同时还原时其生物降解速率之间的关系
当水中同时存在TCP和硫酸盐时,其生物降解速率如图3所示。从图3可以看出,TCP和硫酸盐依然符合级数为0.7级的分数级动力学规律。但是从它们的降解动力学参数k值来看,相比加入同样浓度的C3H4O3作为电子供体时,相应的k值均有所降低。这说明,当2种污染共存于同一体系时,对电子供体具有竞争作用[22]。例如,当同样加入0.36 mmol·L-1或0.72 mmol·L-1C3H4O3时,相比单独TCP或硫酸盐还原时的速率(图1和图2),TCP的还原速率分别降低了13%和35%,硫酸盐的还原速率降低了16%和25%。而当加入的C3H4O3提高到1.08 mmol·L-1时,TCP和硫酸盐的还原速率均有所提高。
在加入相同量C3H4O3的情况下,硫酸盐的还原速率总是比TCP的还原速率高。这是因为硫酸盐在还原过程中,一步反应就可以转化为H2S,使硫酸盐得以去除。而TCP的还原过程则会生成DCP,CP和苯酚等中间产物,而这些中间产物在还原过程中,仍然需要电子供体。因此,TCP的还原速率总是低于硫酸盐的还原速率。此外,该实验结果表明,该体系中同时存在有TCP和硫酸盐还原菌。且硫酸盐还原菌对电子的竞争能力强于TCP还原菌。当C3H4O3的加入量再增加一些时,这种竞争情况可以得到一定程度的缓解。
3 結 论
废水中的TCP和硫酸盐可以通过还原反应使其得到有效去除,其还原速率与电子供体的加入量成正比关系。电子供体加入量越多,污染物的还原速率越快。此外,废水中共存的2种污染物在还原过程中对电子供体具有竞争作用,且硫酸盐还原菌对电子的竞争能力强于TCP还原菌。当C3H4O3加入量适当增加时,这种对电子的竞争情况可以得到有效缓解。
参考文献:
[1] WANG R,MA Q,YE X,et al.Preparing coal slurry from coking wastewater to achieve resource utilization:slurrying mechanism of coking wastewater-coal slurry [J].Science of the Total Environment,2019,650:1678-1687.
[2] ZHANG Y,SUN X,CHEN L,et al.Integrated photocatalytic-biological reactor for accelerated 2,4,6-trichlorophenol degradation and mineralization [J].Biodegradation,2012,23(1):189-198.
[3] ZHANG Y,PU X,FANG M,et al.2,4,6-trichlorophenol(TCP) photobiodegradation and its effect on community structure [J].Biodegradation,2012,23(4):575-583.
[4] LIU G,TANG H,FAN J,et al.Removal of 2,4,6-trichlorophenol from water by Eupatorium adenophorum biochar-loaded nano-iron/nickel [J].Bioresource Technology,2019,289:121734.
[5] LIN X,LI Z,LIANG B.Accelerated microbial reductive dechlorination of 2,4,6-trichlorophenol by weak electrical stimulation [J].Water Research,2019,1621:236-245.
[6] XU H,TONG N,HUANG S,et al.Degradation of 2,4,6-trichlorophenol and determination of bacterial community structure by micro-electrical stimulation with or without external organic carbon source [J].Bioresource Technology,2018,263:266-272.
[7] SOUZA L P,C?TIA LE?A A G,TAQUEDA M E S,et al.Insights into the reactivity of zero-valent-copper-containing materials as reducing agents of 2,4,6-trichlorophenol in a recirculating packed-column system:degradation mechanism and toxicity evaluation [J].Process Safety and Environmental Protection 2019,127:348-358.
[8] REIS M,GONCALVES L,CARRONDA M.Molybdate inhibition of sulphate reduction in two-phase anaerobic digestion [J].Process Biochemistry,2005,40(6):2079-2089.
[9] MENDIBIDE C,DURET-THUAL C.Determination of the critical pitting temperature of corrosion resistant alloys in H2S containing environments [J].Corrosion Science,2018,142:56-65.
[10] VISSER J M,ROBERTSON L A,VERSEVELD H W.Sulfur production byobligately chemolithoauto-trophic Thiobacillus species [J].Applied and Environmental Microbiology,1997,63(8):2300-2301.
[11] ZHAO L,LIU X,MU X,et al.Highly selective conversion of H2S-CO2to syngas by combination of non-thermal plasma and MoS2/Al2O3[J].Journal of CO2Utilization,2020,37:45-54.
[12] JES?S A G,ROMANO-BAEZ F J,LEYVA-AMEZCUA L,et al.Biodegradation of 2,4,6-trichlorophenol in a packed-bed biofilm reactor equipped with an internal net draft tube riser for aeration and liquid circulation [J].Journal of Hazardous Materials,2009,161(2/3):1140-1149.
[13] ANTIZAR-LADISLAO B,GALIL N.Biodegradation of 2,4,6-trichlorophenol and associated hydraulic conductivity reduction in sand-bed columns [J].Chemosphere,2006,64(3):339-349.
[14] SONG J,ZHAO Q,GUO J,et al.The microbial community responsible for dechlorination and benzene ring opening during anaerobic degradation of 2,4,6-trichlorophenol [J].Science of the Total Environment,2019,651:1368-1376.
[15] SONG J,CHEN L,CHEN H,et al.Characterization and high-throughput sequencing of a trichlorophenol-dechlorinating microbial community acclimated from sewage sludge [J].Journal of Cleaner Production,2018,197:306-313.
[16] ZAN F,HAO T.Sulfate in anaerobic co-digester accelerates methane production from food waste and waste activated sludge [J].Bioresource Technology,2020,298:122536.
[17] MCFALL S M,ABRAHAM B,NARSOLIS C G,et al.A tricarboxylic acid cycle intermediate regulating transcription of a chloroaromatic biodegradative pathway:fumarate-mediated repression of the clcABD operon [J].Journal of Bacteriology,1997,179(21):6729-6735.
[18] LI D Y,EBERSPIICHER J,WAGNER B,et al.Degradation of 2,4,6-trichlorophenol by Azotobacter sp.strain GP1 [J].Applied and Environmental Microbiology,1991,57(7):1920-1928.
[19] BOCK C,KROPPENSTEDT R M,SCHMIDT U,et al.Degradation of prochloraz and 2,4,6-trichlorophenol by environmental bacterial strains [J].Applied Microbiology and Biotechnology,1996,45(1/2):257-262.
[20] LOUIE T M,WEBSTER C M,XUN L.Genetic and biochemical characterization of a 2,4,6-trichlorophenol degradation pathway in Ralstonia eutropha JMP134 [J].Journal of Bacteriology,2002,184(13):3492-3500.
[21] CAO J Y,ZHANG G J,MAO Z S,et al.Influence of electrondonors on the growth and activity of sulfate-reducing bacteria [J].International Journal of Mineral Processing,2012,106:58-64.
[22] CAO L,SUN W H,ZHANG Y T,et al.Competition for electrons between reductive dechlorination and denitri?cation [J].Frontiers of Environmental Science & Engineering,2017,11:14.
(责任编辑:郁慧)

