NaCl胁迫对西瓜幼苗叶绿素荧光、光合特性、渗透调节及酶活性的影响
王中玉,逯 昀,陈 昆
(1.睢县农业农村局,河南睢县476000;2.商丘职业技术学院,河南商丘476000;3.商丘市农林科学院,河南商丘476000)
在黄淮地区,利用大棚和日光温室进行保护地栽培西瓜,可以较常规露地地膜覆盖栽培提前20~40 d上市,以较高的价格占有市场,获取较好的经济效益。随着这种种植模式带来的可观经济收入,让愈来愈多的种植户加入其中,保护地栽培面积呈现逐年增长的态势,但保护地因受棚膜覆盖的影响,常年得不到雨水淋洗,长期的土壤水分蒸发使盐分在土壤表层聚集,从而出现土壤次生盐渍化现象。次生盐渍化对植物危害较大,如细胞发生脱水现象,细胞活性氧增加,细胞膜上的保护酶功能紊乱[1],核酸与蛋白质合成受阻,叶片对CO2的同化能力降低,种子出苗率、株高、干鲜质量[2]、胚根生长[3]等指标均有抑制作用,生长发育和形态建成受到严重影响,果实产量降低、品质变劣,最终影响种植户的经济收入。
本试验从叶绿素荧光、光合特性、渗透调节物质、根系活力及保护酶活性等多个方面,深入研究不同强度的NaCl胁迫对西瓜幼苗生理特性的影响,探究西瓜对盐胁迫的忍受范围,探明西瓜对盐胁迫的响应机制和耐盐特性,为西瓜耐盐品种的选育及保护地西瓜的耐盐栽培提供理论指导。
1 材料和方法
1.1 试验材料
供试西瓜品种为浪潮金山666。
1.2 试验设计
2020年3月将浸种催芽后的西瓜种子播种于32孔基质穴盘中,待西瓜幼苗1叶1心时,选取长势基本一致的健壮幼苗移栽至装有Hoagland营养液的无土栽培框中,栽培框上覆2 cm厚泡沫板,泡沫板上事先打10个孔,将西瓜幼苗固定在栽培孔上,每孔1棵,每框10棵西瓜幼苗,共移栽30框。
试验采用随机区组设计,共设置5个NaCl水平,分别为0(CK)、20、70、120、170 mmol/L,每个水平6框,每2框作1次重复,每水平共3次重复,将不同水平的NaCl溶液分别加入各自的栽培框中,处理20 d后对各指标进行测定。
1.3 测定指标及方法
采用德国WALZ公司生产的PAM-2100便携式调制荧光仪对西瓜幼苗第2片真叶的初始荧光(Fo)、最大荧光(Fm)、光系统Ⅱ实际光化学量子效率(φPSⅡ)和光化学猝灭系数(qP)进行测定。
采用美国产CIRAS-2便携式光合仪测定西瓜幼苗第2片真叶的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)与胞间CO2浓度(Ci),每处理重复3次,取平均值。
游离脯氨酸含量采用磺基水杨酸法测定[4];可溶性糖含量采用蒽酮比色法测定;根系活力采用TTC还原法测定;超氧化物歧化酶(SOD)活性采用NBT还原法测定[5]。
1.4 数据分析
数据处理使用Microsoft Excel 2007软件,数据统计分析使用SAS软件。
2 结果与分析
2.1 盐胁迫对西瓜幼苗叶绿素荧光特性的影响
由表1可知,Fo随NaCl胁迫强度的增加而增大,但在低盐(NaCl 20 mmol/L)胁迫下Fo与对照间差异不显著,这表明低盐胁迫对西瓜幼苗叶绿素的影响不显著,而胁迫增强之后叶绿素受到损伤的程度增加。除NaCl 20 mmol/L处理外,其他处理Fm均低于对照,且随盐胁迫强度的增强呈下降趋势,这表明通过PSⅡ的电子传递能力随盐胁迫的增强而降低。φPSⅡ和qP的变化规律一致,均随盐胁迫强度的增强呈现降低趋势,二者呈现正相关关系,表明西瓜幼苗叶片叶绿素光合反应中心PSⅡ的实际量子产量减少,反应中心的开放程度随盐胁迫强度的增强而降低。
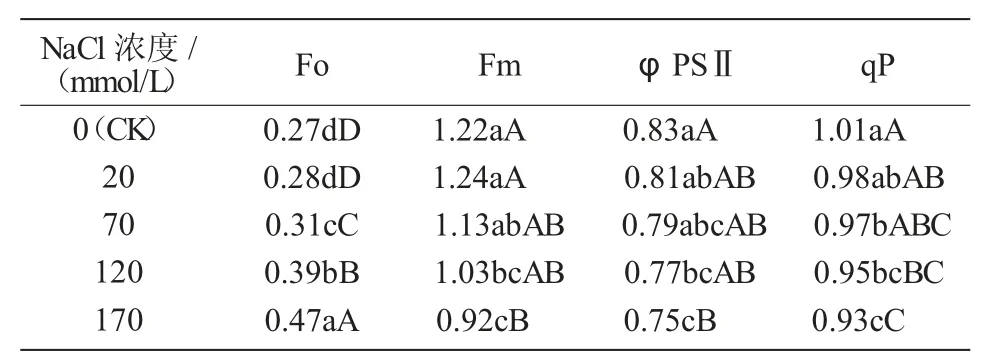
表1 盐胁迫对西瓜幼苗叶绿素荧光特性的影响
2.2 盐胁迫对西瓜幼苗光合特性的影响
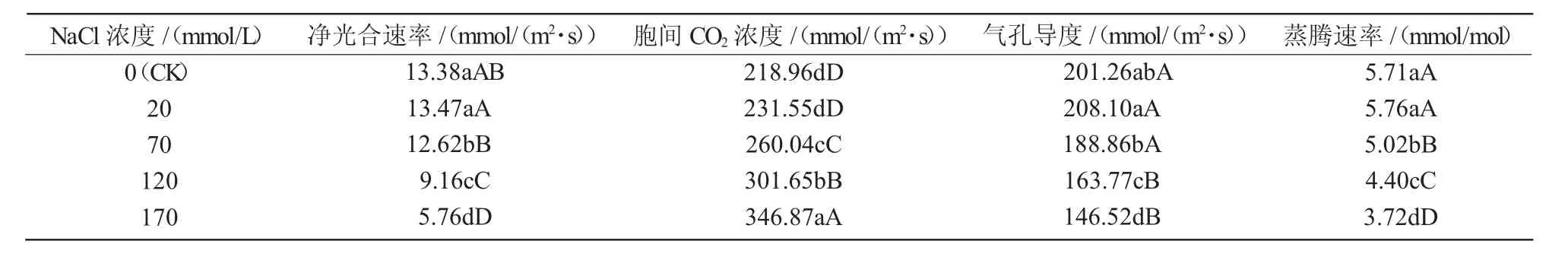
表2 盐胁迫对西瓜幼苗光合特性的影响
从表2可以看出,不同强度的NaCl胁迫对西瓜幼苗叶片光合能力的影响存在差异。低盐(NaCl 20 mmol/L)胁迫下,西瓜幼苗叶片净光合速率、胞间CO2浓度、气孔导度和蒸腾速率均高于对照,但与对照间差异均不显著(P>0.05),这表明低盐胁迫不但不会抑制西瓜幼苗叶片光合能力,还可在一定水平上促进其净光合速率的提高。70~170 mmol/L范围内,净光合速率、气孔导度和蒸腾速率均随NaCl胁迫强度的增强而降低,三者表现出一致的变化规律,具有正相关关系,其中,70、120、170 mmol/L这3个处理的净光合速率较对照分别降低5.68%、46.07%、56.95%,与对照间差异均达极显著(P<0.01)。胞间CO2浓度随盐胁迫强度的增强而增大,其变化规律与净光合速率不一致。
2.3 盐胁迫对西瓜幼苗渗透调节和保护酶活性的影响
由图1可知,在0~170 mmol/L范围内,可溶性渗透调节物质脯氨酸(Pro)和可溶性糖含量均随盐胁迫强度的增强而升高,但在20 mmol/L时与对照差异不显著(P>0.05),这表明低盐胁迫不对细胞内水分平衡造成破坏;70、120、170 mmol/L时西瓜幼苗叶片脯氨酸含量、可溶性糖含量与对照间差异极显著,其中,脯氨酸含量较对照分别提高28.31%、63.17%和93.71%,可溶性糖含量较对照分别提高7.91%、24.77%和70.65%。根系活力随盐胁迫强度的增强呈现先升高再降低的单峰变化规律,在0~20 mmol/L范围内,西瓜幼苗根系活力随NaCl浓度的增加而升高,70~170 mmol/L范围内,根系活力降低。在20 mmol/L时,SOD活性高于对照,但与对照间差异不显著(P>0.05),其他处理均低于对照且与对照间差异极显著(P<0.01)。
3 结论与讨论
叶绿素荧光与光合作用中的电子传递、CO2固定和ATP合成有关[6],叶绿素荧光参数值的变化可以表征光化学反应及用于热耗散等过程的变化[7]。Fo是初始荧光,是光系统Ⅱ反应中心处于完全开放状态时的荧光产量[8]。本试验结果表明,Fo随盐胁迫强度的增强而升高,这可能是因为随着盐胁迫强度的增加光系统Ⅱ逐渐受到损伤,PSⅡ与天线色素(LHC)分离[9],致使光系统Ⅱ的原初光能转换效率下降,荧光和热耗散途径散失的能量在叶绿素所吸收的能量中占比增加,这与张璐颖等[10]在台湾恺木上的结论一致。Fm表示反应中心未进行光合作用时暗适应下的最大荧光产量值。本试验条件下,在NaCl浓度70~170 mmol/L范围内,Fm均显著低于对照,表明高盐胁迫使叶片受到光抑制[11]。φPSⅡ和qP变化一致,均随盐胁迫强度的增强而降低,这表明盐胁迫使西瓜幼苗叶片电子传递效率和对光能转换的能力降低。
净光合速率是表征逆境胁迫强弱的重要生理指标之一,其降低受气孔因素和非气孔因素的影响[12]。本试验结果表明,在低盐(NaCl 20 mmol/L)胁迫下,西瓜幼苗叶片净光合速率高于对照,气孔导度、蒸腾速率和胞间CO2浓度也高于对照,这可能是气孔扩张,蒸腾拉力增大,细胞内的光合原料水分和CO2供应充足,促进了光合能力的提高,说明低盐胁迫下叶片净光合速率的升高与气孔因素有关。而在高盐(NaCl≥70 mmol/L)胁迫下,西瓜幼苗叶片净光合速率下降,气孔导度呈现与之保持一致的下降趋势,但胞间CO2浓度却表现出不降反升的趋势,说明致使高盐胁迫下净光合速率降低的原因与非气孔限制因素有关,这可能是因为高盐胁迫使西瓜幼苗叶片类囊体受损、叶绿素减少,如Na+和Cl-的大量积累对光合酶产生毒害作用,致使光合细胞的光合能力下降[13-14]。
在盐胁迫等逆境环境下,植物细胞可通过对脯氨酸、可溶性糖及无机离子的积累来调节细胞内的渗透势,以维持体内水分的平衡,保护细胞内代谢所需的酶活性。张倩等[15]研究指出,随着盐胁迫强度的增加,棉花幼苗叶片脯氨酸含量逐渐升高。杨志莹等[16]研究发现,NaCl胁迫下,野生玫瑰游离脯氨酸与可溶性糖含量显著高于栽培玫瑰。本试验结果表明,随着盐胁迫强度的增强,西瓜幼苗叶片脯氨酸和可溶性糖含量逐渐升高,且均高于对照,这可能与逆境胁迫下的自我调节有关,渗透调节物质的积累有利于提高植物对逆境环境的抵御能力,试验结果与前人研究一致。作物根系最先感知逆境胁迫,是反映根系生理活动状况的重要指标[17]。陈景明等[18]研究得出,海马齿在低浓度盐胁迫条件下根系活力随盐浓度的增加而提高,高浓度胁迫下呈降低趋势。本试验条件下,西瓜幼苗叶片根系活力随盐胁迫强度的增强呈现先升高再降低的单峰变化规律,试验结果与前人类似,这可能是因为低浓度的NaCl为根系生理活动提供了必要的离子物质,而高浓度的NaCl破坏了根系的正常生理代谢活动,致使三磷酸腺苷供应不足,进而导致根系活力降低。超氧化物歧化酶(SOD)是抗氧化保护酶系统的重要酶类之一,其通过对植物机体内产生的活性氧的清除来保持细胞膜的完整性,增强抗逆性[19]。本研究结果表明,西瓜幼苗SOD活性在低盐胁迫下升高,高盐胁迫下降低,这可能因为低浓度的NaCl增强了抗氧化酶基因在转录水平上的表达[20],而高浓度的盐胁迫下蛋白质分解大于合成,酶活性下降,植物遭受活性氧伤害加重,保护酶系统受到损伤或破坏[21]。

