持续性房颤患者左心房心外膜脂肪组织与低电压及移型区空间关系分析
沈才杰 陆曹杰 潘宇宁 储慧民
已有多项研究证实,左心房心外膜脂肪组织(left atrial epicardial adipose tissue,LA-EAT)与心房颤动发生、发展密切相关,可能系LA-EAT 局部脂肪渗透、促心肌纤维化因子、炎症介质等作用引起心肌组织纤维化所致[1-3]。心肌活检是衡量心肌纤维化的金指标,多项临床研究证实三维电解剖标测系统获取的低电压区(low voltage zone,LVZ)及移型区(transitional zone,TZ)参数可作为一种非损伤性替代指标[4-5],越来越多的临床电生理医师采用基于LVZ 及TZ 的射频导管消融(下称消融)策略治疗心房颤动。本研究旨在明确持续性房颤(persistent atrial fibrillation,PeAF) 患者 LA-EAT 与 LVZ 及 TZ空间的关系,现将结果报道如下。
1 对象和方法
1.1 对象 收集2017 年1 月至2019 年6 月宁波市第一医院择期行消融的非瓣膜病PeAF(PeAF 指持续时间>7 d,不能自行复律)患者16 例,男女各8例,年龄 48~67(56.45±6.63)岁;病程 1~7.2(3.92±1.84)年;体重指数 20.7~28.6(25.65±2.78)kg/m2;心房颤动脑卒中风险评分(CHA2DS2VASc 评分)为1~5(2.34±0.95)分;使用他汀类药物 9 例(56.25%),血管紧张素转化酶抑制剂/血管紧张素Ⅱ受体拮抗剂6 例(37.5%);左心房内径 35~47(40.18±4.13)mm;左心室射血分数50~67(56.85±6.16)%。排除标准:(1)严重的器质性心脏病,需心外科干预的先天性心脏病、瓣膜性心脏病、肥厚型心脏病,急性冠脉综合征;(2)严重的肝肾功能不全;(3)年龄>80 岁,(4)甲状腺功能亢进;(5)造影剂过敏;(6)抗凝禁忌证;(7)既往有心外科手术或针对左心房进行消融病史。所有患者消融前停用抗心律失常药物至少5 个半衰期,于消融前签署知情同意书。
1.2 方法
1.2.1 LA-EAT 体积测定 所有患者消融术前应用64 层多排螺旋CT(荷兰飞利浦公司)测定LA-EAT体积。对患者注射碘帕醇(370mg I/mL)50ml 后,以肺静脉及左心房顶部为扫描起点,设置扫描参数:电压120 kV,电流50 mA,层厚0.6 mm。使用自带工作站重建影像,人工逐层标记出心外膜,剔除二尖瓣环前的左心室周心外膜脂肪组织、右肺上静脉旁右心房周外1 cm 及冠状窦下缘以下的心外膜脂肪组织,剩余部分即为LA-EAT,设定-200~-50 HU 的CT值为脂肪组织,人为分成6 个区域(插页图1A 及1B):后壁(上界为上肺静脉最高缘内1 cm 连线,下界为下肺静脉内1 cm 下缘连线,左右界为左肺静脉和右肺静脉间最外缘连线)、前壁(上界为上肺静脉最高缘内1 cm 连线,下界二尖瓣环,右界为右上肺静脉最高缘与最右侧缘中点至二尖瓣环前壁,左界为经左心耳底部右缘连接后壁前界线与肺静脉交界点至二尖瓣环前壁)、底部(上界为下肺静脉下缘,下界为二尖瓣环后壁,左右界分别为对应下肺静脉与二尖瓣环交界处)、间隔部(左界为前壁右界,右界为右肺静脉外缘连接处,上界为前壁线前缘,下界为二尖瓣环),剩余区域为左心耳+左侧壁,逐层扫描勾勒LA-EAT 分布区域(插页图1C 及1D),测定总LA-EAT 及各区域 LA-EAT 体积。
1.2.2 LVZ+TZ 面积测定 患者在静脉诱导麻醉下,经股静脉及房间隔后将10 级标测导管(LASSO,美国强生公司) 及消融导管(NAVI-STAR,Thermo-cool,美国强生公司)放置于左心房内,借助三维电解剖标测系统(CARTO,美国强生公司)构建肺静脉前庭及左心房电解剖图。随后300J 体外直流电复律,转为窦性心律后,借助腔内导管进行左心房内高密度电压标测(>130 点),标测点距离阈值<10 mm,设置双极电压滤波为30~300 Hz,利用离线分析软件计算出左心房内各点的电压值,LVZ 设定为0.1 mV≤双极电压<0.4 mV,TZ 设定为0.4 mV≤双极电压<1.3 mV(插页图2)[4],根据前述区域划分方法,利用面积计算工具结合CT Merge 测定各区域LVZ+TZ 与左心房的面积比及各区域LA-EAT 对应LVZ+TZ 重叠率。
1.3 统计学处理 采用SPSS25.0 统计软件,正态分布的计量资料以表示,多组比较采用单因素方差分析(One-Way ANOVA),两两比较采用LSD-t检验。计数资料以百分率表示,采用χ2检验或Fisher 精确检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各区域LA-EAT 体积及LVZ+TZ 面积比较见表1。
由表1 可见,LA-EAT 总体积各部位中,后壁体积最大,其次为前壁及侧壁+左心耳,间隔与底部体积最小。前壁、侧壁+左心耳、间隔、底部体积与后壁比较,差异均有统计学意义(均P<0.01)。前壁、侧壁+左心耳体积与间隔、底部比较,差异均有统计学意义(均P<0.01)。(LVZ+TZ)/左心房面积中,后壁比值最大,其次为侧壁+左心耳、前壁及间隔,底部比值最小。前壁、侧壁+左心耳、间隔、底部比值与后壁比较,差异均有统计学意义(均P<0.01),侧壁+左心耳比值大于前壁与间隔及底部,差异有统计学意义(P<0.01),前壁与间隔比值大于底部,差异均有统计学意义(均P<0.01)。

表1 各区域LA-EAT 总体积及LVZ+TZ 面积比较
2.2 各区域LA-EAT 与LVZ+TZ 重叠率比较 见表2。
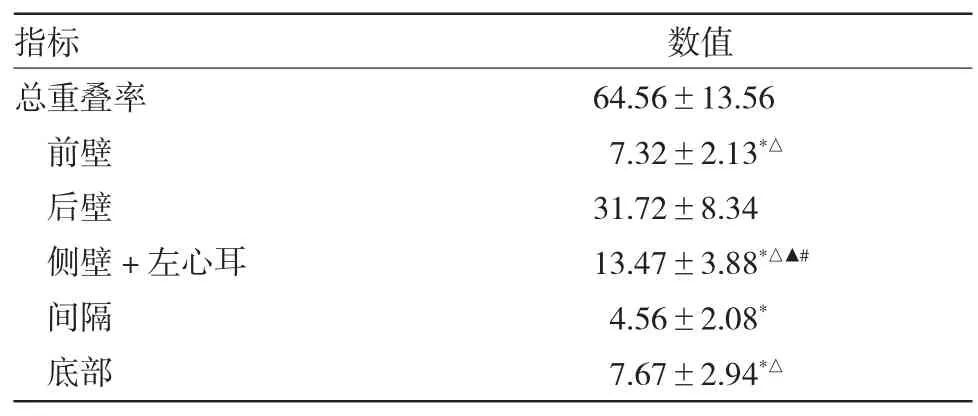
表2 各区域LA-EAT 与LVZ+TZ 重叠率(%)
由表 2 可见,LA-EAT 与 LVZ+TZ 中,后壁重叠率最大,其次为侧壁+左心耳、前壁与底部,间隔最小。前壁、侧壁+左心耳、间隔、底部重叠率与后壁比较,差异均有统计学意义(均P<0.01),侧壁+左心耳与前壁、间隔及底部重叠率比较,差异均有统计学意义(P<0.01),侧壁+左心耳与底部、前壁重叠率比较,差异均有统计学意义(均P<0.01)。
3 讨论
LA-EAT 是位于心包膜脏层与心肌间的特殊脂肪组织,可分泌产生多种炎性因子、生长因子等生物活性因子作用于左心房,引起心肌组织电解剖重构[2-3]。有研究证实在左心房扩大及左心耳收缩功能减退的心房颤动患者中,C 反应蛋白水平与心房颤动持续时间呈正相关[6]。另有学者借助正电子发射断层扫描评价心外膜脂肪组织对氟脱氧葡萄糖摄取水平,间接证实心房颤动患者的心外膜脂肪组织炎症活性更高[7]。Pokushalov 等学者[8]进一步发现接受冠状动脉搭桥术的阵发性房颤患者中,其LA-EAT与迷走神经节空间位置高度重叠,使用肉毒毒素破坏LA-EAT 后,其远期随访所有患者均维持窦性心律,提示LA-EAT 也可通过迷走神经节途径形成心房颤动的“温床”。Greif[9]、Shin 等[10]学者研究表明LA-EAT 体积大小与心房颤动发病率、左心房重构及容积密切相关,部分研究证实肺静脉区域及后壁区域LA-EAT 厚度最大,提示该区域可能与心房颤动电解剖重构有关[11-12]。本研究以LA-EAT 体积作为参数,发现PeAF 患者后壁及侧壁+左心耳区域LA-EAT 体积较大,这些区域已被证实为心房颤动触发及维持的常见区域[13-15]。
LA-EAT 致电解剖重构时,可导致传导速度减慢及异质性传导使电压降低[16-17],与广泛的LVZ、复杂碎裂电位及转子发生有关,易导致心房颤动的发生和维持[18-20]。多项临床研究已证实三维电解剖标测系统可稳定测定心房颤动患者LVZ+TZ,后者可作为一种可靠且非损伤性的心肌纤维化评价指标,根据心肌纤维化程度不同,可分为LVZ 区及TZ 区,多数研究将前者电压定位为0.5~1.5 mV,后者电压<0.5 mV,但中国人群评估LVZ 电压值0.4~1.3 mV 及TZ 电压值<0.4 mV 更为适宜,针对LVZ 及TZ 消融被证实是一种有效的改良心房颤动基质策略[4-5,21]。另有研究表明LA-EAT 与心房颤动患者消融后复发相关,而损坏LA-EAT 有利于提高手术即刻成功率及远期预后[22-23]。本研究发现LVZ+TZ 与LA-EAT 分布以及两者重叠率均以后壁为主,说明LA-EAT 与LVZ+TZ 空间分布紧密相关,提示积极干预后壁心外膜脂肪组织或LVZ+TZ 区域对心房颤动消融可能非常关键,针对心房颤动患者LVZ 或TZ 消融有效性可能很大程度依赖于LA-EAT 与LVZ+TZ 重叠程度。本研究的局限性在于以下几个方面:仅以PeAF 患者作为研究对象的小样本的回顾性研究,未设置对照组,64 排多层螺旋CT 的分辨率可能影响LA-EAT 体积测定精确度,会在今后行进一步研究。