2020 ISHNE/HRS/EHRA/APHRS关于移动医疗用于心律失常管理的专家共识声明:心脏节律专家的数字医疗工具(一)
国际动态心电图和非侵入性心电学会 心律协会 欧洲心律协会 亚太心律协会
1 绪论
1.1 适用范围及合理性 数字健康是一个笼统的术语,用于描述数字信息、数据和通信技术的应用以收集、共享和分析健康信息,从而改善患者健康、患者教育和患者获得的医疗保健服务(https://www.fcc.gov/general/five-questions-you-can-ask-yourdoctorabout-digital-health#ab)(Turakhia,2016)。这一概念包括了远程医疗、电子健康记录、可植入监控设备、可穿戴传感器的数据、分析论和人工智能、行为健康和个性化医疗。其中,移动医疗(mHealth)是数字健康的组成部分。世界卫生组织将mHealth 定义为“移动设备支持的医疗和公共卫生实践,例如移动电话、患者监护设备、个人数字助理以及其他无线设备(https://apps.who.int/gb/ebwha/pdf_files/WHA71/A71)。近年来,这些设备的使用在具有较强健康意识的消费者中激增,并可能会在更正规的医疗环境中继续实现快速扩展和整合。
基于远程心血管可植入电子设备(cardiovascular implantable electronic device,CIED),如起搏器、植入型心律转复除颤器(implantable cardioverter de-fibrillator,ICD) 进行远程监测的经验,mHealth 直观地流向了心律失常管理领域的卫生专业人员(Varma 2010)。在过去的10~15 年中,许多研究采集的大量数据证实了远程技术辅助随访的获益,并将其确立为治疗标准(Varma 2013,Slotwiner 2019)。然而,CIED 的远程监测结果可能无法立刻被归类为mHealth。例如,前者仅限于患有心脏病(主要是心律不齐和心力衰竭)的患者,即一类已被定义为患者的人群。CIED 远程监测的治疗途径也很明确,在美国和世界许多其他地方都已能开具账单并获得报销。相比之下,mHealth 有所区别:mHealth 作为可渗透到社会大多数领域的消费产品的形式,被提供给包括未经正规医学诊断的个人;mHealth 可能被应用于更广泛的疾病;mHealth 的数据可以来源于使用者自我检测,而非由医疗专业人员评估产生;mHealth 尚无成熟的报销模式。实际上,某些心律监测功能可能会从为不同目的购买的产品中间接获得并被使用。相反,在医学领域,医疗保健专业人员(health care professionals,HCPs)基本不会为患者开具 mHealth 应用,因为通常缺乏可用于疾病管理的验证,并且治疗途径仍然多种多样或定义不清。然而,如果实施得当,CIED 和mHealth 两个领域的融合将带来广泛的机会:人群筛查、未诊断疾病监测和纵向疾病管理的拓展;更重要的是,允许患者参与自我治疗过程,使大量治疗过程实现异步化和虚拟化。它的价值和整合程度将取决于不同国家的不同医疗体系。
只有当获取的信息能帮助决策者改善预后时,mHealth 才有价值。这需要一条清晰的信息流和可操作路径。此外,所有利益相关者都需要了解其中的逻辑链,以便每个人都知道会发生什么,并明确自己的职责(可能包括设备供应商)。同样,基于监测获取的信息而采取的措施应该对所有的利益相关者保持透明。例如,对于一位通过可穿戴设备记录并传输不规则心律的患者,应遵循指定的决策过程向其明确该心律是否为心房颤动,是否需要额外的诊断测试以明确,该测试将如何安排,最后应该在合理的时间窗内完成什么治疗?显然,由于医疗测试及其引起的消费者内心的焦虑导致开销增大的风险是存在的。CIED 的经验开创了先例:研究表明,通过将远程监测整合到针对特定疾病管理的清晰逻辑框架中(如用于心脏再同步化治疗患者的IN-TIME 远程监控,CARDIOMEMS)(Abraham 2011,Hindricks2014,Varma2013),疾病预后得到了改善。但试图使用mHealth复制这样的成功给医疗服务提供者带来了挑战,且远远超出了监控和传输设备的技术能力。这样的改变是困难的,除了存在要解决这类变化所需的组织性问题外,报销可能会有推动或阻碍作用。而COVID-19 大流行提高了对这些因素的认知:为了减少患者与医疗保健提供者的接触并同时继续提供医疗保健服务,远程医疗解决方案被广泛倡导(Varma 2020)。
鉴于可穿戴设备和其他移动设备技术的快速发展和普及,以及对mHealth 基础结构的分析和规划的需求,国际动态心电图和非侵入性心电学会(International Society for Holter and Noninvasive Electrocardiology,ISHNE)、心律协会(Heart Rhythm Society,HRS)、欧洲心律协会(European Heart Rhythm Association,EHRA)和亚太心律协会(Asia-Pacific Heart Rhythm Society,APHRS)认识到这一共识性声明的必要。本文旨在定义最新的mHealth 技术及其在心律不齐管理中的应用,并探讨未来临床应用的方向。因此,本文件的范围包括对当前可用或正在开发的不同mHealth 技术的讨论;获取与健康有关的数据;相关数据的应用,包括疾病识别和管理、临床试验;患者的观点;为了有效应用mHealth 技术必须致力解决的问题。此外,讨论部分进一步拓展到了mHealth用于合并症的管理,这些合并症已被越来越多地认为会影响心律失常(如肥胖症和睡眠呼吸暂停),而这也正在成为心律专业人员的责任(Chung 2020)。
2 mHealth 技术
利用mHealth 技术,用户可使用移动通信设备内部自带或附加的专业应用软件和传感器监测、收集和分享生理和健康数据,见图1。应用范围包括诊断、决策支持、疾病管理、药物依从性评估以及教育和临床研究。其在心律失常中的应用主要有:(1)诊断:评估有症状的患者是否由心律失常导致;评估心律失常患者对药物和侵入性治疗方式的反应。(2)筛查:重点应用于心房颤动。

图1 根据适应证进行心律失常监测的mHealth 设备(传统的可穿戴监测器可用于特定的短时间监测,优点是能够连续监测和使用多导联,这对于心律失常的鉴别非常重要)
2.1 动态心电图监测 动态心电图监测是最基础的诊断方法,技术的选择和时间范围取决于是否有症状(如心悸、晕厥)以及症状发生的频率。目前,心房颤动管理得到了较多的关注。具有“连续”或“间歇”记录能力的传统动态心电图装置(如动态心电图、无线心脏遥测系统)提高了对疑似心律失常的诊断率,同时也存在监测时间不足等局限性,对于心房颤动的检测缺乏灵敏度或特异度,以及对患者造成的不便仍是重要的实施障碍(Steinberg 2017)。可植入式心电记录仪(implantable loop recorders,ILRs)可以连续监测心律,但仅能记录由患者或自动算法激活前后的心电图。目前已有几种已经获批准的ILR设备(Musat 2018,Sakhi 2019,Tomson 2015),并有多项研究来评估这些设备的诊断准确性(Ciconte 2017,Hindricks 2010,Mittal 2016,Nolker 2016,Sanders 2016)。由于ILRs 具有侵入性且价格昂贵,一些功能可能会转移到mHealth。
2.2 基于新mHealth 模式的心律失常监测 具体可分为以下两类:(1)记录心电图(单导联或多导联,间歇或连续形式不同持续时间的模式);(2)使用非心电图技术,如光电容积描记术(photoplethysmography,PPG)。目前缺少对数据的验证(或底层算法)和专业评审机制(如安装心内植入型电子装置和无线心脏遥测系统)。这项新的技术,如果没有专业医生操作,就可能会出现未知的重大事件和(或)过度治疗(如心房颤动假阳性)的风险。
2.2.1 基于心电图的设备 在基于心电图的各种设备中,手持式和贴片式系统已经过最广泛的验证。
2.2.1.1 手持设备 几种独立的手持设备无需额外的硬件即可运行,在其两侧带有2 个或3 个心电图电极,会产生一段30 s~1 min 的单导联或多导联心电图记录,其中一些心电图记录会在监视器上显示。不同人群的研究已经证明了通过短期节律监测手持设备对心房颤动检测诊断的准确性(Desteghe 2017,Doliwa 2009,Hendrikx 2014,Kaasenbrood 2016,Poulsen 2017,Svennberg 2017,Tvernier 2018,Tieleman 2014,Vaes 2014),见表 1。
2.2.1.2 穿戴式贴片 商业化的贴片最多可以使用14 d(Barrett 2014,Turakhia 2013)。与基于导联系统的黏性电极不同,防水贴片在监测期间不用移除,从而获得更长的携带时间、更多可分析数据,而且没有导联反转误差。监测期过后,该设备将返还给制造商进行数据提取,通过专有算法进行分析,并由医疗技术人员进一步对潜在的心律失常进行二次分析,之后诊断报告将发送给负责治疗的医师。由于贴片没有外部导联,因此与传统的动态心电图监测仪相比,佩戴起来感觉更舒适,且有94%的患者相较于动态心电图监测仪更喜欢贴片设备(Barrett 2014)。较新的贴片系统加入了接近实时的分析和连续传送数据至云端的功能,从而可以促进更快速的数据收集和诊断。多参数监测可通过使用长达3 个月的贴片来实现(Stehlik 2020)。
2.2.1.3 生物纺织材料 最初设计纺织材料相关的心电监测系统是为了满足监测过程中患者的舒适性及患者体力活动的需求。这些材质的背心和背带可以较好地贴合患者,尤其是对于那些需要进行剧烈活动的患者,若使用有线监测系统则会大大限制此类患者的活动。这些生物医学装置通过将电极嵌入衣物中采集心电信号,并同时可以无创采集最长30 d的心电图数据。单导联/多导联(最多12 导联)数据采集和事件激活装置都是可行的(Eliot 2019,Eysenck 2019,Fabregat 2014,Feito 2019,Pagoloa 2018)。可穿戴式心脏除颤器可以传输2 通道心电图数据至一个在线患者管理数据库,该数据可以远程监测高风险患者。近期出现的融合心音评估技术可能预测心力衰竭失代偿情况并将在前瞻性研究中进一步论证(HEARIT-Reg试验,临床试验编号:NCT03203629)。
2.2.1.4 智能手机和智能手机相关装置 近期非穿戴式装置融合智能手机方案已经出现。这些装置(Varma 2020,表1)允许使用者采集“随机检查”单通道最长30 s 的心电图,当其中一个手指放在两个电极上(通常位于手机外壳和外部卡)时可以记录更长时间的心电图,见图2。心电图信号通过手机内置的综合分析应用程序来进行无线传输。心电数据可以在手机上分析、储存或者根据使用者的建议发送给专家进行分析。大部分与心房颤动相关。

图2 iPhone 手机的心电图应用(A:手指尖端记录;B:胸前的卡记录)
当P 波出现或者不出现且合并不规则的RR 间期,自动诊断程序可以判定心电记录为“心房颤动可能”。当探测到过多的干扰判定为“不可判读”,这可能与运动过度、电极片和皮肤接触不良相关。不同AliveCor 自动诊断程序版本已被评估(Chan 2016,Chan 2017,Desteghe 2017,Lowres 2014,Tarakji 2015),同时该程序也作为风险人群的筛选工具(Halcox 2017,Lowers 2014)。在苹果手表中,当心率波动在50~150 次/min 时,利用程序诊断的有效性较高。当心率在此区间,认为该患者很少有异常心搏,而且每次搏动的心电图形态、宽度均正常。
灵敏度和特异度与软件、所研究的人群(如老年患者具有更多的震颤情况,更难抓握心电监测装置,会导致更多的不可判读)以及研究人群的心房颤动发生率有关。这提示使用该类装置需要对每个可能的使用对象进行更好的评估。近期一项新的6 导联心电图已被研发成功,该心电图可进行30 s 的心电记录。也可以从中获得QT 间期(https://cardiacrhyth mnews.com/kardiamobile-6l-can-be-used-to-measure-qt-duration-in-covid-19-patients/)(Chung2015,Garabelli 2016)。然而,仍缺乏一些参数,如单导联记录的矫正QT 间期能否可靠替代12 导联心电图等相关的信息。在一项研究中智能手机监测的单导联心电图低估了 QT 间期(Koltowski 2019)。
其局限性在于:(1)使用单导联装置。对于老年患者或肢体受限患者(震颤、脑卒中等)进行无噪声记录可能难度很高。(2)尽管心电诊断算法受到监测,但这些算法可能经常误判心律失常,将窦性心律判为心房颤动或者相反,这在没有临床医生确认情况下可能导致有害后果(Bumgarner 2018)。因此一些装置在诊断评估上具有一定的局限性。比如当心率超过150 次/min 或者低于50 次/min 时,苹果手表无法评估心房颤动的心电图(https://www.apple.com/healthcare/docs/site/Apple_Watch_Arrhythmia_De tection.pdf),因此美国食品药品管理局仅批准其在非心房颤动人群中使用(https://support.apple.com/en-us/HT208931,accessed January 2,2020,见图 3)。(3)对于此类手表,心电图诊断是一个医疗确认前的预诊断,当没有医生审查时并不适合使用。(4)鉴别其他心律失常(室性期前收缩、房性期前收缩、室性心动过速)目前尚不可行。
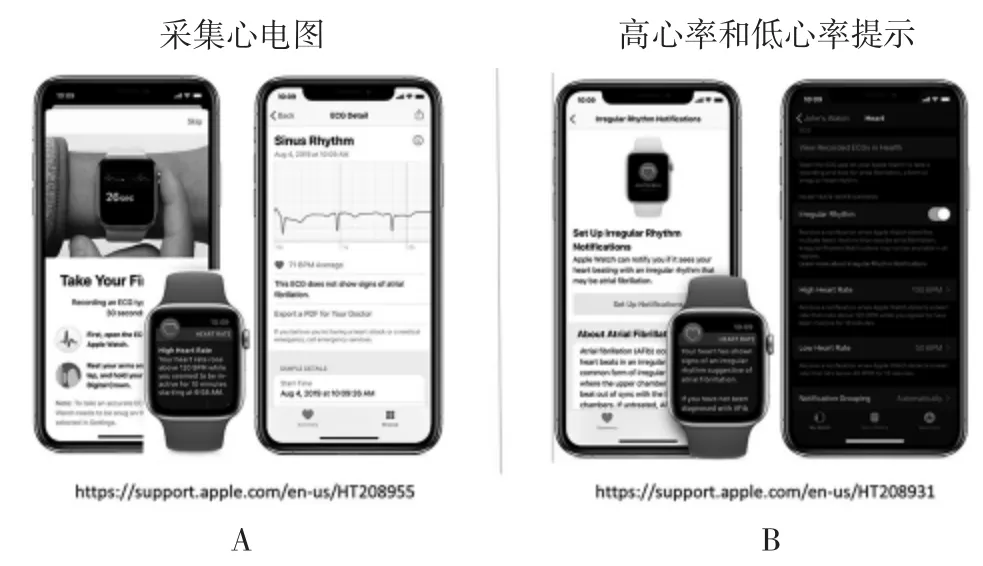
图3 iPhone 手机的心电图应用(A:手指尖端记录;B:胸前的卡记录)
2.2.2 非基于心电图的mHealth 技术
2.2.2.1 PPG PPG 是通过下载应用程序进而使用大多数消费型设备(智能手表和健身手环)上已经存在的硬件来检测心律失常。通过使用光源和光电检测器检测光强度变化能够反映皮肤表面(如指尖、耳垂或面部)组织血容量的脉搏波形(Conroy 2017,McManus 2013),随后通过自动算法来检测心房颤动。
这项技术已经应用于智能手机,例如通过使用手机摄像头来测量指尖脉搏波形。快速且不规律传导的心房颤动可能会产生不同的脉压进而影响心律失常的检测准确性(Choi 2017,McManus 2013,Mc-Manus 2016,Proesmans 2019),且基于智能手机的PPG 应用程序已经用作高危人群心房颤动检测和普通人群心律失常的筛查工具(Verbrugge 2019)。
PPG 技术也已被用于智能手表中测量心率和检测心脏节律(Dorr 2019,Guo 2019)。有研究者开发了128 Hz 同步记录的包括单通道心电图、多波长PPG 和三轴加速度计在内的手环原型(Nemati 2016),另一些研究者则使用基于PPG 传感器的深度神经网络技术检测心房颤动(https://www.mobihealthnews.com/content/study-apple-watch-paired- de ep-neural-network-detectsatrial-fibrillation-97-perce nt-accuracy;https:mrhythmstudy.org)。
2.2.2.2 示波测量法 当脉搏不规则时,血压测量结果可能不稳定,而自动示波血压测量仪则利用该特性以算法导出心脏节律的规律(Chen 2017)。自动血压监测仪已用于机会性心房颤动检测。研究表明,来自两家制造商的6 种设备的检测灵敏度和特异度均超过85%(Kane 2016)。有几项研究探讨了该设备作为筛查工具的诊断准确性(Chan 2017,Chen 2017,Gandolfo 2015,Kearley 2014,Marazzi 2012,Stergiou 2009,Wiesel 2009,Wiesel 2014) 和可行性(Chan 2017,Omboni 2016,Wiesel 2017)。
2.2.2.3 心机械图 心机械图描记技术可利用加速计和陀螺仪来感知心脏的机械活动。一项概念验证研究(Jaakkola 2018)通过在仰卧患者的胸部放置内置有加速器和陀螺仪的智能手机(索尼Experia)来检测心脏的机械运动,并与胸导联心电图对照后发现,以此方式记录的心机械图检测心房颤动的技术精度可接近心电监测。或许,若能利用置于口袋中的检测装置完成检测则更有实用价值,但也面临着如人体运动(如行走)带来的随身物品移动所混淆的问题。
2.2.2.4 非接触式视频容积描记技术 针对呼吸和心率的非接触式视频描记技术已诞生近15 年(Takano 2007,Verkruysse 2008)。非接触式视频容积描记技术可以从记录人体皮肤(特别是面部皮肤)的标准数字红绿蓝(red-green-blue,RGB)视频中提取光电容积描记信号。目前开展的数项研究通过开发更高灵敏度的方法来检测每一次心脏搏动相应的光电容积描记信号并对其变异性进行分析。此类设备以摄像机的色调空间为基础(Dautov 2018,Tsouri 2015),故其可以轻松集成到任何带有摄像头的便携式计算机设备(如智能手机、平板电脑等)中,不需要进一步使用和分发物理设备,故而该技术的推广非常简单。实现该技术的要点之一是进行视频记录时的稳定聚焦,因此对移动目标的分析仍然是目前的一大挑战。另外一项关键的注意事项是避免直接记录、发送或传输患者的真实影像学视频,从而保护隐私和尊严。基于视频记录技术的远程医疗也引发了一系列新的社会和伦理问题。此项技术大规模开展时,有关隐私、保密以及法律和道德义务的问题仍是需要考虑的关键因素(Turakhia 2019)。
2.2.2.5 智能音箱 目前已有研究报道利用商品化的智能音箱进行濒死呼吸识别的系统(Chan 2019,Wang 2019)。通过将智能音箱转换成声纳设备,其发射听域内声波并对返回波进行分析,可以识别异常心率模式。此类技术目前并未实际应用于消费产品,但具有广泛的应用前景。
3 mHealth 在心律失常方面的应用
大多数心悸和头晕患者通常使用前面所述的各种技术进行评估(Steinberg 2017)。该类智能设备可能对儿科患者也有用(Gropler 2018)。
3.1 心房颤动 新的数字医疗和传感器技术能早期识别心房颤动。这些优势可以用来服务于几类人群:普通人群的筛查、已确诊患者的管理、疗效随访以及心房颤动患者合并症的管理和生活方式的改善,见图4。
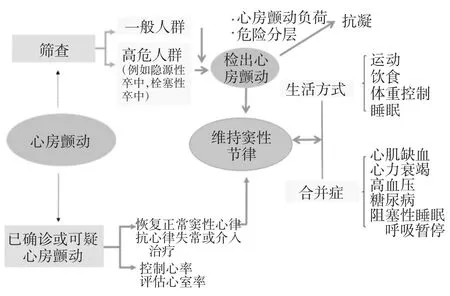
图4 mHealth 与心房颤动(应用于普通人群或高危人群筛查心房颤动,对合并症和生活方式管理以及对确诊心房颤动患者的治疗管理)
3.1.1 心房颤动的筛查 许多用于确诊心房颤动的技术已可以直接用于那些尚未明确诊断的人群。消费者会自发选择使用这些技术(例如智能手表或连接智能手机的心电记录仪)。因此,消费者驱动的心房颤动识别与医疗保健系统启动的心房颤动筛查不同。这些设备进行的心房颤动识别需要进一步确认,因为这些心房颤动筛查工具的特异度并不稳定(表2),从而增加了在低风险患病人群中阳性率假性偏高的可能性以及进行不必要治疗的风险。最近的系统综述显示,已有近500 项研究评估了用于检测心房颤动的移动设备的准确性(Giebel 2019,Lowres 2019,O’Sullivan 2020)。这些设备的监测能力因所使用的技术、使用环境和研究人群而异。最近还报道了两个大规模的筛查试验。
到目前为止,还没有针对筛查发现的心房颤动患者卒中、死亡等终点的大规模临床试验。尽管心房颤动的偶然诊断似乎与卒中风险增加和口服抗凝药治疗的保护作用有关(Freedman 2016,Martinez 2014,Tsivgoulis 2019)。偶然性诊断心房颤动是否使患者获益的临床试验仍在进行中(Gudmundsdottir 2019,Steinhubl 2018,Svennberg 2015,www.heartline.com)。这项工作解决了一个问题,即通过筛查检测到的心房颤动可能会识别出固有低风险的患者,因此抗凝治疗的疗效及其风险获益比需要重新校准。欧洲和美国的指南明确建议对年龄≥65 岁未确诊心房颤动的患者进行机会性筛查(Freedman 2017,January 2019,Kirchoff 2016)。另一方面,美国预防专家工作组目前对用心电图进行系统性心房颤动筛查的建议是“依据不足”(Jonas 2018)。
3.1.2 识别心房颤动高危人群
3.1.2.1 隐源性卒中/ 短暂性脑缺血发作 高达1/3 的缺血性卒中是由心房颤动介导的脑栓塞引起(Hannon 2010)。因此,最近的指南建议对卒中后心房颤动进行长期监测(January 2019,Kirchhof 2016,Schnabel 2019),但卒中后心房颤动的筛查结果不一(Kishore 2014,Sanna 2014,Zungsontiporn 2018)。一项荟萃研究显示,对卒中后的患者采用分步法监测心房颤动,结果有23.7%的患者检测出心房颤动(Sposato 2015),而对两项随机研究和两项观察性研究的联合分析显示,在长期心电监测后,卒中复发率降低了55%(Tsivgoulis 2019)。目前尚不清楚启动抗凝的最佳心房颤动持续时间的阈值。
在未知来源的栓塞性卒中(embolic strokes of unknown source,ESUS)中,未诊断的心房颤动和其它血栓来源的风险很高,这促使人们开展相关研究来评估经验性新型口服抗凝药治疗是否较不需要检测心房颤动的抗血小板治疗更有效。其中NAVIGATE ESUS(Hart 2018)和 RESPECT-ESUS(Diener 2018)研究并没有显示经验性服用新型口服抗凝药的患者卒中复发减少。第3 项相关研究正在进行中,该研究纳入的是提示有心房心肌病的患者 [心房增大、N 末端脑钠肽前体(N terminal pro B type na- triuretic peptide,NT-proBNP)水平升高或P 波增宽](Kamel 2019)。
3.1.2.2 其他高危患者 mHealth 心电记录仪可以让常见的设备(包括基于智能手机的应用程序或手表)在长时间内进行频繁而短暂的记录(如30 s)。这些设备特别适合捕捉间歇性或非持续性心律失常(Charitos 2012,Yano 2016)。心房颤动负荷被认为是中风的一个强有力的独立预测因子(Chen 2018),尽管通过植入装置可以精确地检测(Varma 2005),但不容易从间歇性心电数据中计算出来。

表2 已验证的不同mHealth 技术示例性研究
mHealth 记录的心电图对新诊断心房颤动具有重要意义,显著优于诊间心电图诊断(表3)。而存在风险因素的患者,如年龄较大和具有较高CHA2DS2-VASc评分者,通常检出率会提高。Lowres 等在荟萃分析中发现心房颤动的新检出率随着年龄的增长逐渐增加,从<60 岁的0.34%增加到≥85 岁的2.73%。重要的是,该研究中筛查心房颤动符合抗凝适应证的受试者中<60 岁者 1 089 例,而≥65 岁者仅 83 例。
3.1.3 对已确诊心房颤动患者的诊断 mHealth 对于已确诊的心房颤动患者具有重要的意义。尽管一些研究成功地报道了新型设备检测心房颤动的灵敏度和特异度,但迄今为止还没有研究评估mHealth干预对临床结局的影响。通过苹果手机帮助评估心房颤动技术的研究(iHEART)是一个单中心、前瞻性、随机对照试验,而Heartline 研究则旨在实现这一 目 标 (Caceres 2019,Hickey 2016,https://www.heartline.com)
3.1.4 心房颤动的治疗
3.1.4.1 心房颤动负荷 目前的抗凝指南主要基于心房颤动的诊断以及存在的危险因素,而未考虑心房颤动的持续时间、症状或负荷(January 2019)。然而,越来越多的人认识到心房颤动负荷的重要性,例如与持续性房颤相比,阵发性房颤的血栓栓塞风险更小(Chen 2018)。心房颤动负荷可以用%/监测时间、最长持续时间和发作频率来描述。检索数据有助于对自然病史和相关后遗症的深入了解(Healey 2012,Kaplan 2019,van Gelder2017,Varma 2005)。这促进了口服抗凝药干预试验的开展,用于评估基于心房颤动持续时间的应用在减少卒中方面的价值(Lopes 2017,Martin 2015)。这些研究表明存在一个阈值,低于该阈值血栓栓塞性卒中的风险较低,且这样的风险获益比可能不值得长期口服抗凝剂。通过设备检测,持续6 min~24 h 的“亚临床”心房高频率发作与卒中风险增加有关,但其绝对风险远低于仅根据危险因素所预期的风险(Glotzer 2003,Healey 2012,van Gelder 2017)。而是否需要在高危人群中进行抗凝治疗是目前一些研究所关注的(Kirchoff 2017,Lopes 2017,van Gelder 2017)。用数字健康工具进行心房颤动检测可以进一步了解无植入设备适应证患者的情况。mHealth 将心房颤动筛查扩展到无心血管疾病的年轻患者,他们的血栓栓塞风险可能较低。使用14 d 贴片监测心房颤动负荷高的患者(定义为:≥11.4%的监测时间,平均持续时间为11.7 h)与心房颤动负荷低的患者相比,血栓栓塞事件发生率增加(Go 2018)。是否使用口服抗凝药仍存在较大差异,特别是对于通过设备检测到的心房颤动(Perino 2019)。这可能是由于临床对于最佳治疗临界点仍不确定。尽管观察性研究的数据表明口服抗凝药与发作>24 h 的心房颤动卒中风险下降有关,可能与发作6~24 h 的心房颤动卒中风险降低有关(Perino 2019)。目前还没有前瞻性研究验证的临界点或风险模型将心房颤动负荷纳入到卒中预防治疗的决策中。关键的知识缺陷为判定mHealth 检测的心房颤动的特征(持续时间、发作次数/密度)和抗凝的危险因素。
3.1.4.2 节律控制和心率控制 在通过移动医疗设备检测是否有心房颤动时,就应启动mHealth 监测正常窦性心律、QT 间期[对某些抗心律失常药物非常重要(Garebelli 2016)]以及考虑心血管危险因素干预和改变生活习惯,因为相关合并症可能会影响心房颤动的发生和自然病程。在心率控制方面,欧洲心脏病学会建议静息心率目标为<100~110 次/min,而美国心脏病学会(American College of Cardiology,ACC)/美国心脏协会(American Heart Association,AHA)/HRS 指南建议静息心率目标为<80 次/min。mHealth技术可用于评估长时间心房颤动的心室率,并评估不同心率控制法的效果(January 2019,Kirchoff 2016)。
3.2 心脏性猝死
3.2.1 室性心律失常 目前有报道使用AliveCor 监测仪(AliveCor,美国旧金山)和智能手表(Ringwald 2019,Waks 2015)监测症状性室性心律失常。室性期前收缩可能对基于PPG 的系统具有挑战性,因为很多室性期前收缩可能不充盈心脏(Billet 2019)。
3.2.2 晕厥 使用可移动医疗设备(穿戴式或植入式)延长监测时间仍然是诊断晕厥时心脏节律的主要手段(Steinberg 2017)。一项针对心悸和晕厥前兆的人群通过AliveCor 和普通心电监测的随机对照临床试验证实,AliveCor 组对症状性心律失常有更快和更高的检出率,提示在先兆晕厥人群中,使用商用的mHealth 设备进行患者激活的节律监测是高效的(Reed,2019)。由于直立不耐受或神经源性问题导致的一过性意识丧失和机械跌倒具有很大的重叠(Davic 2010,Heinrich 2010)。手机应用如果可以结合心律监测、跌倒探测、GPS 位置、视频记录患者周围情况,以及有症状的患者探测到跌倒发生时触发警告信号等功能,将会给患者带来极大获益。
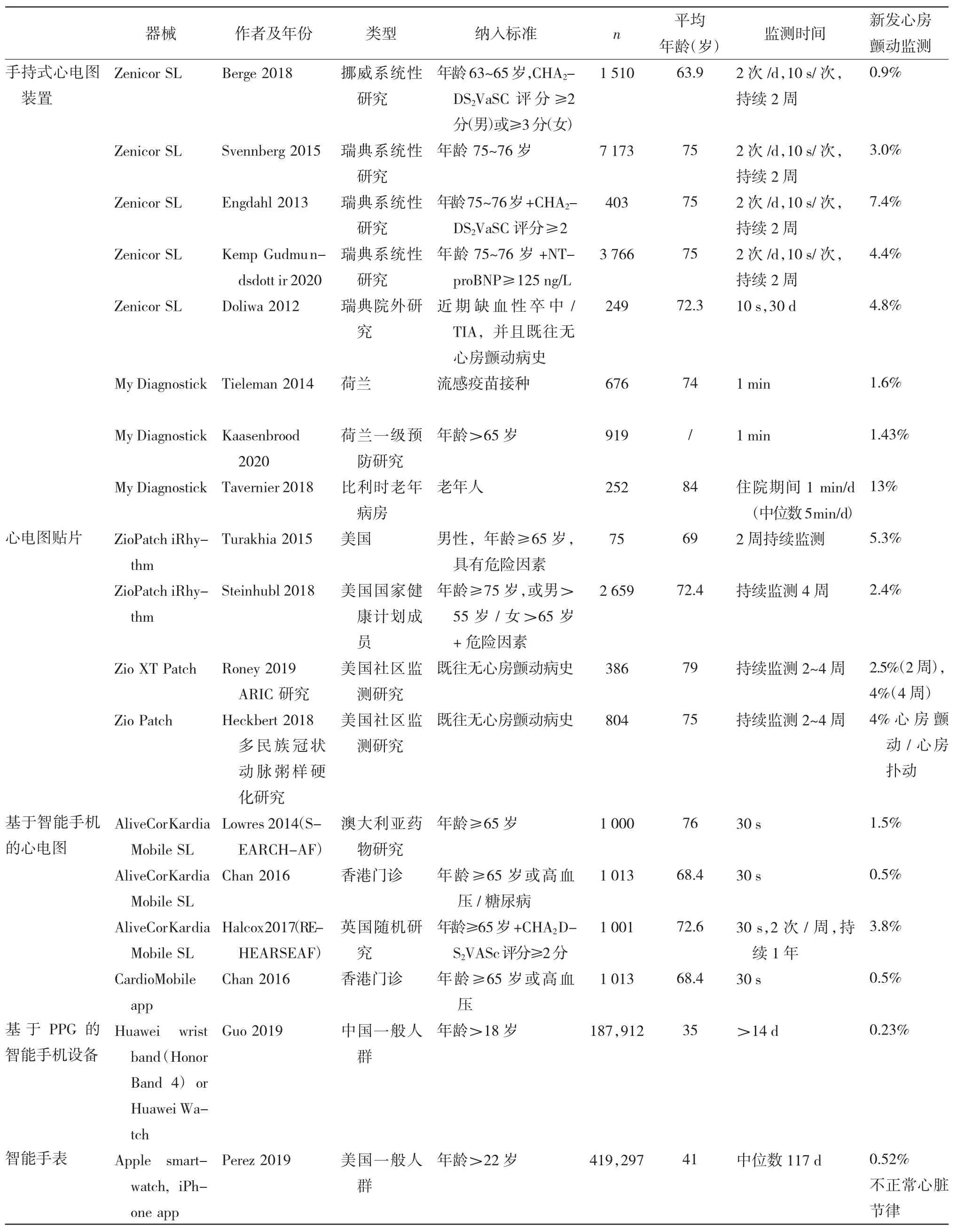
表3 采用新技术对心房颤动进行筛查的研究
3.2.3 心脏骤停 mHealth 或许可以预测心脏骤停。一旦发生心脏骤停,快速识别对于触发紧急响应至关重要。结合生理监测、GPS 和通信功能的可穿戴设备,可以提供几乎即时的警报以及位置信息(Kwon 2019,Praveen 2019)。mHealth 设备或许能够识别脉搏和濒死的呼吸模式。移动电话的普及可加速急救通知,并且调度员有可能从旁观者那里收集信息,并提供急救指导,如心肺复苏术。这一措施可以改善各种紧急情况的临床结局(Wu 2012)。使用当前的技术通知发生心脏骤停事件附近的施救人员,有助于提高心肺复苏率(Ringh 2015)。无论是专业救助人员还是旁观者做出响应,移动设备在提供来自调度员或设备本身的语音(或视频)指令时可能会更加有用。对预录音频、实时视频和基于动画教学的研究表明,尽管技术在不断发展,但心肺复苏术的实施和自动体外除颤器(automated external defibrillator,AED) 的使用仍有待改进(Bolle 2009,Choa 2008,Merchant 2010,You 2008)。局限性在于,由于此类应用不受监管,因此许多应用无法传达当前的基本生命支持算法,且实用性可能很差(Kalz 2014)。移动设备有可能帮助提高AED 的获取和使用率 (Sakai 2011,Hatakeyama 2018,Neves Briard 2019)。克服这些缺陷的一种新兴方法是通过无人机将AED 分发到心脏骤停位置,有望减少除颤前时间,尤其是农村地区(Boutilier 2017,Claesson 2017)。Heartrunner 试验测试了公民响应者激活的完整链条(Andelius 2020)。
4 合并症
许多疾病的管理可能直接影响心律失常的复发和预后(Chuang 2020),见图 4。mHealth 在促进这些干预措施方面具有巨大潜力,见图5。这些决策支持应用能成功的关键因素与它们的用户友好性、复杂性以及向患者提供电子通信和反馈的能力等有关。远程监控嵌套在更复杂的干预措施中有望带来可持续益处,这些措施包括面对面咨询、远程广播、教育、行为管理、药物管理和遵守合同。
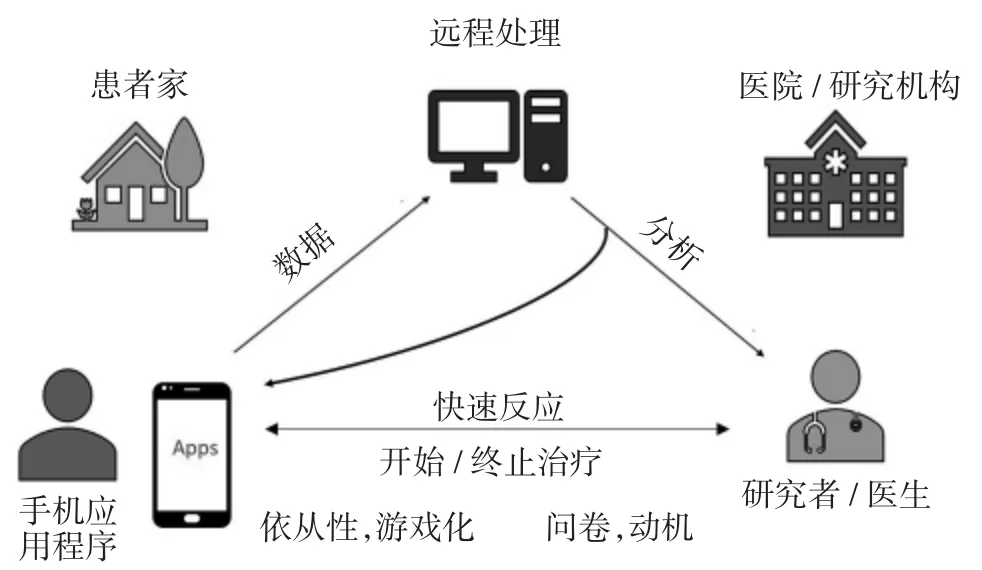
图5 数字应用程序可以整合患者传输的传感器信息和临床信息,进行远程自动分析和临床校正,对患者进行教育和治疗
4.1 缺血性心脏病 急性缺血综合征的早期处理(例如早期血管成形术)可以减少梗死区域和室性心律失常的发生。心肌梗死后如合并心房颤动,其预后会更差(Pizzetti 2011)。从家庭设施的角度来讲,mHealth 可能会改善症状识别和早期表现,即“症状到门时间”(Moser 2006)。3 导联心电图(以及派生的增强肢体导联)可以用市售的智能手表记录下来(Avila,2019)。新兴技术(www.heartbeam.com)使用的是信用卡大小的设备,该设备压在用户的胸部上,见图3。其使用新的3D 矢量方法收集心电图信号。信号发送到云端,然后在云端进行分析并将其与患者的无症状基线读数进行比较。假设由现场的应急人员将心电图传输到医院进行检查和分流,可缩短门球时间,降低肌钙蛋白峰值水平(Clemmensen 2010,Sanchez-Ross 2011)。移动技术也可通过增加药物依从性、改善随访程序及协助预约就诊时间来促进医院后护理(Chow 2015,Horwitz 2013,Unal 2018,Ziaeian 2013)。用于测量心率、呼吸频率和运动参数的移动应用程序和链接的传感器可能会克服一些传统限制,例如可用性、成本和便利性等,并且使某些患者更易接受(Zwisler 2016,Varnfield 2014)。
4.2 心力衰竭
4.2.1 移动技术与心力衰竭管理 通过压力、张力或者加速度监测胸壁活动的压力、张力或者加速度,进一步监测呼吸频率和模式的传感器在心力衰竭中具有应用价值(包括传统心率、血压和体重)。LINK-HF 研究使用一次性多传感器胸部贴片,其初步结果令人鼓舞(Stehlik 2020),可以在临床表现出现前1 周,以76%~88%的灵敏度和85%的特异度检测出因心力衰竭加重而住院的前兆。
4.2.2 运动训练 建议对所有稳定的心力衰竭患者进行运动训练(Piepoli 2011,Ponikowski 2016)。家庭远程康复是安全有效的,并且在心力衰竭患者中具有高度的依从性。它可以改善体力(Piotrowicz 2015)和心理状况(Piotrowicz 2016),在改善峰值摄氧量、6min 步行距离和生活质量(quality of life,QoL)方面均十分显著(Piotrowicz 2019)。
4.3 糖尿病 糖尿病和代谢综合征是影响心血管疾病患者发病和死亡的危险因素。欧洲心脏病学会关于糖尿病和心血管疾病的指南最近推荐了mHealth 模式自我管理(Cosentino 2019)。血糖控制可能会减少心房颤动的发生和复发(Chao 2012,Chang 2014,Gu 2011,Otake 2009)。随机对照试验中,其改善血糖的有效性显示出好坏参半的结果(Agarwal 2019,Fleming 2020,Pal 2014,Quinn 2011,Whaley 2019)。
4.4 高血压 高血压由于其高患病率,为心房颤动的发生提供了最高的归因风险(Huxley 2011)。几项临床试验表明,在血压达标方面,血压远程监测可能较常规护理更有效(Bosworth 2011,Kim 2015,Mc-Manus 2010)。荟萃分析显示,与常规护理相比,远程血压监测使诊室收缩压和舒张压分别提高了3.99 mmHg(95%CI:5.06~2.93,P <0.001)和 1.99 mmHg(95%CI:-2.60~-1.39,P<0.001)(Duan 2017)。
4.5 包括睡眠呼吸暂停在内的疾病 睡眠障碍非常普遍,可导致心血管疾病风险增加以及心律失常,特别是心房颤动(Daghlas 2019,Hirshkowitz 2015,Mehra 2006,May 2016,May 2017)。有研究报告显示,睡眠障碍和睡眠剥夺是一个未得到解决的公共卫生问题(美国医学研究所睡眠医学研究委员会,http://www.ncbi.nlm.nih.gov/books/NBK19961)。治疗睡眠呼吸暂停可能会减轻心房颤动负担(Qureshi 2015,Youssef 2018)。市面上有几种可穿戴设备可以精确测量总睡眠时间,但不能精确测量睡眠效率和不同睡眠阶段等更详细的参数(Mantua 2016)。初步数据表明,与黄金标准多导睡眠图(Selvaraj 2014)相比,可穿戴设备可能能够更准确地检测睡眠呼吸暂停,并改变睡眠障碍的筛查、诊断和治疗。通过7 d手腕活动描记诊断出的睡眠不规律与心血管事件的风险有关(Huang 2020)。
4.6 生活方式(图4)
4.6.1 体育运动 健身代表着移动通讯技术领域有着巨大市场,以及改善广大mHealth 消费者健康状况的重大机遇。这些大量的应用程序通过计算用户每天的行走步数、在线训练量和激励教练来计算日常体育活动量,并促进形成健康的生活方式(Mc-Connell 2018)。(1)心肺健康与心房颤动负荷量呈反比关系(Faselis 2015);(2)超重个体提高 2 MET 的运动量,可以避免罹患心房颤动的可能性增加1 倍(Pathak 2015)。
竞技运动员罹患心房颤动的风险可能更高(Abdulla 2009,Anderson 2013)。移动设备可以作为管理培训的自我监控工具(Aroganam 2019,Li 2016,Peake 2018,Peart 2019,Seshadri 2019),不仅能提供训练表现和水平的参考信息,还能提供心律失常有价值的诊断信息,而这种信息可能会触发正规的心脏病相关评估。
4.6.2 饮食 减轻体重和改变危险因素是心房颤动治疗的第 1 类(B-R)建议(January 2019)。减轻 10%的体重(BMI<27 kg/m2)可减轻心房颤动负担(Pathak 2015)。但人们对这一建议的依从性很差,原因之一就是无法追踪人们的食物摄入(Abed 2013, Donnellan 2019,Pathak 2015)。
目前有许多面向消费者的手机应用程序是为了追踪食物摄入量而设计的,但是这些应用程序通常需要多个步骤。例如用户键入所摄取的食物,然后滚动搜索结果以匹配程序的食物和营养数据库;接下来,在找到匹配的食物类型之后,用户必须估计并输入一个数量。这些应用程序需要用户的大量输入过程,不仅耗费了时间,同时出错的可能性很高(Griffiths 2018)。尽管有大量与饮食和体重相关的应用程序,以及社区对体重控制的关注,目前仍然缺乏高质量的证据来证明这些应用是有效的(Dounavi 2019)。
未完待续。