基于高通量测序和Q-PCR芯片技术分析养殖环境中苍蝇携带细菌菌群结构和耐药基因特点
张红娜,周玉法,崔 娜,翟真真
(1.河北经贸大学生物科学与工程学院,石家庄 050061;2.泰安市岱岳区畜牧局,山东 泰安 271000;3.泰安市中心医院,山东 泰安 271000)
苍蝇在人类和动物活动环境中十分常见,如餐厅、医院、农贸市场、屠宰场及养殖场等[1]。苍蝇脚和口器带有腺毛和垫子,分泌大量黏性物质,易携带大量微生物包括葡萄球菌、肠球菌、志贺氏菌、大肠杆菌、炭疽芽孢杆菌、衣原体、棒状杆菌等;苍蝇肠道也是耐药基因和毒力基因在细菌间水平转移适宜场所[2-3]。因此,苍蝇可通过食物链将携带的大量病原菌和多重耐药菌传递给人和动物,威胁公共健康安全[4]。苍蝇携带病原菌与其所处环境密切相关,如动物养殖场长期使用抗生素,苍蝇携带大量耐药菌株[5]。
动物养殖场中粪便、尿液、腐蚀物等为苍蝇生长发育提供丰富营养,也为动物源耐药菌散播提供媒介[6-7]。Marc等和de Jong等研究报道,动物养殖场苍蝇和粪便中均检测到耐临床一线抗生素细菌,如第三代头孢菌素和氟喹诺酮[8-9]。由于抗生素大量使用甚至滥用,动物养殖场已成为耐药基因存储库[10],因此深入研究动物养殖环境中苍蝇携带细菌耐药情况,有助于了解养殖场耐药菌特点,对防控耐药基因散播具有重要意义。
目前,定量聚合酶链反应(Quantitative polymerase chain reaction,Q-PCR)芯片技术可同时检测大量ARG,且具有样品用量少、操作方便和反应快速等优点,广泛应用于环境耐药性检测[11]。因此,本研究采用高通量测序和Q-PCR芯片技术,以鸡舍和奶牛舍为采样地点,系统分析苍蝇和粪便样品中细菌菌群结构、潜在致病菌、耐药基因(Antibiotic resistance gene,ARG)和移动遗传元件(Mobile gene elements,MGE),为养殖场卫生管理、苍蝇治理及耐药性散播防控提供参考。
1 材料与方法
1.1 样品采集
2019年9月选择山东省泰安市一个全封闭鸡舍和一个半开放奶牛舍作为采样点,两个采样点之间距离大于5.0 km。每个养殖舍内放置一条无毒、无杀虫剂和无气味捕蝇网,2 h后回收。用无菌镊子将苍蝇从网中取出,分别放入含有800 μL磷酸盐缓冲液无菌1.5 mL离心管,置于冰块上1 h内送回实验室。利用无菌组织匀浆器将苍蝇均质化,5 000 r·min-1离心20 s,保存于-80℃待用。从鸡舍(n=15)和奶牛舍(n=15)中共捕获30只苍蝇。
同时,在靠近捕蝇网位置用无菌棉拭子采集新鲜粪便样品,置于无菌离心管,保存于-80℃待用。从鸡舍(n=6)和奶牛舍(n=6)中共采集12份粪便样品。
1.2 细菌菌群分析
根据说明书,使用MO BIO PowerSoil DNA试剂盒(Qiagen公司)提取苍蝇匀浆和粪便样品DNA。PCR扩增16S rRNA基因V4高变区,引物为515F(5'GTGCCAGCMGCCGCGGTAA 3')和 806R(5'GG ACTACHVGGGTWTCTAAT 3'),PCR条件参考文献[12]。通过琼脂糖凝胶电泳验证PCR产物,并纯化回收。根据Illumina TruSeq DNA文库制备方法构建DNA文库,并在Illumina MiSeq平台(上海美优生物公司)上作双末端测序。
采用QIIME(v1.9.1)处理序列数据,序列拼接后去掉<150 bp且模糊片段以及无法矫正的条形码。根据97%同源性归类操作分类单元(Operational taxonomic units,OTUs),使用Usearch去掉嵌合体。利用NCBI(www.ncbi.nlm.nih.gov)和核糖体数据库工程(Ribosomal Database Project)(http://rdp.cme.msu.edu)中BLASTn对OTUs分类。根据目前已知致病菌[13],在属水平鉴定样品中致病菌。
1.3 Q-PCR芯片检测
采用WaferGen SmartChip Real-time PCR系统(WaferGen Bio-systems公司)作Q-PCR,设置循环阈值(Ct)为30。首先对粪便样品DNA作初步QPCR芯片检测,在384引物组中检测到372个靶向ARG/MGE,可归类为12种耐药基因型:氨基糖苷类(n=61),酰胺醇类(n=20),β-内酰胺类(n=55),氟喹诺酮类(n=12),MGE(n=48),多重耐药类(Multidrug resistance,MDR;常指多种药物外排泵基因,n=43),大环内酯类-林可酰胺-链霉菌素 B(Macrolides-lincosamide-streptogramines B,MLSB;n=43),磺胺类(n=6),四环素类(n=27),甲氧苄氨嘧啶类(n=17),万古霉素类(n=24)和其他质粒介导耐药基因(n=13)[14]。使用Qubit 3.0荧光计检验DNA浓度和质量,将每个样品DNA稀释至相同浓度和质量。微流控SmartChip具有5 184个反应孔(每孔100 nL反应体系),制备372个靶向基因Q-PCR陈列后,使用多样品纳米分配器(TaKaRa)将PCR混合物分配到芯片反应孔,QPCR反应:95℃初始酶活化10 min,40个循环包括95℃变性30 s,60℃退火30 s。每个Q-PCR反应重复3次。
1.4 统计分析
通过比较不同组OTUs和Shannon指数分析Alpha多样性,使用非参数Kruskal-Wallis检验比较各组之间Alpha多样性是否具有差异性。利用QIIME中SourceTracker量化苍蝇携带细菌菌群来源。将映射到指定OTUs序列数除以每个样品序列总数计算细菌菌群相对丰度。通过计算单个OTU相对丰度>0.001%样本数量分析致病菌流行率。利用卡方检验比较苍蝇和粪便之间ARG和MGE特点。利用Pearson correlation分析ARG和MGE与细菌菌群之间相关性,r>0.9时显著正相关。P<0.05为差异显著,P<0.01为差异极显著,具有统计学意义。
2 结果与分析
2.1 细菌菌群结构
分析不同动物养殖舍内苍蝇和粪便中细菌菌群在门水平组成结构(见图1)。总体上,在苍蝇和粪便中共检测到13个细菌门。在苍蝇中,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)为绝对优势菌群,均占鸡舍苍蝇和奶牛舍苍蝇总细菌菌群99%以上。在粪便中,厚壁菌门、变形菌门、拟杆菌门、放线菌门、螺旋体门(Spirochaetae)、疣微菌门(Verrucomicrobia)和互养菌门(Synergistetes)为绝对优势菌群,约占鸡粪便和奶牛粪便总细菌菌群98%。鸡舍苍蝇中未发现螺旋体门,鸡粪便中未发现绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria);而奶牛舍中,苍蝇和粪便中均检测到这13个细菌门。结果表明粪便样品中鉴定的细菌门出现在苍蝇体内。
从图1可以看出,同一养殖场内苍蝇之间、苍蝇与粪便之间优势细菌门组成结构相似;而不同养殖场苍蝇之间、粪便之间细菌菌群结构差异较大。例如,鸡舍内厚壁菌门在苍蝇和粪便中分别占61.04%、67.81%;奶牛舍内厚壁菌门在苍蝇和粪便中分别占37.41%、37.42%。同样,变形菌门、拟杆菌门、放线菌门等也显示相同趋势。说明苍蝇细菌菌群结构受同一养殖场内动物粪便影响。Park等研究表明,苍蝇携带细菌群落组成因栖息地不同而变化,且与所处环境微生物组成密切相关,尤其腐烂和排泄物丰富环境[15]。
2.2 细菌菌群α多样性分析
基于16S rRNA和α多样性分析发现,苍蝇细菌菌群OTUs数量和多样性受相应养殖舍动物粪便影响(见图2)。基于16S rRNA分析(见图2a),苍蝇中鉴定447~665个OTUs,奶牛舍苍蝇中平均OTUs(574.33±67.42)高于鸡舍苍蝇中 OTUs(508.50±53.47);粪便样本中鉴定出902~2 170个OTUs,奶牛粪便中平均OTUs(1 506.67±355.65)显著高于鸡粪便中OTUs(1 040.33±128.14)。
经α多样性分析(见图2b),奶牛舍苍蝇细菌菌群Shannon指数(4.36±1.12)显著高于鸡舍苍蝇(3.13±1.51);奶牛粪便细菌菌群Shannon指数(7.53±0.70)最高,显著高于鸡粪便(5.32±1.36)。以上结果显示,奶牛舍苍蝇携带细菌菌群组成结构比鸡舍苍蝇更复杂,表明苍蝇细菌菌群多样性受所处环境动物粪便影响。
2.3 苍蝇细菌菌群溯源
SourceTracker追踪分析(见图3a)显示同一养殖舍内动物粪便是苍蝇中细菌菌群主要贡献因素。鸡舍苍蝇细菌菌群主要由鸡粪便提供(68.5%)。相比之下,奶牛舍苍蝇携带细菌群落大部分来源未知(51.8%),这可能与奶牛舍环境相对开放有关,但奶牛粪便仍是影响奶牛舍苍蝇细菌群落主要因素(39.7%)。Bray-curtis距离分析(见图3b)显示苍蝇携带细菌菌群与所处环境动物粪便细菌菌群结构更接近,进一步验证上述结果。
2.4 潜在致病菌
在属水平共鉴定出1 025个细菌属。苍蝇中鉴定出953个细菌属,其中32个细菌属被认为是人类和/或动物致病菌属(见表1)。在粪便样本中鉴定出561个细菌属,其中21个细菌属被认为是致病菌属(见表2)。可以看出,在较低分类水平苍蝇中显示出较高多样性。值得注意,9个致病菌属在苍蝇和粪便中均具有较高的丰度(>0.1%),包括不动杆菌属(Acinetobacter),假单胞菌属(Pseudomonas)、链球菌属(Streptococcus)、产碱杆菌属(Alcaligenes)、弯曲菌属(Campylobacter)、博代氏杆菌属(Bordetella)、肠球菌属(Streptococcus)、葡萄球菌属(Staphylococcus)、污蝇杆菌属(Wohlfahrtiimonas)。
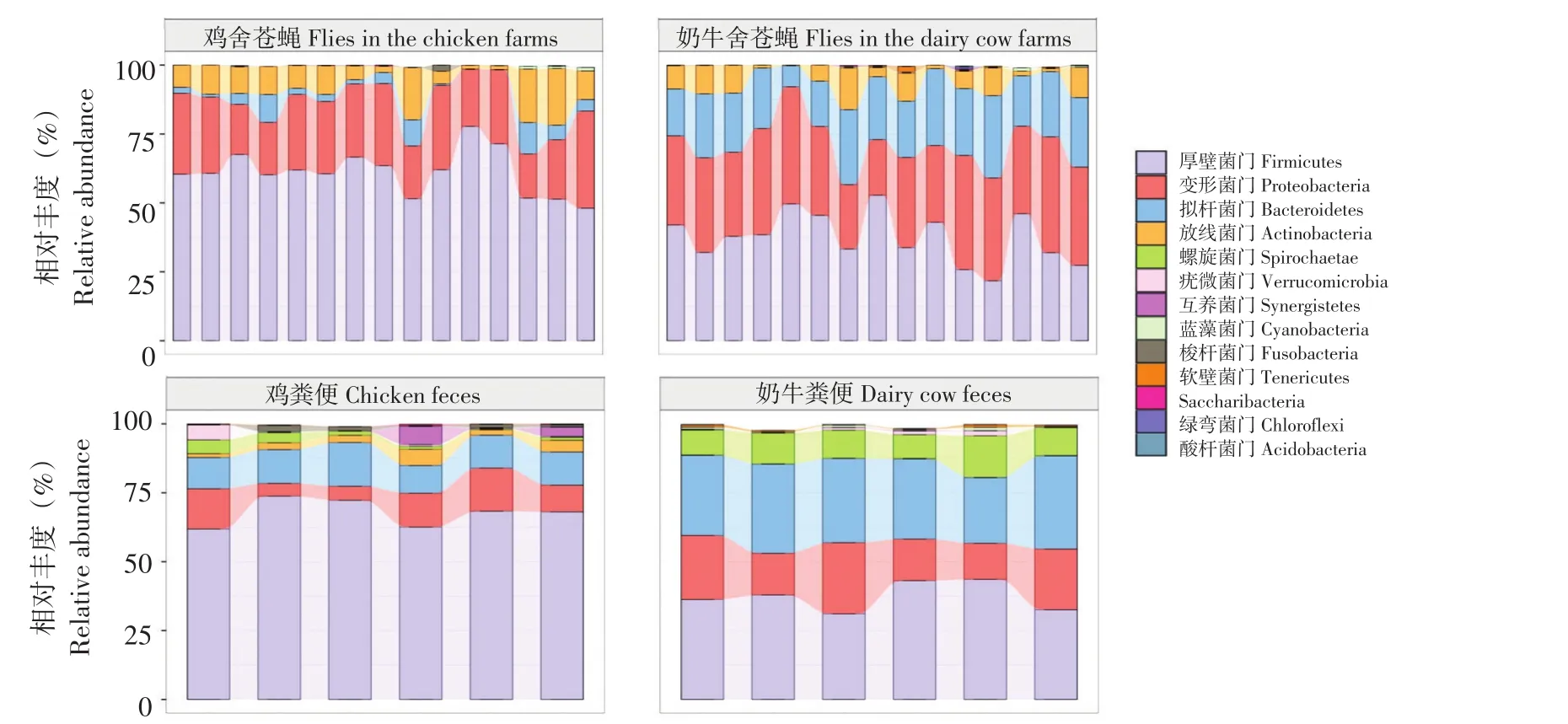
图1 门水平苍蝇和动物粪便中细菌菌群组成Fig.1 Bacterial composition of flies and feces at phylum level

图2 苍蝇和粪便中细菌菌群多样性分析Fig.2 Diversity analysis of bacterial communities of flies and feces
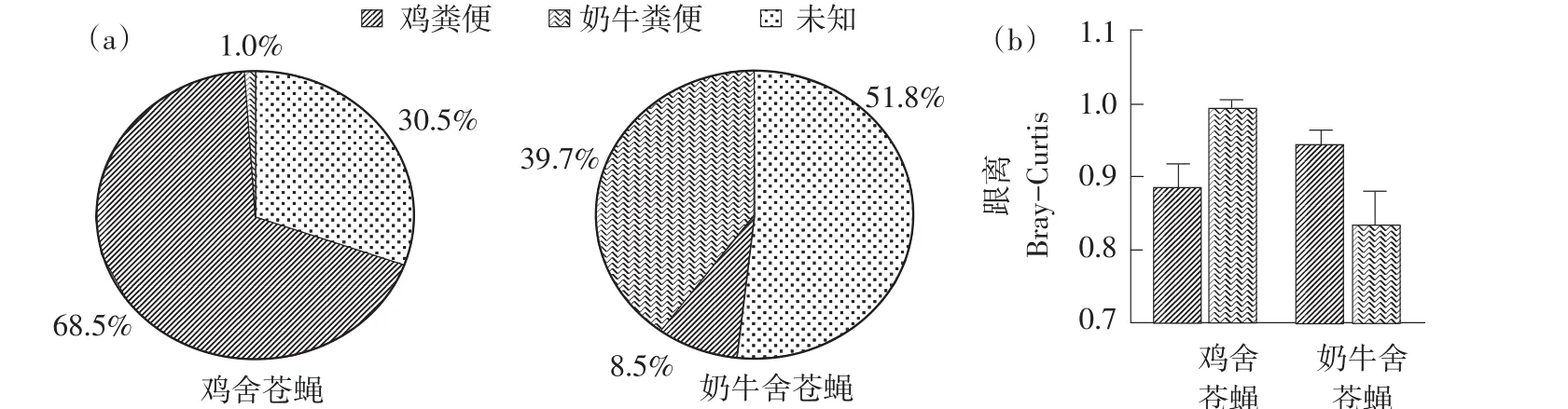
图3 养殖舍苍蝇细菌菌群溯源分析Fig.3 Source tracking of bacterial community of flies trapped from breeding environment

表1 属水平苍蝇样本中潜在致病菌Table 1 Potential pathogens at genus level in flies samples (%)
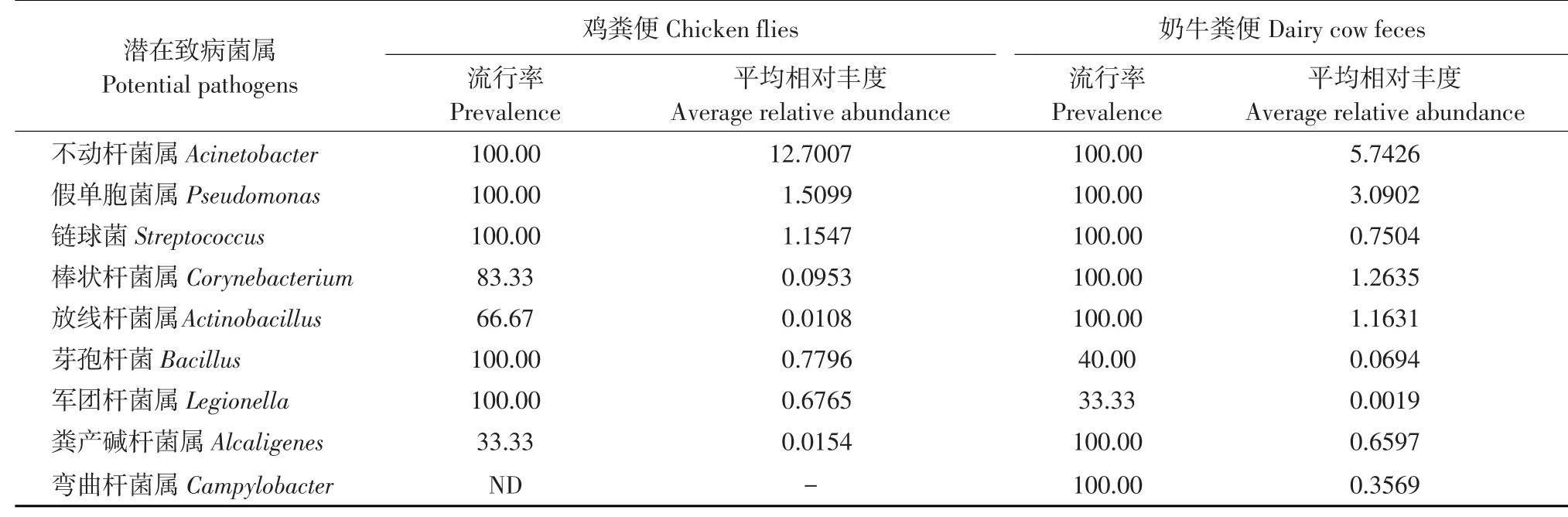
表2 属水平粪便样本中潜在致病菌Table 2 Potential pathogens at genus level in feces samples (%)
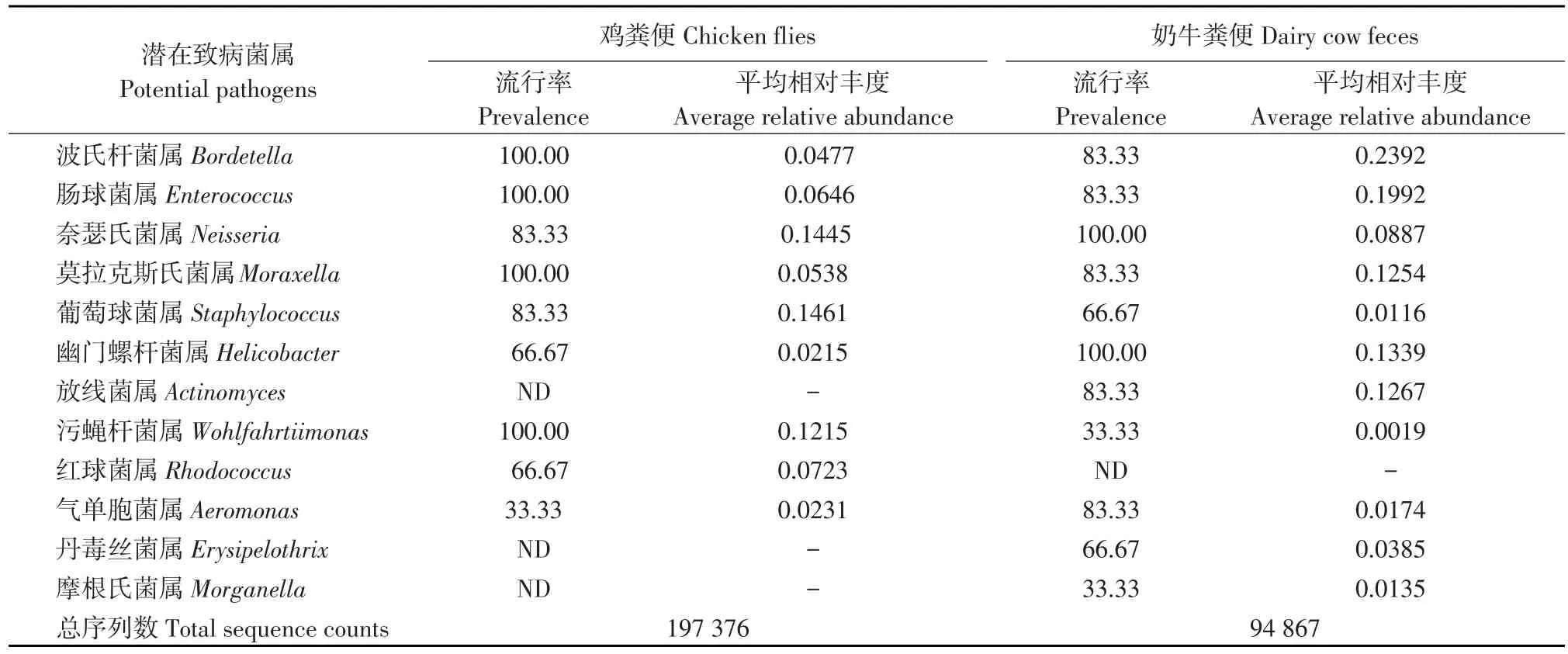
续表
在鸡舍苍蝇中假单胞菌属最多(19.74%),其次是气单胞菌属(Aeromonas,12.67%);奶牛舍苍蝇中,不动杆菌属丰度最高(3.81%),其次是肠杆菌属(Enterobacter,2.88%)、肠球菌属(1.65%)等。两个养殖舍粪便样本中不动杆菌属数量最多,其次假单胞菌属。由表1和2可知,一些潜在致病菌在两个采样点苍蝇中普遍存在且丰度较高,而某几种潜在致病菌仅在其中一个采样点存在。研究表明,周围环境对苍蝇携带潜在致病菌也具有影响[15-16]。
养殖场动物粪便为苍蝇繁殖提供物质条件,而苍蝇与污染物接触后,又通过其体表、口器携带并传播具有感染性致病菌,如致病性大肠杆菌,血清型沙门氏菌等,对人类和动物健康产生威胁[17-18]。此外,苍蝇也可能是耐药性致病菌在动物和人类之间传播媒介或关键环节[19-20]。
2.5 ARG和MGE特点
经Q-PCR阵列在两个采样点粪便和苍蝇中共检测到256个ARG和44个MGE,鉴定出12种耐药基因型均(见表3)。总体上,粪便中检测到234个ARG和39个MGE,高于在苍蝇中210个ARG和32个MGE,且苍蝇中耐药基因均可映射到粪便中。奶牛舍苍蝇(203)和粪便(253)中检测到ARG/MGE数量均高于鸡舍苍蝇(198)和粪便(241)。
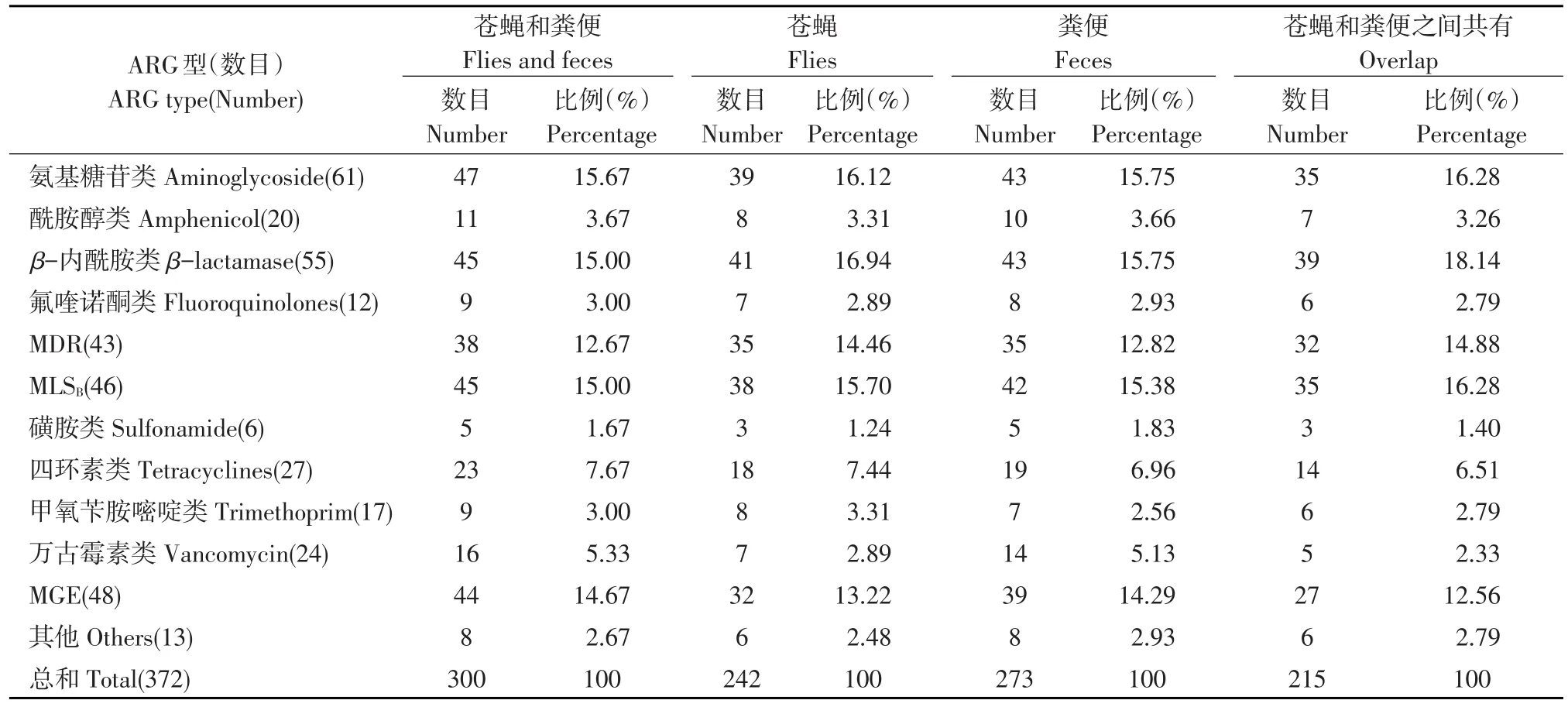
表3 苍蝇和粪便中ARG和MGE鉴定Table 3 Identified ARG and MGE in flies and feces
图4显示各组样品ARG和MGE特点。在鸡舍内,苍蝇和粪便中最常见ARG主要是氨基糖苷类、多重耐药(Multidrug resistance,MDR)、β-内酰胺类耐药基因;在奶牛舍内,苍蝇和粪便最常见ARG主要是氨基糖苷类、甲氧苄氨嘧啶类、MDR。此外,鸡舍内,苍蝇和粪便中MGE分别占16.95%和18.36%;奶牛舍内,苍蝇和粪便中MGE分别占14.60%和12.50%。可以看出,苍蝇与同一采样点内动物粪便ARG和MGE特点一致。
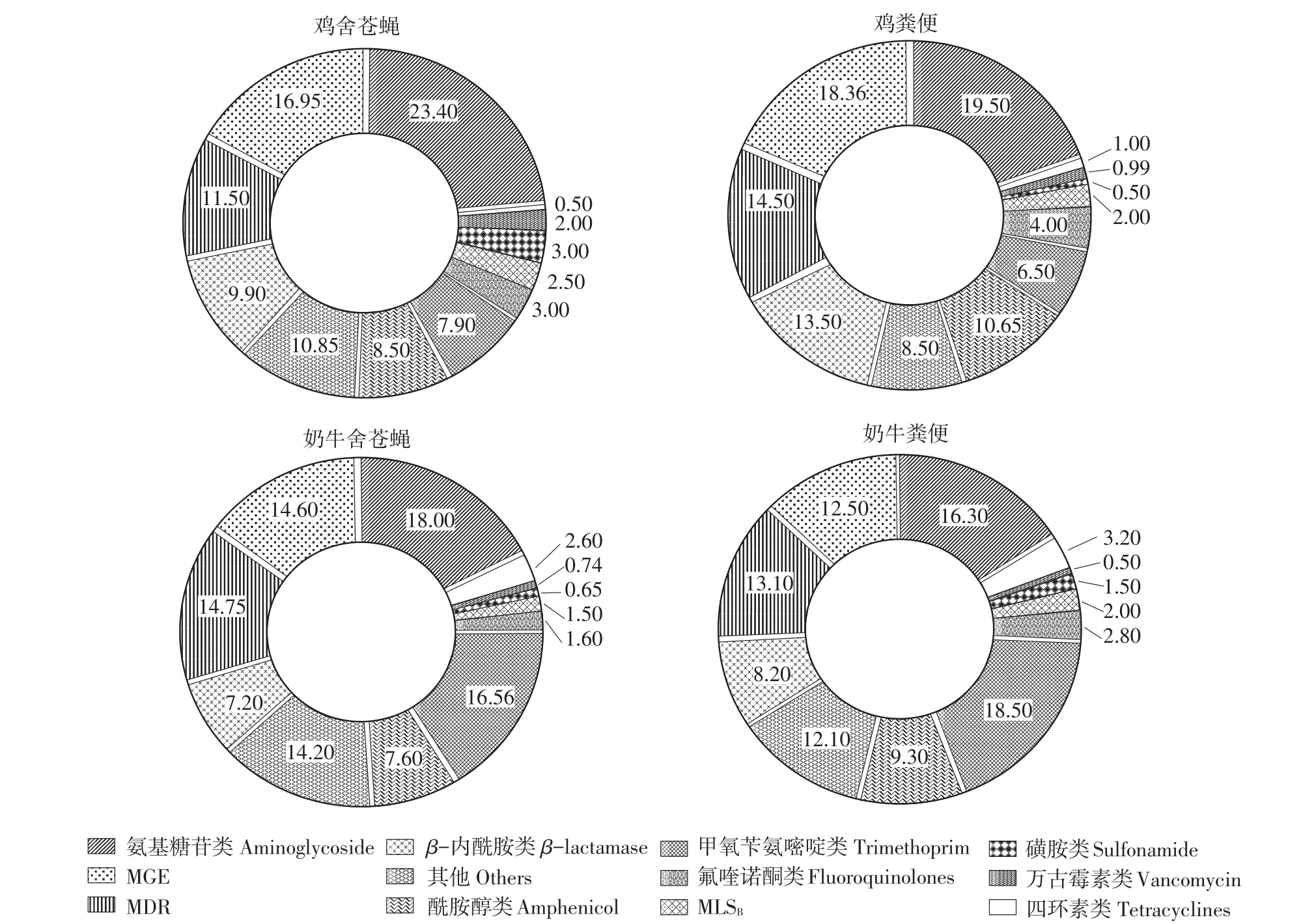
图4 苍蝇和粪便中ARG和MGE组成分布Fig.4 Distribution of ARG and MGE in flies and feces
利用Pearson correlation分析主要ARG和MGE类型与其携带菌(属水平)相关性(见表4和5)。本研究中主要ARG类型为氨基糖苷类、胺酰醇、β-内酰胺类、氟喹诺酮类、MDR、MLS、磺胺类、四环素类、甲氧苄氨嘧啶类和万古霉素类等;主要 MGE 类型为 Tp614、IS613、tnpA、intI1_337、IncN_oriT、 orf37-IS26、 ISEfm1-Entero、 int1-amarko、intl2和intl3等。表5和6同时显示,主要ARG和MGE与其携带菌具有显著正相关(r>0.9)。由于苍蝇可长距离飞行,这些ARG可通过苍蝇携带造成大面积散播,另外,MGE进一步加剧耐药基因在细菌间转移,间接表明动物源耐药菌携带多种耐药基因的原因。
2.6 共有ARG和MGE
苍蝇与粪便之间存在215个共有ARG和MGE,分别占苍蝇总ARG和MGE 88.84%(215/242)和粪便总ARG和MGE 78.75%(215/273)。通过使用卡方检验比较苍蝇与不同动物粪便之间共享ARG和MGE数量百分比(见图5)发现,鸡舍苍蝇—鸡粪便共有ARG和MGE数量百分比(56.02%,135/241)高于奶牛舍苍蝇—鸡粪便(43.57%,105/241),且差异极显著;奶牛舍苍蝇—奶牛粪便共有ARG和MGE数量百分比(54.94%,139/253)同样显著高于鸡舍苍蝇—奶牛粪便(44.27%,112/253)。
与细菌菌群分析结果一致,不同动物舍苍蝇携带ARG和MGE特点与其所处环境动物粪便相近,由于检测到的ARG和MGE主要存在于4个细菌门中,即变形菌门、厚壁菌门、拟杆菌门和放线菌门[21]。本研究中4个可能富含ARG和MGE的细菌门均占两个采样点苍蝇细菌菌群99.0%以上。说明在养殖场内苍蝇和粪便均是耐药基因载体,同时也说明苍蝇可作为某一环境中耐药基因特点参照物。
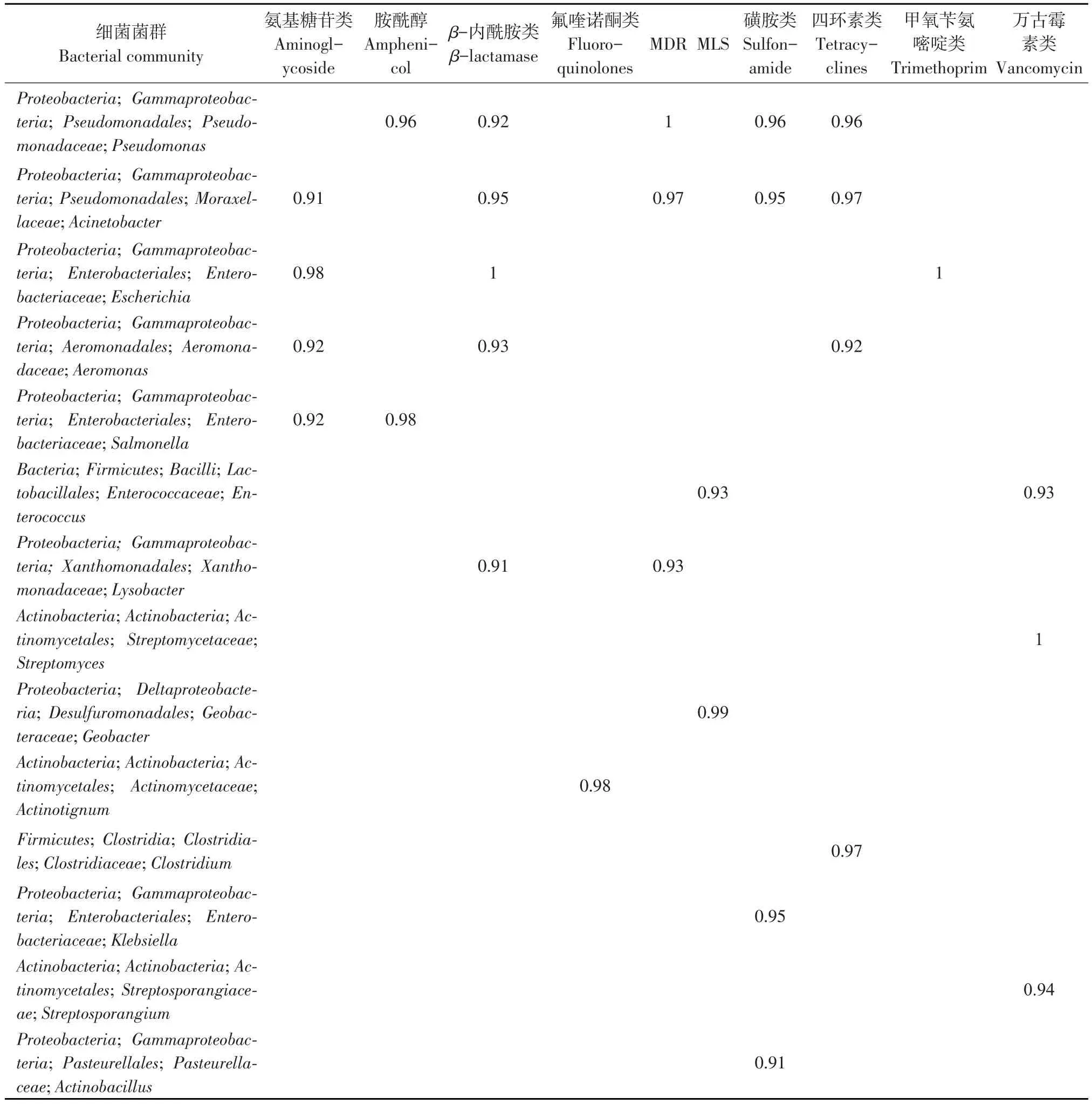
表4 ARG与属水平细菌菌群之间Pearson相关分析(r>0.9)Table 4 Pearson correlation between ARG and bacteria at genus level
值得注意的是,奶牛舍苍蝇中8.5%细菌菌群显示来自鸡舍粪便,且同一采样点内苍蝇细菌菌群以及ARG和MGE特点也存在一定多样性,可能由于苍蝇迁徙过程中可能在粪便、废水和腐烂有机物上吸食和产卵,接触细菌和耐药基因[22]。
苍蝇在畜禽养殖场接触动物排泄物,随后很可能将获得细菌和耐药基因带到不同环境中,包括人类生活区[1-2]。因此,为进一步了解苍蝇在监测耐药性动态指示作用,有必要开展大规模、长时间和不同地理空间研究。同时,由于耐药基因在苍蝇和粪便中高流行率,应建立苍蝇评估耐药性公共卫生框架。
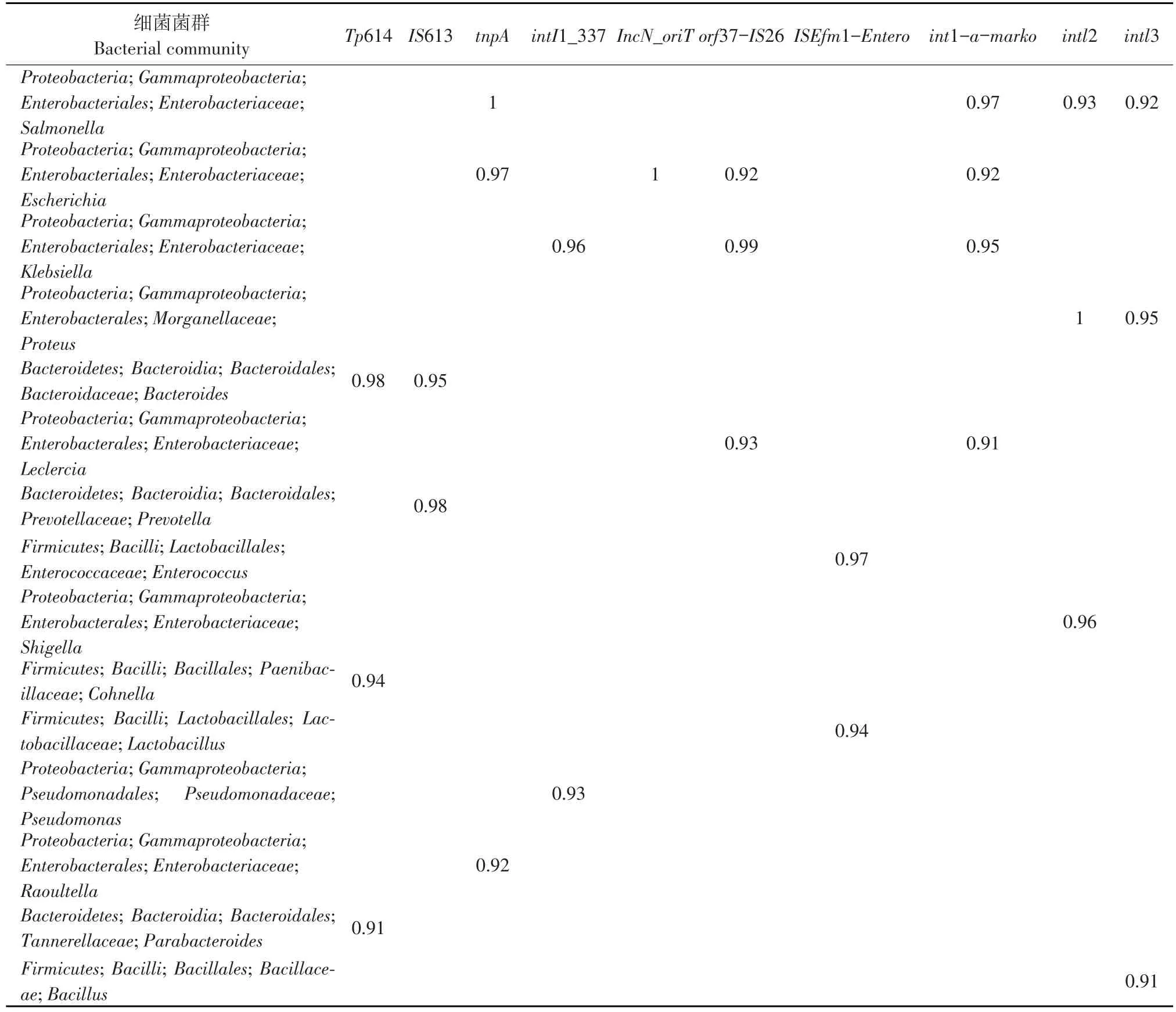
表5 MGE与属水平细菌菌群之间Pearson相关分析(r>0.9)Table 5 Pearson correlation between MGEs and bacteria at genus level
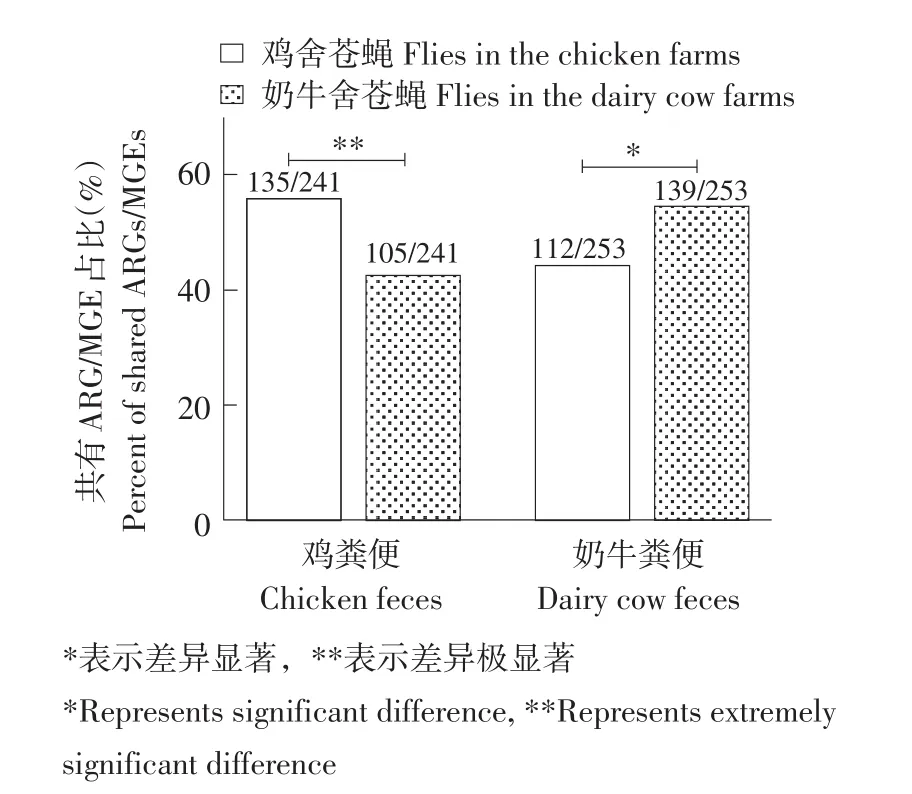
图5 苍蝇和不同动物粪便共有ARG和MGEFig.5 SharedARGandMGEbetweenfliesandanimalfeces
3 结 论
本研究中养殖舍苍蝇携带细菌菌群结构以及ARG和MGE组成分布与同域动物粪便相近,表明动物粪便是养殖舍苍蝇携带细菌菌群和耐药基因主要贡献因素。因此,养殖场苍蝇不仅是耐药基因和病原菌传播媒介,也是反映其所处环境耐药基因污染程度重要指标。

