层积前GA处理对老山芹种胚发育及物质代谢的影响
李富恒,吴晶晶,赵恒田,张晓雯,张宏发,尚爱娟,马汇聪
(1.东北农业大学生命科学学院,哈尔滨 150030;2.中国科学院东北地理与农业生态研究所,哈尔滨 150081;3.东北农业大学园艺园林学院,哈尔滨 150030)
老山芹是东北林区主要山野菜种类之一,学名兴安独活(Heracleum dissectumLedeb),为伞形科独活属多年生宿根草本植物[1]。其食用器官为嫩茎叶,味鲜美,营养丰富,有降糖降压、退热解毒、祛风除湿、清洁血液等功效,具有较高食用与药用价值,深受广大消费者喜爱。
种子休眠原因主要有种皮障碍、后熟作用及存在发芽抑制物质等。研究表明,老山芹种子采收时种胚尚未发育完全,处于心形胚-鱼雷形胚时期,存在后熟现象,播种后需较长时间发芽,且发芽率低、出苗不整齐、缺乏完善育苗技术,限制老山芹产业发展。由于需求量不断增加,过度采收造成野生资源日益枯竭,人工种植老山芹成为必然选择。开展老山芹育苗技术研究,对改善林区产业结构、发展林下经济、保护生态环境、实现老山芹规模化生产具有重要理论及实践意义。
赤霉素(Gibberellin,GA)是植物内源激素之一,具有打破种子休眠,促进种子萌发作用。GA在促进种子萌发中可软化种胚周围组织,克服种皮机械限制;促进种胚生长[2]。研究表明,赤霉素与层积处理相结合有效打破野茉莉[3]、滇重楼[4]等种子休眠,促进种子萌发。老山芹研究主要集中于植株及种子生长发育特性[5]、层积条件下种子后熟过程[6]、变温层积效果比较[7]、种子成熟度差异[8]、层积过程中种胚主要发育期间差异蛋白[9]等方面,缺乏GA处理对层积过程中种胚发育及物质代谢影响的系统研究。
本研究以老山芹种子为研究对象,测定不同浓度GA处理后变温层积过程中种胚形态及各种生理生化指标动态变化,分析比较各处理种子后熟进程,为深入研究老山芹种子休眠及萌发机制、提高种子处理效果和发芽率、保障种苗供应、发展老山芹产业提供理论依据和技术支撑。
1 材料与方法
1.1 材料
试验材料为七年生老山芹植株收获种子,购于黑龙江省大兴安岭地区农业林业科学研究院。种子采收后自然阴干备用。
1.2 方法
1.2.1 GA浸种
取籽粒饱满种子清水洗净,分别于200、300、400 mg·L-1GA浸泡24 h,蒸馏水处理为对照。
1.2.2 变温层积及取样
将细砂洗净后置于110℃烘箱中高温灭菌3 h,冷却后备用。将GA浸泡后种子与细砂以1∶2搅拌混匀,放入塑料盒(长×宽×高=19 cm×13 cm×11 cm)中,在塑料盖顶部打孔,利于种子呼吸。采用20℃,10 d→4℃,90 d→20℃,5 d变温层积方式。分别于 0、15、30、45、60、75、90、105 d取样,液氮速冻后置于-80℃冰箱保存备用。
1.2.3 种胚形态指标测定
取不同层积时期种子,去除种皮后游标卡尺测定胚乳长。解剖刀挑出种胚后制成临时装片,在显微镜下用直线式测微尺测定胚长。重复测定10次取平均值,计算胚率:
胚率(%)=胚长/胚乳长×100%。
胚乳长:去除种皮后用游标卡尺测量种子长度最大值。
胚长:直线测微尺测量种胚长度最大值。
1.2.4 种子生理生化指标测定
可溶性蛋白含量测定采用考马斯亮蓝G250法;可溶性糖和淀粉含量测定采用蒽酮法;粗脂肪含量测定采用索氏提取法[10]。
1.2.5 数据分析
试验数据采用DPS 7.05统计分析。
2 结果与分析
2.1 GA处理对老山芹种胚发育进程的影响
显微镜观察发现,老山芹种子存在形态后熟现象,即采收后种胚尚未发育完全,且种子成熟度不一致,其中大部分种胚处于心形胚阶段(见图1A),小部分种胚处于鱼雷形胚阶段(见图1B),在层积过程中种胚继续发育,逐渐达到子叶期胚阶段(见图1C-D),完成形态后熟过程,具备发芽潜在能力。根据此生物学特征,在种子采收时应当分期采收,尽量减少种子成熟度差异,利于出苗整齐一致。

图1 不同浓度赤霉素处理下老山芹种胚发育进程Fig.1 Development of embryo in Heracleum dissectum Ledeb seeds under different concentrations of gibberellin
层积开始前3个GA处理及对照老山芹种胚多处于心形胚时期。层积至15 d时,各处理种子从20℃暖温转入4℃低温,种胚较未层积前体积变大,但形态上差别不明显,大多数种胚仍处于心形胚时期。
随层积时间延长,层积30 d时各处理种胚形态开始出现差异:处理一和对照种胚仍停留在心形胚时期,而处理二和三种胚已发育至鱼雷胚时期。说明层积前GA处理促进层积过程中种胚发育,其中以较高浓度GA效果更佳。
层积至45 d时,对照与处理一种胚已发育至鱼雷形胚阶段;处理二和三种胚体积增加,发育至子叶期胚初期阶段,可观察到两片子叶轮廓。
层积至60 d时,对照种胚仍滞留在鱼雷形胚阶段,而处理一由鱼雷形胚发育至子叶期胚初期阶段;处理二和三种胚两片子叶继续伸长。处理三种胚形态已定型,体积大于其他处理。
层积至75 d时,对照种胚已发育至子叶期胚初期阶段,处理一处于子叶期胚阶段,形态定型;处理二种胚体积大于处理一,但子叶脉序仍较模糊;处理三种胚体积大于其他各处理,子叶上已观察到清晰脉序,部分种子开始萌发。
层积至90 d时,除对照种胚子叶上脉序还较模糊外,其他处理子叶上均观察到清晰脉序。处理一和二有少量种子发芽,处理三种子发芽数量较多。说明此时处理一和二部分种胚已完成形态后熟,具备发芽能力;处理三种子已进入大量发芽时期。
层积至105 d时,对照种子开始少量萌发,处理一和二种子大量发芽。
由以上分析可看出,层积前GA处理加快老山芹种子后熟过程,种胚发育快,发芽早,其中以赤霉素浓度为400 mg·L-1处理(处理三)效果最佳。与对照相比,处理三完成种胚发育和具备发芽能力时间比对照提前30 d。
2.2 GA处理对层积过程中老山芹种胚形态指标的影响
2.2.1 胚长
由图2可见,随层积时间增加,对照及3个GA处理老山芹种胚不断生长发育,种胚长度均有不用程度增加,GA浓度越高,种胚生长速度越快。
层积前对照及3个GA处理种胚长度分别为0.50、0.52、0.55、0.54 mm,各处理间无显著差异。
层积至15 d时,对照及3个GA处理胚长分别增长至0.57、0.59、0.60和0.62 mm,与层积前相比分别增长14%、13.5%、9.1%和14.8%,其中处理三增长速率最快。各处理相比较,处理三极显著高于对照,显著高于处理一,与处理二无显著差异;处理二显著高于对照,而与处理一差异不显著;处理一和对照无显著差异。
层积至30 d时,对照及3个GA处理胚长分别为0.66、0.74、0.65和0.78 mm,与层积15 d相比分别增长15.8%、25.4%、8.3%和25.8%,处理三仍保持较快增长速率。各处理相比较,处理三极显著高于对照和处理二,显著高于处理一;处理一极显著高于对照和处理二;处理二与对照间无显著差异。
层积30 d后胚长增长速率加快,层积45 d时,对照及3个GA处理胚长分别为1.02、1.06、1.10和1.13 mm,与层积30 d相比分别增长54.5%、43.2%、69.2%和44.9%,其中处理二增长速率最快。说明层积30~45 d胚乳中贮藏营养物质被大量分解为小分子有机物供应种胚,使种胚生长速率加快,胚长增长50%。各处理相比较,处理三显著高于对照和其他处理;处理一、二和对照间差异不显著。

图2 不同浓度赤霉素处理下种胚长度变化Fig.2 Changes of embryos length under different concentrations of GA
层积60 d时,各处理胚长分别为1.28、1.30、1.35和1.41 mm,与层积45 d相比分别增长25.5%、22.6%、22.7%和22.1%,增长速率较上一取样期下降。此时形态后熟过程完成,各处理种胚形态陆续进入子叶期胚阶段。各处理相比较,处理三极显著高于对照和其他处理;处理二极显著高于对照和处理一;处理一显著高于对照。
层积75 d时,与层积60 d相比各处理胚长分别增加0.94、1.07、1.08和1.09 mm,增长速率分别为73.4%、82.3%、80%和77.3%。各处理种胚增长迅速,其中处理二增长最快。这时种胚增长主要得益于子叶快速伸长。各处理相比较,处理三极显著高于对照和其他处理;处理二极显著高于处理一和对照;处理一极显著高于对照。各处理间胚长均呈极显著差异。
层积90 d时,各处理胚长分别为2.98、3.10、3.14和3.22 mm,与层积75 d相比分别增长34.2%、30.8%、29.2%和28.8%。增长速率变慢,其中对照增长速率最快,因其种胚发育相对滞后,完成形态后熟时间较晚。各处理相比较,处理三极显著高于对照和其他处理;处理二极显著高于处理一和对照;处理一极显著高于对照。与上一个取样期相同,各处理间胚长均表现为极显著差异。
层积105 d时,各处理胚长分别为3.14、3.20、3.33和3.42 mm,与层积90 d相比分别增长5.4%、3.2%、6.1%和6.2%。此时层积结束,种子已具有萌发能力,部分种子已发芽,故增长速率大幅变小。
层积结束与层积前相比各处理种胚长度分别增加2.64、2.68、2.78和2.88 mm,为层积前胚长5倍。层积过程中各处理种胚生长均呈慢-快-慢趋势,符合生长大周期规律,其中处理三(GA浓度为400 mg·L-1)种胚发育最快。
2.2.2 胚率
胚率反映种胚发育程度,胚率越大说明种胚发育程度越高。如图3所示,种子层积前种胚较小,对照及3个GA处理胚率分别为10.95%、11.26%、11.51%和11.31%,各处理间无显著差异。
层积至15 d时,对照和3个GA处理胚率分别为11.98%、12.75%、12.11%和13.06%,以百分数计算,较层积前增长率分别达9.4%、13.2%、5.2%和15.5%。差异显著性分析结果表明,处理三极显著高于对照和处理二,与处理一差异不显著;处理一极显著高于对照,显著高于处理二;处理二和对照差异不显著。
层积30 d时,对照和3个GA处理胚率分别为13.75%、15.66%、13.41%和16.18%,以百分数计算,较层积15 d时增长率分别达14.8%、22.8%、10.7%和23.9%,其中处理三胚率增长百分率最大。各处理相比较,处理三极显著高于其他处理和对照;处理一极显著高于对照和处理二;对照和处理二差异不显著。
层积45 d时,对照和3个GA处理胚率分别为21.47%、22.80%、23.31%和23.40%,以百分数计算,较层积30 d时增长率分别达56.1%、45.6%、73.8%和44.6%,增长速率加快,其中处理二增长速率最快。各处理相比较,处理三和处理二极显著高于对照和处理一;处理一极显著高于对照;处理三与处理二差异不显著。
层积60 d时,对照及3个GA处理胚率分别为26.98%、27.25%、29.09%和30.32%。以百分数计算,较层积45 d时增长率分别达25.7%、19.5%、24.8%和29.6%,增长速率减慢,其中处理三增长速率最快,已进入子叶期胚阶段。各处理相比较,处理三极显著高于处理二、处理一和对照;处理二极显著高于处理一和对照;处理一显著高于对照。
层积75 d时,对照及3个GA处理胚率分别为36.99%、40.00%、40.84%和43.39%,以百分数计算,较层积60 d时增长率分别达37.1%、46.8%、40.4%和43.1%,是层积过程中胚率增长较快时期之一,其中处理一增长速率最快。各处理相比较,处理三极显著高于其他处理和对照;处理二和处理一极显著高于对照;处理二和处理一差异不显著。
层积90 d时,对照及3个GA处理胚率较上一取样时期分别增长4.61%、4.51%、4.97%和4.03%,以百分数计算,增长率为12.5%、11.3%、12.2%和9.3%,增长速率下降。其中处理三胚率增长速率最小,已完成形态后熟。各处理相比较,处理三极显著高于处理一和对照,显著高于处理二;处理二极显著高于对照,显著高于处理一;处理一极显著高于对照。
层积105 d时,对照及3个GA处理胚率分别为43.73%、45.36%、46.39%和47.85%,以百分数计算,较层积90 d时增长率分别达到5.1%、1.9%、1.3%和0.9%。此时,经GA处理后种胚发育完全,胚率增长速率缓慢,不再增加,而对照种胚持续增长,较其余处理胚率增长速率快。各处理相比较,处理三极显著高于其他处理;处理二极显著高于对照和处理一;处理一极显著高于对照。
层积结束后,各处理胚率均增加,赤霉素处理后胚率大于对照,其中处理三(GA浓度为400 mg·L-1)胚率最大,达47.85%。
2.3 层积过程中种子内主要营养物质动态变化
2.3.1 可溶性糖
不同浓度GA处理后老山芹种子可溶性糖含量动态变化如表1所示,层积过程中各处理可溶性糖含量变化趋势不同。
层积前老山芹种胚处于休眠状态,营养物质多处于大分子贮藏阶段,故可溶性糖含量低。经水和不同浓度GA浸泡24 h后对照及3个GA处理可溶性糖含量分别为184.67、223.56、223.50和235.68 mg·g-1,GA处理使分解酶活性提高,分解大分子有机物为小分子物质,故GA处理后可溶性糖含量较对照升高。各处理相比较,处理三极显著高于其他GA处理和对照;处理一和二与对照相比也表现出极显著差异,而处理一和二差异不显著。
层积至15 d时,由于种皮变软,种子吸水能力增强,导致代谢活动增强,贮藏物质分解加快。对照及3个GA处理可溶性糖含量快速增加。对照及3个GA处理可溶性糖含量分别为289.00、303.11、311.43和324.33 mg·g-1,与层积前相比分别增加56.5%、35.6%、39.3%和37.6%,此时处理三可溶性糖含量达到其层积过程峰值。对照可溶性糖含量增速最高,可能与其种胚发育较慢、消耗营养物质较少有关。各处理相比较,处理三极显著高于对照和其他GA处理;处理二极显著高于对照和处理一;处理一和对照相比也呈极显著差异。
层积至30 d时,可溶性糖被大量消耗用于种胚生长发育,各处理可溶性糖含量均显著下降。对照及3个GA处理可溶性糖含量分别为242.83、239.00、234.83和174.30 mg·g-1,其中处理三可溶性糖含量下降46%。各处理相比较,对照极显著高于3个GA处理;处理一极显著高于其他GA处理;处理二与三呈极显著差异。
层积至45 d时,对照及3个GA处理可溶性糖含量分别为270.54、259.83、221.50和145.33 mg·g-1,其中处理二和三可溶性糖含量分别下降5.7%和16.6%;对照及处理一含量升高,分别增加11.4%和8.7%。这种变化趋势与此期间处理二和三种胚发育较快有关。各处理相比较,对照可溶性糖含量极显著高于3个GA处理;处理一极显著高于处理二和处理三;处理二与处理三之间也呈极显著差异。

图3 不同浓度赤霉素处理下种胚胚率变化Fig.3 Changes of embyo rate under different concentrations of GA
层积至60 d时,对照及3个GA处理可溶性糖含量分别为 290.50、352.86、289.17和90.50 mg·g-1,除处理三外,其他处理可溶性糖含量均回升。对照、处理一和二可溶性糖含量分别增加7.4%、35.8%、30.6%,而处理三减少37.7%,降低至层积过程最低点。可能此时处理三种胚发育较快,子叶面积增加消耗大量可溶性糖。各处理相比较,处理一极显著高于其他处理;对照极显著高于处理二和三;处理二极显著高于处理三。
层积至75 d时,对照及3个GA处理可溶性糖含量分别为306.67、307.33、323.83和248.67 mg·g-1,与层积60 d时相比处理一降低12.9%,而对照、处理二和三分别增加5.6%、12.1%、174.8%。处理三可溶性糖含量大幅上升,可能与其种胚形态后熟完成、可溶性糖消耗减少有关。各处理相比较,处理二极显著高于其他各处理;处理一极显著高于处理三,而与对照无显著差异;处理三极显著低于对照。
层积至90 d时,对照及3个GA处理可溶性糖含量分别为315.61、235.00、329.33和204.17 mg·g-1,与层积75 d时相比处理一和三分别减少23.5%和17.9%;对照和处理二分别增加2.9%和1.7%,处理二达到层积过程最大值。各处理相比较,处理二极显著高于其他处理;对照极显著高于处理一和三;处理一极显著高于处理三。
层积至105 d时,对照及3个GA处理可溶性糖含量分别为343.58、288.50、311.17和318.67 mg·g-1,与层积90 d时相比较,对照、处理一和三分别增加8.9%、22.8%和56.1%,而处理二减少5.5%。各处理相比较,对照极显著高于其他各处理;处理三极显著高于处理一和二;处理二极显著高于处理一。
可溶性糖含量与多种物质代谢及种子生命活动有关,层积过程中各处理可溶性糖含量变化趋势不同,对照层积过程中可溶性糖含量除层积30 d外,其余取样点均呈上升趋势,且在105 d达到峰值;而经GA处理种子可溶性糖含量起伏变化较大,其中处理三(GA浓度400 mg·L-1)变化幅度较大。
2.3.2 淀粉
各处理老山芹种子淀粉含量动态变化见表2。随层积时间增加,各处理淀粉含量均呈下降趋势,但下降速率不同。
层积前各处理淀粉含量分别为23.63、22.14、22.08和21.98 mg·g-1,GA浸泡后提高淀粉酶活性,加速淀粉分解,因此GA处理后淀粉含量低于对照。各处理相比较,对照极显著高于3个GA处理;各GA处理之间差异不显著。
层积至15 d时,淀粉被分解为可溶性糖等小分子物质供种胚发育生长,含量迅速减少。对照和3个GA处理淀粉含量分别为20.19、19.35、19.22和18.28 mg·g-1,与层积前相比淀粉含量分别减少3.44、2.79、2.86和3.7 mg·g-1,减少幅度分别为14.6%、12.6%、13%和16.8%,其中处理三减少幅度最大。各处理相比,对照极显著高于GA处理;处理一和二极显著高于处理三;处理一和二之间无显著差异。

表1 层积过程中可溶性糖含量变化Table 1 Changes of soluble sugar contents during stratification processes (mg·g-1)

表2 层积过程中淀粉含量变化Table 2 Changes of starch contents during stratification processes (mg·g-1)
层积至30 d时,对照和3个GA处理淀粉含量分别为18.54、17.12、17.05和15.21 mg·g-1,与层积15 d相比分别减少1.82、2.23、2.17和3.07 mg·g-1,减少幅度分别为9.0%、11.5%、11.3%和16.8%,处理三仍保持较大减少幅度。各处理相比较,对照极显著高于其他处理;处理一和二极显著高于处理三;处理一和二之间无显著差异。
层积至45 d时,对照和3个GA处理淀粉含量分别为16.75、15.72、15.54和13.32 mg·g-1,与层积30 d相比减少幅度分别为9.7%、8.2%、8.9%和12.4%。各处理相比较,对照极显著高于其他处理;处理一和二极显著高于处理三;处理一和二之间无显著差异。
层积至60 d时,与层积45 d相比较,对照及3个GA处理淀粉含量分别减少3.59、4.44、3.76和3.21 mg·g-1,减少幅度分别为21.4%、28.2%、24.2%和24.1%。在此期间各处理淀粉含量减少幅度增加,可能与此时各处理种胚发育加快、淀粉被淀粉酶加速分解利用有关。各处理相比较,对照极显著高于其他处理;处理二极显著高于处理三,显著高于处理一;处理一极显著高于处理三。
层积至75 d时,对照和3个GA处理淀粉含量分别为10.69、10.16、9.51和6.77 mg·g-1,较上一取样点分别减少18.8%、9.9%、19.3%和33.0%。此阶段处理三可溶性糖含量迅速积累,为淀粉含量下降速率最快时期,种胚发育已进入子叶期胚阶段,子叶快速伸长需消耗大量营养物质。各处理相比较,对照极显著高于处理二和三,显著高于处理一;处理一极显著高于处理二和三;处理二和三之间也呈极显著差异。
层积至90 d时,对照及3个GA处理淀粉含量分别减少3.56、2.62、2.80和1.63 mg·g-1,减少幅度达33.3%、25.8%、29.4%和24.1%,其中,对照减少幅度最大。对照种胚发育相对滞后,此时子叶期胚阶段,营养物质消耗加快,淀粉大量被分解利用。各处理相比较,处理一极显著高于对照、处理二和三;处理二极显著高于对照和处理三;处理三极显著低于处理二。
层积至105 d时,对照及3个GA处理淀粉含量分别为5.87、5.79、5.58和4.57 mg·g-1,减少幅度分别为17.7%、23.2%、16.8%和3.7%,此时处理三大量种子发芽,淀粉含量变化最小。各处理相比较,对照极显著高于处理二和三,与处理一差异显著;GA处理之间也呈极显著差异;处理三极显著低于处理二。
2.3.3 可溶性蛋白
层积过程中对照及3个GA处理种子中可溶性蛋白含量动态变化见表3。层积过程中可溶性蛋白质含量变化波动较大,其中处理一、二与对照变化趋势一致,而处理三在层积后期变化趋势明显区别于其他处理。
层积前各处理可溶性蛋白含量分别为718.60、719.45、723.93 和 727.89 mg·g-1。其中对照可溶性蛋白含量最低,GA处理可增加可溶性蛋白含量,且GA浓度越高,可溶性蛋白含量越多。各处理相比较,处理三极显著高于其他处理;处理二极显著高于对照和处理一;处理一与对照差异不显著。
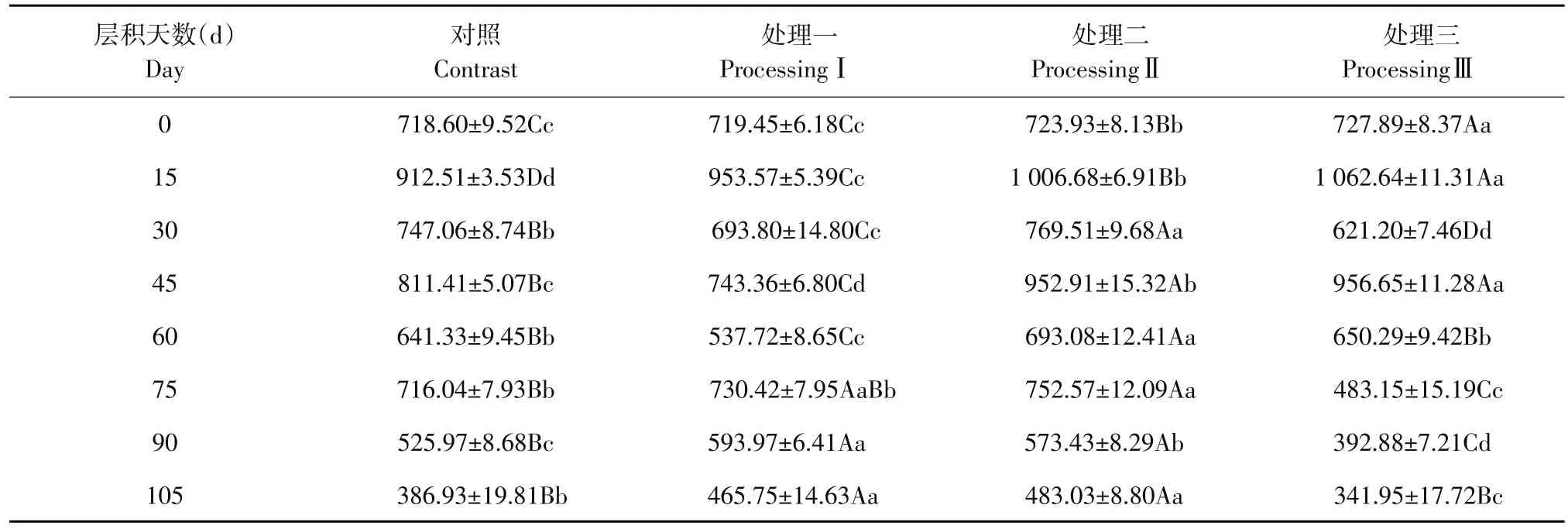
表3 层积过程中可溶性蛋白含量变化Table 3 Changes of soluble protein contents during stratification processes (mg·g-1)
层积15 d后,各处理可溶性蛋白含量较层积前分别增加193.91、234.12、282.75和334.75 mg·g-1,增长速率分别为27.1%、32.5%、39.1%和46.1%。层积过程中种子吸水吸膨后代谢活动逐渐活跃,可溶性蛋白含量迅速增加。其中处理三可溶性蛋白含量最高,增长速率最快,说明400 mg·g-1GA处理加速蛋白质合成。各处理相比较,处理三极显著高于对照及其他GA处理;处理二极显著高于处理一;处理一与对照之间也表现极显著差异。
层积至30 d时,各处理可溶性蛋白含量快速下降,对照及3个GA处理可溶性蛋白含量分别减少至747.06、693.80、769.51 和621.20 mg·g-1,下降速率达18.1%、27.2%、23.6%和41.5%,其中处理三下降速率最快,此时胚形态发生变化,可溶性蛋白被迅速分解为小分子物质,为种胚生长提供能量。各处理相比较,处理二极显著高于其他处理,对照极显著高于处理一和三;处理一极显著高于处理三。
层积至45 d时,各处理与上一取样点比较,对照和处理一可溶性蛋白含量小幅回升,分别增加64.35、49.56 mg·g-1,增长速率分别达8.6%、7.1%,处理二及三分别增加183.4、335.45 mg·g-1,增长速率分别达23.8%、54.0%,涨幅明显,且处理三达到层积过程中第二个峰值。处理二、三较对照和处理一种胚发育迅速,种子内部代谢活动旺盛,因此可溶性蛋白变化幅度较大。各处理相比较,处理三和二极显著高于对照和处理一;对照和处理一之间也呈极显著差异;处理三显著高于处理二。
层积至60 d时,各处理种胚持续生长发育,可溶性蛋白含量分别降至641.33、537.72、693.08和650.29 mg·g-1,较上一取样点减少170.08、205.64、259.83和306.36 mg·g-1,各处理下降速率分别为21.1%、27.7%、27.3%和32.0%,此时处理三可溶性蛋白消耗最多,种胚发育最快;对照消耗最少,代谢活动较弱,发育迟缓。各处理相比较,处理三极显著高于其他处理;处理三和对照均与处理一呈极显著差异;而对照和处理三之间差异不显著。
层积至75 d时,处理三可溶性蛋白含量持续下降,减少167.14 mg·g-1,下降速率为25.7%,此时处理三蛋白质消耗大于合成,可溶性蛋白被分解转化为糖等小分子物质被种胚生长利用。而对照、处理一和二可溶性蛋白含量上升,分别增加11.6%、35.8%和8.6%。此时各种酶活性增加,而大多数酶本质为蛋白质,因此可溶性蛋白含量上升。各处理相比较,处理二极显著高于对照和处理三;处理一极显著高于处理三;处理一和二之间无显著差异;对照和处理一之间也无显著差异。
层积至90 d时,对照及3个GA处理可溶性蛋白含量均下降,较上一取样点分别减少190.07、136.17、179.14 和 90.27 mg·g-1,下降速率分别为26.5%、18.7%、23.8%和18.7%,此时对照消耗可溶性蛋白最多,胚发育最晚。各处理比较,处理一和二极显著高于对照和处理三;对照极显著高于处理三;处理一显著高于处理二。
层积至105d时,对照及3个GA处理可溶性蛋白含量分别减少139.04、128.22、90.40和50.93 mg·g-1,下降速率分别达26.4%、21.6%、15.8%和13.0%,此时对照下降最多,处理三下降最少,由于对照种子在105 d时萌发种子较少,休眠未完全解除,因此仍需消耗较多可溶性蛋白为种子萌发提供营养物质。各处理比较,处理一和二极显著高于对照和处理三;对照和处理三之间呈显著差异;处理一和二之间无显著差异。
层积过程中可溶性蛋白质变化较为复杂,与未层积前相比各处理均减少,其中处理三在层积过程中出现两个峰值且均极显著高于对照,在层积60 d后持续下降,可溶性蛋白被不断消耗供种胚发育,种胚发育最快。
2.3.4 粗脂肪
各处理老山芹种子粗脂肪含量动态变化如表4所示。层积前粗脂肪含量8%。层积过程中脂肪逐渐被降解,总体呈下降趋势。层积前期下降较快,后期下降较慢。
层积前对照和3个GA处理种子粗脂肪含量分别为8.67%、8.78%、8.96%和8.82%。各处理相比较,处理二显著高于对照;对照、处理一和三之间差异不显著。
层积15 d后,种子内粗脂肪含量下降,但幅度较小。与层积前相比分别减少0.42%、0.64%、0.68%和0.37%,下降速率达4.8%、7.3%、7.6%和4.2%,其中处理二下降速率最大。各处理相比较,处理三极显著高于处理一,显著高于对照和处理二;处理一、二和对照之间均无显著差异。
层积至30 d时,对照和3个GA处理粗脂肪含量分别下降至7.73%、7.54%、7.25%和7.14%,与层积15 d相比下降速率分别为6.3%、7.4%、12.4%和15.5%。此阶段粗脂肪含量下降速率明显高于层积15 d,其中处理二和三粗脂肪含量下降速率高于对照和处理一。说明层积前较高浓度GA处理有利于层积过程中脂肪分解代谢。各处理相比较,对照极显著高于处理二和三,显著高于处理一;处理一极显著高于处理二和三;处理二和三之间差异不显著。

表4 层积过程中粗脂肪含量变化Table 4 Changes of crude fat contents during stratification processes (mg·g-1)
层积至45 d时,与层积30 d时相比粗脂肪含量分别减少0.36%、0.59%、0.53%和0.88%,与层积30 d相比下降速率分别为4.7%、7.8%、7.3%和12.3%。其中处理三仍保持较高下降速率,而其他处理下降速率变慢。各处理相比较,对照极显著高于处理二和三,显著高于处理一;处理一极显著高于处理三,与处理二差异不显著;处理三显著低于处理二。
层积至60 d时,对照及3个GA处理粗脂肪含量分别为6.74%、6.35%、6.13%和5.75%,与层积45 d相比下降速率分别为8.5%、8.6%、8.8%、8.1%,对照、处理一和二下降速率提高,其中对照提高3.8%,与此时对照种胚发育加快,需消耗较多营养物质有关。随GA浓度增加,粗脂肪含量逐渐减少,其中处理三含量最低。各处理间比较,对照极显著高于3个GA处理;处理一极显著高于处理三,显著高于处理二;处理二极显著高于处理三。
层积至75 d时,对照及3个GA处理粗脂肪含量较上一取样时期减少0.49%、0.51%、0.44%和0.57%,与层积60 d相比下降速率分别为7.3%、8.0%、7.2%和9.9%,除处理三外,其他处理下降速率均有不同程度减少,此时处理三种胚已发育完全。各处理相比较,对照极显著高于3个GA处理;处理一和二极显著高于处理三;处理一和二无显著差异。
层积至90 d时,对照及3个GA处理粗脂肪含量下降至5.65%、5.35%、4.84%和4.54%,与层积75 d相比下降速率分别为9.6%、8.4%、14.9%和14.4%,各处理下降速率均提高,其中处理二下降速率最快。各处理相比较,对照极显著高于其他处理;处理一极显著高于处理二和三;处理三极显著低于处理二。
层积至105 d时,对照和3个GA处理粗脂肪含量分别下降1.14%、1.01%、0.61%和0.43%,与层积90 d相比下降速率分别为20.2%、18.9%、12.6%和9.5%,其中对照和处理一分解速率加快,处理二和三分解速率减慢。各处理相比较,对照极显著高于其他处理;处理一极显著高于处理三,显著高于处理二;处理二与三差异显著。
在层积过程中粗脂肪含量不断下降,脂肪被分解利用,种胚逐渐完成后熟过程。GA处理促进作用以处理三(GA浓度为400 mg·L-1)效果最佳。
3 讨论
3.1 GA处理对种子层积效果的影响
具有活力的种子在条件适宜情况下仍无法萌发的现象称为种子休眠。种子休眠特性一方面利于种质资源保护,但也制约农业生产。层积以及GA处理是解除种子休眠常用方法。层积时将种子和基质(河沙、蛭石、珍珠岩等)在低温、高温和变温条件下混合放置。层积处理对种皮透性(透气、透水)、种胚发育、激素比、内源抑制物、相关酶活及基因启动均有影响[11]。研究表明,低温层积可有效消除紫椴种子发芽抑制物质的抑制作用,保持种子活力[12]。
外源GA影响种子内源激素含量,提高分解大分子物质酶(淀粉酶、蛋白酶、脂肪酶等)活性,促进物质代谢,加快种子后熟及萌发过程。500 mg·L-1GA处理提高节节麦发芽率[13];东北软枣猕猴桃等植物种子中也验证GA有利于解除种子休眠[14]。
对于休眠原因较为复杂种子,单一方法解除休眠效果差,需多种方法并用。研究结果表明,使用200 mg·L-1GA处理后再变温层积可有效打破圆齿野鸦椿种子休眠[15];层积前经高浓度GA处理缩短顽拗性三七种子后熟时间[16]。本研究结果表明,层积前400 mg·L-1GA溶液浸种24 h后再变温层积,使老山芹种胚提前30 d完成形态后熟过程,缩短层积时间,使种子尽早具备萌发能力。但本研究选用GA浓度过少,今后应增加对400 mg·L-1以上浓度处理层积效果研究,确定最佳GA处理浓度。
3.2 GA处理对层积过程中种子物质代谢的影响
在层积过程中,种子需充足物质和能量供应以维持其呼吸和其他代谢活动,营养物质源于种胚中贮藏物质,主要包括糖类、蛋白质和脂肪等。种子后熟是一个将大分子物质分解转化为小分子物质供种胚生长发育,直至解除休眠过程,这一过程中贮藏物质经历复杂的代谢变化。
可溶性糖作为呼吸作用底物,其含量反映种子内部糖类物质运转情况,也反映呼吸作用和代谢强弱,可作为种子休眠状态代谢标记[17]。不同浓度GA处理西洋杜鹃花瓣,随GA浓度增加,可溶性糖含量升高[18]。黄珍等研究表明,经GA3处理后,华重楼种子在0~15 d阶段可溶性糖呈下降趋势[19]。本研究结果表明,层积前期可溶性糖含量呈上升趋势,层积15 d后持续下降。因GA处理后增加淀粉酶活性,淀粉分解成可溶性糖,用于种胚生长发育。随种胚发育,可溶性糖被大量消耗,其含量开始下降。采用低浓度GA处理紫椴种子,可溶性糖含量也表现为前期快速升高趋势[20]。
淀粉是种子中主要贮藏物质,种子解除休眠过程中处于分解与合成动态平衡,一般前期合成占优势,后期以分解为主。刘月洋等研究表明,GA3处理诱导天女木兰种子内部淀粉含量下降[21]。
脂肪也是种子中主要贮藏物质之一,其贮存能力远高于糖类,可为种胚发育提供营养和能量。老山芹种子在解除休眠过程中,淀粉和脂肪保持下降趋势,层积后期下降趋势变缓。GA显著促进棉花种子脂肪降解[22]。
蛋白质含量是反映植物体内物质代谢重要生理指标,在种子解除休眠过程中,一部分蛋白被降解为游离氨基酸,用于蛋白质重组,另一部分经脱氨转化为各种糖类供种胚生长利用[23]。胥雪峰研究表明,GA3处理使黄芪可溶性蛋白含量呈先降后升趋势[24]。本研究中老山芹种子内可溶性蛋白含量变化趋势较为复杂,层积前期可溶性蛋白大量积累,之后下降,又呈上升趋势。由于GA增强淀粉酶、蛋白酶、脂肪酶等相关酶活性,提高种胚内部新陈代谢,贮藏物质之间相互转化,因此可溶性蛋白含量变化较大。
4 结 论
a.老山芹种子存在胚形态后熟现象,采收时多处于心形胚时期,在层积过程中种胚逐渐发育,完成形态后熟。
b.在层积过程中各处理淀粉和粗脂肪含量呈下降趋势;可溶性糖含量表现为先升后降趋势;可溶性蛋白含量变化较大,表现为先升后降再升再降趋势。
c.层积前经GA浸种24 h使种胚提前完成形态后熟,其中处理三(400 mg·L-1)效果最佳,与对照相比使种胚提前30 d完成形态后熟。

