河南地区22 673例女性HPV感染状况及分型研究*
吴道远,刘 慧,陈广军,王 坤,王 艺,张 贺
郑州大学附属肿瘤医院病理科,河南郑州 450008
宫颈癌是目前全球女性发病率及致死率排名前三的恶性肿瘤,每年约有52万的新增病例及26万的死亡病例[1]。调查研究显示几乎所有的宫颈癌发病都与人乳头瘤病毒(HPV)感染密切相关[2-3]。HPV是一种小型的球形双链环状DNA病毒,能引起人体皮肤黏膜的鳞状上皮增殖。目前已发现的HPV基因型达200余种,根据致病力强弱可分为高危型、疑似高危型和低危型,而高危型(如HPV 16和18)感染或双重、多重HPV感染使得宫颈癌的发病机制更加复杂[4]。因此,女性宫颈组织标本的大规模HPV筛查对于宫颈癌的早期预防和治疗具有重要意义。本研究选取郑州大学附属肿瘤医院妇科门诊与住院女性患者的宫颈脱落细胞22 673例,应用PCR和导流杂交法对HPV不同基因型感染的检测结果进行分析研究,为河南地区女性宫颈癌的流行病学特征研究及防治提供参考。
1 资料与方法
1.1一般资料 回顾性分析2015年4月至2019年4月于本院门诊就诊或住院的HPV可疑感染者(包括体检健康女性)共计22 673例的临床资料,年龄18~91岁,平均(47.2±10.8)岁。
1.2仪器与试剂 仪器选择Applied Biosystem 2720热循环PCR仪与HPV检测系统(潮州凯普生物化学有限公司,含HPV DNA提取试剂盒、HPV DNA扩增试剂盒、HPV分型检测试剂盒及HHM-2型医用快速杂交仪)。37种HPV分型检测试剂盒的分型定性检测包括HPV 16、18、31、33、35、39、45、51、52、56、58、59、66、68型14种高危型别,HPV 26、53、70、73、82型5种疑似高危型别,以及HPV 6、11、40、42、43、44、81(CP8304)、34、54、55、57、67、61、69、71、72、83、84型18种低危型别。
1.3标本采集与处理 就诊者非月经期采样,采样前3 d内禁止使用阴道内药物或对阴道进行冲洗,检查前阴道禁止进行醋酸或碘液涂抹,且就诊者24 h内无性行为。宫颈脱落细胞的取样由医生以窥阴镜暴露宫颈,用消毒棉拭子将宫颈过多分泌物擦去,将专用宫颈刷置于宫颈口顺时针轻轻旋转3~5圈后取出,放入专用细胞保存液后立即送检或放置4 ℃冰箱3 d内检测。
1.4检测方法 采用PCR和导流杂交法进行HPV分型检测。具体步骤:(1)DNA分离提取:取含有宫颈脱落细胞的细胞保存液0.5~1.0 mL,14 000 r/min离心1 min后弃上清,按凯普公司细胞裂解液(分离法)试剂盒说明书操作提取DNA;(2)PCR扩增:取1 μL抽提好的DNA样本作为模板进行PCR扩增,在每个反应管分别加入PCR试剂23.25 μL及DNA Taq酶0.75 μL,混合均匀后在PCR仪上进行扩增(每批次检测同时设置阴性对照与阳性对照);(3)杂交过程:取PCR产物在95 ℃下加热5 min后立即冰水浴2 min,随后按照试剂盒说明书在杂交仪中进行导流杂交(保持杂交液温度为45 ℃);(4)显色判读:按操作步骤进行显色反应后,取出杂交膜置于吸水纸上,通过肉眼观察显色的蓝紫色圆点与HPV探针排列图比对,从而判断阳性点为何种HPV类型(杂交显色质控点与PCR质控点均需为阳性)。
1.5统计学处理 采用SPSS18.0统计软件对数据进行统计分析,样本组间比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结 果
2.1HPV感染阳性率及亚型分布 在22 673例女性患者HPV筛查样本中,HPV感染阳性者共8 505例,HPV感染总阳性率为37.51%。HPV感染阳性率较高的亚型是HPV 16、52、58型,依次为13.76%、4.08%、4.02%。
2.2HPV感染类型分布 8 505例HPV感染阳性者中,HPV高危型、低危型、疑似高危型感染阳性者依次为5 117例(60.16%)、994例(11.69%)、804例(9.45%)。HPV混合感染情况比较见表1。
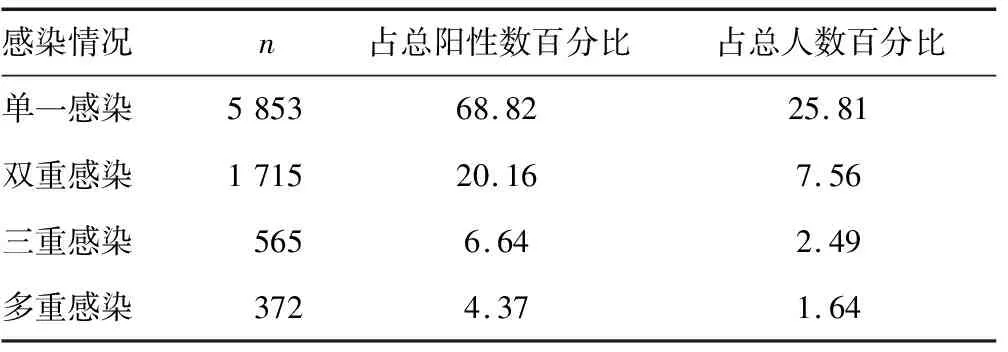
表1 HPV混合感染情况比较(%)
2.3不同年龄段间HPV感染情况比较 各年龄段HPV感染阳性者依次为18~<25岁114例(44.36%)、25~<35岁985例(33.53%)、35~<45岁2 387例(35.20%)、45~<55岁3 175例(38.00%)、55~<65岁1 380 例(43.62%)、65~≤91岁464例(39.39%)。18~<25岁与55~<65岁HPV感染阳性率较高,25~<35岁HPV感染阳性率最低。不同年龄段HPV感染阳性率比较,差异有统计学意义(χ2= 93.407,P<0.05)。
3 讨 论
HPV是无包膜的小型双链环状DNA病毒,颗粒呈球形,直径45~55 nm,DNA分子长度约7 900 bp。流行病学和分子生物学研究认为,HPV持续感染是导致宫颈癌发生的重要因素,其中高危型HPV感染更易导致癌前病变,进而诱发宫颈癌[5]。HPV感染宿主后,可以与宿主细胞染色体整合。整合后的DNA发生致癌作用的基因主要是E6、E7,大量HPV被持续转录成E6/E7 mRNA时,抑癌蛋白p53和Rb的表达将会受到显著抑制,导致细胞修复及凋亡途径失能,促使细胞癌变[5-6]。
有研究表明,不同国家、地区之间的HPV感染阳性率不尽相同[7]。世界范围内,非洲人群HPV感染阳性率最高[8]。对我国而言,澳门、浙江、福建等地区女性HPV感染阳性率相对较高,而新疆、山西、山东等地区HPV感染阳性率相对较低[9],这可能与各地区的环境气候、经济发展水平及生活习惯有一定关联。本研究结果显示,河南地区女性HPV感染总阳性率为37.51%,与文献[10-12]调查研究结果较为一致,而明显高于另一些HPV感染阳性率的调查统计结果[13-14]。近年来,部分地区的HPV感染阳性率呈上升趋势,HPV的早期筛查有助于及时发现和治疗癌前病变,降低宫颈癌发病率[15]。
年龄是HPV持续感染致病的主要危险因素[16]。本研究发现,18~<25岁与55~<65岁HPV感染阳性率较高,25~<35岁HPV感染阳性率最低。这与国内外研究结果基本一致[13,17]。年轻女性HPV感染阳性率最高,这或许与不适当的性行为有关,而老年女性再次出现HPV感染高峰,这可能与机体免疫力下降有关,研究结果提示应该对这两阶段的人群进行重点关注。从HPV感染亚型来看,河南地区HPV感染阳性率较高的亚型是HPV 16、52、58型,这与文献[18-21]研究结果一致。但是除了HPV 16亚型在全世界范围内常见外,其余亚型的感染分布均有一定的区域性,因此调查各地区HPV感染的流行型别,对于指导该地区女性宫颈癌的预防筛查、疫苗研究具有重要意义。
宫颈癌的发病率及病死率逐年上升,而HPV持续感染是导致宫颈癌发生的重要因素。本研究调查了河南地区女性HPV感染的特征与分型状况,对于高危型HPV感染的人群建议定期随访检测,早发现、早诊断、早治疗,以降低宫颈癌发病风险。

