胰激肽原酶对大鼠急性心肌梗死内皮祖细胞血管生成能力的影响
王苗,董小莉,王裕岱,黄玉冰,李斌,王圣,曹一秋
急性心肌梗死是心血管内科的常见病及急危重症,主要是因为单支或多支冠状动脉(冠脉)严重狭窄或闭塞导致心肌细胞缺血坏死,而心肌细胞不可再生,最终被纤维瘢痕组织取代,导致心力衰竭(心衰),有研究报道急性心肌梗死并发急性心衰的院内死亡率为20.9%[1]。该病最佳的治疗方法是尽早开通罪犯血管,避免过多的心肌细胞缺血坏死。然而,临床中并不是所有患者都能尽早开通罪犯血管,比如患者发病地点距离医院较远,需转运耗时;患者合并症多,需处理其他合并症;患方拒绝经皮冠状动脉介入治疗(PCI)及溶栓;患者经济困难等多种原因,导致后期患者出现缺血性心肌病,反复心衰发作,因此如何保护心肌细胞成为我们研究的课题。有研究认为刺激缺血区域血管新生,提高心肌细胞存活率,或在坏死区域补充再生的心肌细胞,可减少对心脏收缩功能的影响[2]。内皮祖细胞(EPCs)是可直接分化为血管内皮细胞的一种前体细胞,也是一类具有游走,增殖并能分化为血管内皮细胞[3]。其参与了缺血组织的血管新生,对于内皮再生与完整以及形成心血管具有重要意义[4]。已有研究显示EPCs作为组织工程化血管的种子细胞,能够减少缺血面积,增加缺血心肌的血供,改善左心室功能[5],但是具体的作用机制还不明确。阿司匹林为心肌梗死常见的基础性治疗药物,也具有调节循环中EPCs水平的作用,但是疗效的持续性不强[6]。胰激肽原酶为从猪胰腺组织中提取出来的一种蛋白水解酶,由238个氨基酸组成,又称胰激肽释放酶。其被机体吸收后可释放出激肽,加强毛细血管通透性,舒张微小血管,进而增加血流量改善微循环[7]。已有研究已证实了胰激肽原酶在改善糖尿病肾病及内皮细胞功能障碍方面具有很好的疗效[8]。本文具体探讨了胰激肽原酶对大鼠急性心肌梗死内皮祖细胞血管生成能力的影响,以明确胰激肽原酶的作用价值。现总结报道如下。
1 资料与方法
1.1 实验材对象及材料 所有动物相关实验均征得了实验用动物伦理委员会的同意,都获得了较好的人性化待遇,并严格按照有关原则与规定执行各项操作。45只同系雄性SD(Sprague-Dawley)大鼠(体重200~250 g)由本院实验动物中心饲养(购自上海市斯菜克实验动物有限责任公司)。饲养条件:屏障环境,4只一笼,标准饲料喂养,恒湿55%±5%,恒温22±2 ℃,人工光照明暗各12 h/d,24 h自由取食和饮水。胰激肽原酶购自中国常州市千红制药公司(批号20192322),阿司匹林购自拜耳医药保健有限公司(批号20188492),抗β-actin单克隆抗体、抗大鼠结缔组织生长因子(CTGF)抗体、抗血管内皮生长因子(VEGF)抗体都购自美国BD公司,小鼠抗大鼠CD133单抗与CD34单抗购自美国Santa Cruz公司。
1.2 动物分组与处理 所有动物都给予制备急性心肌梗死模型,水合氯醛(300 mg/kg)腹腔注射大鼠,然后仰卧固定。铺消毒巾,经口插管,接机械通气,通气参数:达到了30 ml/kg的潮气量,频率为80 次/min。在胸骨左缘扪及心脏搏动位置逐层切开,将心包剪开并且暴露出血管与心脏。进针位置为左心耳根部下方2 cm位置,以5/0缝线穿过心肌表层,出针位置为肺动脉圆锥旁,导致心肌梗死。造模成功标志:远端心肌迅速缺血变白。
将造模成功的42只大鼠(3只未造模成功的大鼠死亡)随机分为三组:模型组、实验1组与实验2组,每组各14只。分别给予蒸馏水、阿司匹林30 mg/kg/d、胰激肽原酶800 U/kg/d治疗。后两组分别将阿司匹林、胰激肽原酶研磨后溶于少量蒸馏水中,采用灌胃法给药,3/d。三组都持续给药8周。
1.3 观察指标 ①在给药后4周与8周采用超声心动图检测心功能,采用VIVID-7二维超声心动图(探头频率108 Hz),仔细观察心脏的形态等,测定左室收缩末内径(LVESD)及左室舒张末内径(LVEDD),取3个连续心动周期平均值记录数据。②在给药后8周麻醉所有大鼠,分离右侧颈总动脉,采用8道生理记录仪记录左室收缩末压(LVESP)及左室舒张末压(LVEDP)。③在给药后8周取大鼠的尾静脉采血0.5~1.0 ml,取其中100 μl全血,采用流式细胞检测CD34+细胞、CD133+细胞比例,其中横坐标为荧光强度,纵坐标为表达一定荧光强度的细胞数量。④上述检测完成后处死大鼠,快速分离心脏并清洗干净,以组织切割刀片截取心脏横断面,置入新鲜配制的2%四唑红(TTC)溶液中,37 ℃恒温避光水浴30 min后进行染色观察。⑤研磨心肌组织,提取总蛋白,采用免疫印迹法(Western blot法)检测CTGF、VEGF表达水平,以β-actin作为内对照。
1.4 统计学分析 所有数据使用SPSS 13.00统计学软件处理,计量数据均以均数±标准差表示,通过t检验来进行样本间均值比较,单因素方差分析(One-way ANOVA)分析来进行多个样本均值比较。以P<0.05为差异有统计学意义。
2 结果
2.1 不同组大鼠心脏超声对比 给药后4周与8周,实验1组、实验2组的LVEDD、LVESD值都低于模型组,实验2组也低于实验1组,对比差异都有统计学意义(P<0.05)(表1)。
2.2 不同组大鼠血流动力学对比 给药后8周,实验1组、实验2组的LVESP高于模型组,实验2组也高于实验1组;实验1组、实验2组的LVEDP值都低于模型组,实验2组也低于实验1组,对比差异都有统计学意义(P<0.05)(表2)。
2.3 不同组大鼠EPCs数量 对比给药后8周,实验1组、实验2组外周血的CD34+细胞、CD133+细胞比例都高于模型组,实验2组也高于实验1组,对比差异都有统计学意义(P<0.05)(表3)。
2.4 不同组大鼠心肌染色对比 模型组:心肌间质胶原纤维明显增生,心肌细胞肿胀,呈网格状包绕心肌细胞。实验1组:心肌细胞间胶原纤维减少,非梗死区心肌细胞肿胀,排列紊乱较模型组改善。实验2组:心肌细胞呈现正常组织结构,呈条索状与心肌纤维平行排列,仅见少量胶原纤维(图1)。
表1 三组大鼠心脏超声指标对比(mm,±s)
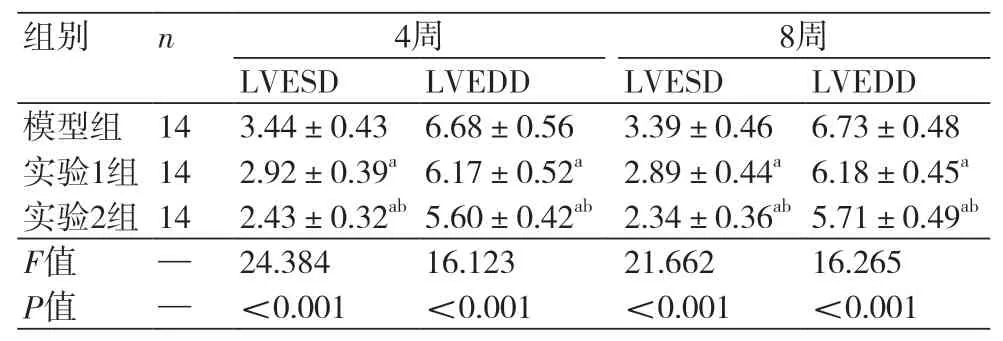
表1 三组大鼠心脏超声指标对比(mm,±s)
注:LVESD:左室收缩末内径;LVEDD:左室舒张末内径;与模型组对比,aP<0.05;与实验1组对比,bP<0.05
?
表2 三组大鼠血流动力学对比(mmHg,±s)

表2 三组大鼠血流动力学对比(mmHg,±s)
注:LVESP:左室收缩末压,LVEDP:左室舒张末压;与模型组对比,aP<0.05;与实验1组对比,bP<0.05
?
表3 三组大鼠外周血CD34+细胞、CD133+细胞比例对比(%,±s)

表3 三组大鼠外周血CD34+细胞、CD133+细胞比例对比(%,±s)
注:与模型组对比,aP<0.05;与实验1组对比,bP<0.05
?
2.5 不同组大鼠CTGF、VEGF蛋白表达水平对比给药后8周,实验1组、实验2组心肌组织CTGF、VEGF蛋白相对表达水平高于模型组,实验2组也高于实验1组,对比差异都有统计学意义(P<0.05)(表4)。
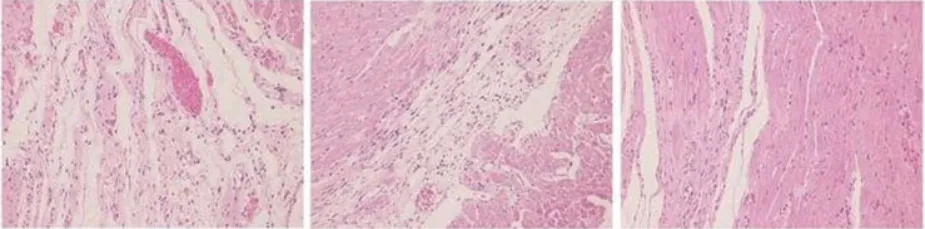
图1 三组心肌组织染色特征(左、中、右分别为模型组、实验1组和实验2组)

表4 三组大鼠心肌组织CTGF、VEGF蛋白表达水平对比(x ±s)
3 讨论
急性心肌梗死属于心血管疾病中较为严重的一种疾病,是导致患者死亡的一个重要原因。临床上的病理特征主要表现是心脏血供停止或者减少,从而损伤了心肌组织[9]。特别是梗死区坏死的心肌细胞则被纤维瘢痕组织代替,可诱发发生心室重构,从而导致心脏衰竭[10]。激肽释放酶可参与凝血和纤溶过程,主要通过自分泌和旁分泌途径对邻近细胞发挥重要的生物学作用。其能参与调节血压调节、电解质平衡、血管紧张性、炎症反应、纤维蛋白溶解等多个过程[11]。其中胰激肽原酶是一种含有唾液酸的糖蛋白,可作用于激肽原并裂解生成活性多肽,从而发挥生理学效应[12]。本研究显示给药后4周与8周,实验1组、实验2组的LVEDD与LVESD值都低于模型组,实验2组也低于实验1组,对比差异都有统计学意义(P<0.05);给药后8周,实验1组、实验2组的LVESP值都高于模型组,实验2组也高于实验1组,对比差异都有统计学意义(P<0.05),表明胰激肽原酶的应用能改善心肌梗死大鼠的心功能与血流动力学状况。也有研究显示胰激肽原酶能诱导血管内皮产生舒张因子,抑制肾素分泌,增加血管通透性及血管舒张,扩张小动脉,降低外周血管阻力,增加局部血流,也可调节肾脏组织对钠盐的排泄,从而调节机体心血管功能[13]。
急性心肌梗死具有病情凶险、病死率较高等特点,特别是可继发心功能不全,如不早期进行控制,可诱发形成充血性心力衰竭[14]。EPCs是血管内皮的前体细胞,也称为成血管细胞,可增殖并且可分化为血管内皮细胞[15]。在血管新生过程以及生产胚胎血管过程中,EPCs都有重要作用。EPCs可直接整合到已存在的血管内皮中,直接形成毛细血管,可通过磷脂酰肌醇3激酶/丝氨酸苏氨酸蛋白激酶等信号途径介导血管新生[16]。移植EPCs可促进机体生成新生血管,可使得内皮细胞增殖、迁移,以发芽的方式使血管得以延伸,从而增加梗死区血供并改善心功能[17]。本研究显示给药后8周,实验1组、实验2组外周血的CD34+细胞、CD133+细胞比例都高于模型组,实验2组也高于实验1组,对比差异都有统计学意义(P<0.05),表明胰激肽原酶的应用能增加EPCs数量。从机制上分析,胰激肽原酶可活化内皮舒张因子,使微血管扩张,微血管内血流速度加快,促使内皮细胞释放组织纤溶酶原激活物,使器官组织的血流灌注增加[18]。且其也可促使机体形成EPCs,从而在心肌局部微环境诱导下,分化为类心肌细胞,有利于顿抑心肌的复苏和梗死区内冬眠,从而促使梗死后心功能得到有效改善[19]。部分研究表明心肌梗死大鼠行外源性VEGF治疗,可达到心脏功能改善的目的,促进血管新生[20]。
在急性心肌梗死发生的过程中,可出现大量炎性细胞浸润,并且内皮功能严重降低,从而继发心肌损伤[21]。EPCs可由骨髓动员进入机体外周血循环中,从而参与血管新生和内皮损伤后的修复再生过程[22]。EPCs还可以通过旁分泌的形式分泌出多种细胞生长因子,包括CTGF、VEGF等,后者在促进内皮组织周围血管新生过程中发挥重要作用[23]。有研究也表明VEGF也可以动员骨髓EPCs向外周血迁移,进而参与损伤血管内皮的修复[24]。本研究显示给药后8周,实验1组、实验2组心肌组织CTGF、VEGF蛋白相对表达水平高于模型组,实验2组也高于实验1组,对比差异都有统计学意义(P<0.05)。从机制上分析,胰激肽原酶可保护并逆转心肌梗死后心肌细胞的肥大,减轻了剧烈的炎症反应对EPCs的损害,并保护现有心肌细胞,从而改善心功能,促进CTGF、VEGF的释放[25]。并且胰激肽原酶可扩张血管,可使肾脏血流量增多,降低外周血管阻力及调节肾脏组织对钠盐的排泄,从而扩大血管新生效应[26]。本研究也存在一定的不足,没有在镜下观察EPCs的变化情况,也没有进行细胞增殖与凋亡的检测,可能存在研究偏倚,将在后续研究中深入探讨。
总之,胰激肽原酶在大鼠急性心肌梗死中的应用能在一定程度上增加EPCs数量,改善心功能与血流动力学状况,激活CTGF、VEGF的表达,从而有利于血管生成。

